すべての治療ラインで免疫チェックポイント阻害薬が優位に
ネオアジュバント療法:NEOSTAR試験
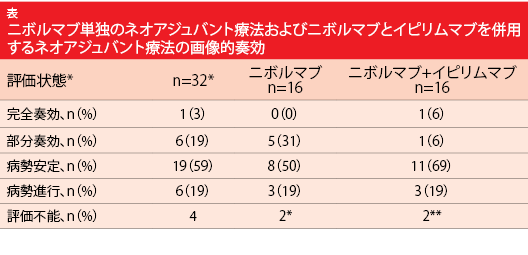
初期の局所進行(Ⅰ~ⅢA期)非小細胞肺がん(NSCLC)患者には通常、手術を行うことが多いが、長期転帰には不満が残る。手術だけを行った場合の再発率はかなり高く、50%を超えている[1]。再発防止策として周術期化学療法を行ったとしても、手術単独に比べて5年生存率がわずか5%改善するだけである [2、3]。そのため、腫瘍作用を強化し、微小転移巣を根絶するのを目標に、抗PD-L1抗体薬を用いるネオアジュバント療法を評価することになった[4]。 非盲検ランダム化試験の第Ⅱ相NEOSTAR試験では、手術を受けることを承諾しているⅠ~ⅢA期のNSCLC患者36人に、ニボルマブ3 mg/kgのみを3回(A群)もしくは、ニボルマブ3 mg/kgを3回とイピリムマブ1 mg/kgを1回(B群)、術前に投与した[5]。両群とも主要評価項目は、病理学的奏効(MPR、活動性のある腫瘍細胞が10%以下と定義)とした。ネオアジュバント療法後の生存期間の評価項目にはMPRを代用した。ニボルマブの単独投与やニボルマブとイピリムマブを併用投与する導入療法で、MPR率が40%には達すると予測した。この数値を達成するとプラチナ製剤ベースの導入化学療法でのMPR率を超えることになる。なお、両群間でMPRを比較する際に検出力は調整していない。
バイオマーカーから臨床活性を確認
患者の89%がネオアジュバント療法を完了し、84%が手術を受けた。手術を受けた群のMPR率は31%である。MPRを達成したのはA群で28%、B群で33%だった。手術を受けた群の組織標本に活性のある腫瘍細胞は認められなかった(A群は14%、B群は25%)。画像的完全 奏患者の89%がネオアジュバント療法を完了し、84%が手術を受けた。手術を受けた群のMPR率は31%である。MPRを達成したのはA群で28%、B群で33%だった。手術を受けた群の組織標本に活性のある腫瘍細胞は認められなかった(A群は14%、B群は25%)。画像的完全ルマブとイピリムマブの併用投与により増加することが見られた(p=0.048)。 著者らは結論の中で、この試験により、単剤のネオアジュバント療法に関するデータセットをさらに増やすことができ、複数の製剤を併用するネオアジュバント療法が広がると記した。ただ、各群の患者数が少なかったのでこの試験には限界がある。バイオマーカーの探索的分析は現在も行われている。
PACIFIC試験成績の事後解析
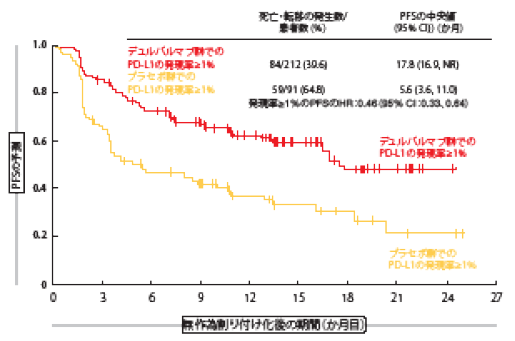
切除不能なⅢ期のNSCLC患者で、根治的化学放射線療法を受けた後に増悪した患者にはデュルバルマブを標準治療とすることが、PACIFIC試験の第Ⅲ相試験で定まった。この患者らを、デュルバルマブ10 mg/kgを隔週(Q2W)で最長12か月間投与する群(n=476)と、プラセボを投与する群(n=237)に無作為に割り付けた。無増悪生存期間(PFS:デュルバルマブ群16.8か月、プラセボ群5.6か月、HR:0.52、p<0.001)[6]、全生存期間(OS:デュルバルマブ群は判明せず、プラセボ群28.7か月、HR:0.68、 p=0.0025)[7]のどちらもデュルバルマブ群に有意な効果が見られた。同試験ではPD-L1検査は必須とせずにデュルバルマブを評価する、all-comer(全員参加)臨床試験である。なお、患者の37%でPD-L1の発現量は判明していない。同試験の成績を基に、デュルバルマブはAll comerを対象に日本および米国で承認を受けたが、EU加盟国では適応をPD-L1の発現率が1%以上の患者に限定して承認している。 本総会で発表のあったPACIFIC試験成績の事後解析は、PD-L1の発現率以外に、先に行った同時化学放射線療法で用いた抗がん剤、照射線量、放射線治療終了後から無作為割り付けまでの期間に分けて、その後の結果を調べている[8]。PD-L1に関する解析結果からは、PD-L1の発現率が1%以上あった患者にはPFS(デュルバルマブ群17.8か月、プラセボ群5.6か月、HR:0.46、図1)とOS(OS:デュルバルマブ群は判明せず、プラセボ群29.1か月、HR:0.53)に、デュルバルマブの効果のあることが示された。PD-L1の発現率が1%未満の患者ではPFSに顕著な改善が見られたが (デュルバルマブ群10.7か月、プラセボ群5.6か月、HR:0.73)、OSについてはプラセボ群のパフォーマンスによる交絡が生じた。デュルバルマブ群の場合、生存曲線は初めの12か月間はデュルバルマブに優勢になっており、投与期間の長さと一致している。一方、プラセボ群は追跡期間の状態が良好になっていた(HR:1.36)。プラセボ群にこのような良い結果が見られたのは、死亡や転移の数が少なかったこと、サブグループの人数が少なかったこと、そしてベースライン時の患者の特性に偏りがあったことでおそらく説明がつく。ここで重要なのは、PD-L1の発現率にかかわらず、安全性プロファイルの内容がほぼ同じであったことである。著者らによると、サブグループへの探索的事後解析には限界があるため、PD-L1の発現率別の結果について結論づけることはできないという。 また、事前に行った化学放射線療法の抗がん剤と照射線量の影響についても事後解析がなされている。抗がん剤の種類、照射線量、放射線治療終了後から無作為割り付けまでの期間にかかわらず、そのデータにはPFSとOSの両方にデュルバルマブの効果が一貫して見られた。有害事象についても、放射線治療終了後から無作為割り付けまでの期間にかかわらず同様な内容であった。化学放射線療法後にデュルバルマブを投与するPACIFIC試験の治療レジメンが、切除不能なⅢ期のNSCLCへの新たな標準治療になりうることを、同試験で得たデータが支持している。
図1:PACIFIC試験でデュルバルマブ群に割り付けられた、PD-L1発現率が1%以上の患者の無増悪生存期間の改善状態
Mpower130試験:化学療法にアテゾリズマブを追加する
Ⅳ期の非扁平上皮NSCLCへのファーストライン治療として化学療法にアテゾリズマブを追加するレジメンを、非盲検ランダム化試験の第Ⅲ相IMpower130試験で評価した[9]。カルボプラチンにnab-パクリタキセルを併用する化学療法にアテゾリズマブを追加する群を治療群(n=451)とし、アテゾリズマブを単独投与する群を対照群(n=228)とした。同試験で得た知見は、PD-L1の発現率によらず、アテゾリズマブ+化学療法が進行非扁平上皮NSCLCの治療の選択肢になりうることを支持する内容だった。同試験は、EGFR遺伝子変異あるいはALK融合遺伝子変異のある患者を除いて無作為に割り付けた野生型のITT解析対象集団の、PFSとOSの両主要評価項目の基準に合致した。化学療法にアテゾリズマブを追加することで、増悪と死亡のリスクが36%低下した(PFSの中央値は治療群で7.0か月、対照群で5.5か月、HR:0.64、p<0.0001)。死亡リスクについては21%低下し、OSが4.7か月になったことには統計学的有意性があり、臨床的意義もあった(治療群18.6か月、対照群13.9か月、HR:0.79、p=0.033)。12か月目のPFS率は、対照群に比べて治療群で2倍になった(治療群29.1%、対照群14.1%)。また、奏効率(ORR)も治療群で高くなり(治療群49.2%、対照群 31.9%)、奏効期間の中央値に有意な伸びがあったこと(治療群8.4か月、対照群6.1か月、p=0.0004)がデータで判明した。解析の時点で奏効状態が続いていたのは治療群の36.8%、対照群の19.4%である。 参加者の登録時に肝転移のあった患者を除いて、すべてのサブグループで全生存期間とPFSへの効果が見られた。また、治療群のPD-L1コホート全体(PD-L1高発現、同低発現、同陰性)にもPFSへの効果が見られた。OSに関してもPD-L1のサブグループの治療群に効果が見られたが、対照群との間に有意な差はなかった。EGFR遺伝変異陽性とALK融合遺伝子変異陽性のサブグループには、PFSとOSへの統計学的有意性のある効果は見られなかった。安全性プロファイルについては、化学療法にアテゾリズマブを併用してもアテゾリズマブ単独療法で見られた有害事象と変わりはなかった。なお、同試験で新たな安全性の問題点は見いだされなかった。
効果予測バイオマーカーとしてのbTMB
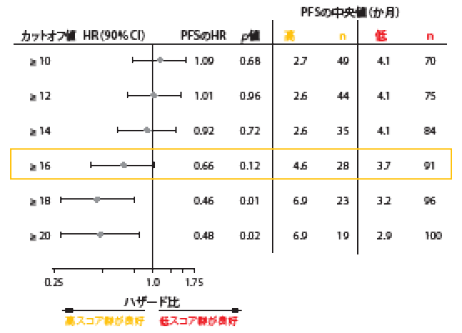
遺伝子変異量(TMB)は、免疫チェックポイント阻害薬向けの新たな効果予測バイオマーカーである。だが、TMBの検査に十分な量の腫瘍組織を必ず得られるという保証はない。そのため、侵襲性の低い方法として血中のTMB(bTMB)を測定することへの評価が始まっている。単群試験の第Ⅱ相B-F1RST試験の主要評価項目についてKimらが報告している。この試験は、アテゾリズマブ単独療法をNSCLCのファーストライン治療として行う場合、bTMBが効果予測バイオマーカーとして利用できるかを調べる初の前向き検証試験である[10]。PD-L1の発現率を問わず、全組織型のⅢB期およびⅣA期のNSCLC患者(n=152)に、増悪するまでアテゾリズマブ1,200 mgを3週間間隔(Q3W)で投与した。bTMBスコアのカットオフ値は16と規定した。ベースライン時の血液検体に測定可能な腫瘍遺伝子変異量のある患者が合計で119人おり、効果予測バイオマーカーの評価対象集団(BEP)となった。このうちbTMBスコアが低い(16未満)患者は91人、bTMBスコアが高い(16以上)患者は28人である。 有効性の主要評価項目である試験責任医師が評価するORRはBEPで10.1%にのぼり、奏効率についてはbTMBの低スコア群よりも高スコア群に有意な改善を認めた(高スコア群28.6%、低スコア群4.4%、p=0.0002)。探索解析結果からは、カットオフ値をより高くすると奏効率が改善することが示された。カットオフ値を20以上に設定すると、高スコア群で36.8%、低スコア群で5.0%とより大差がついた(p<0.0001)。なお、この時点では高スコア群の奏効期間の中央値はまだ判明していない。PFSに関しても低スコア群に比べて高スコア群で改善していたが、有意な差ではなかった(高スコア群4.6か月、低スコア群3.7か月、HR:0.66、p=0.12)。9か月目のPFS率は高スコア群で37.4%、低スコア群で9.7%である。OSのデータはこの時点でまだそろっていなかった。bTMBをカットオフ値別(10以上、16以上、20以上)に評価したところ、高スコア群にPFSとOSの両方に改善が見られた(図2)。PFSとOSについては、カットオフ値16以上が有効性の転換点だろう。アテゾリズマブの忍容性は高く、bTMBについては現在、第Ⅲ相前向きランダム化試験で検証が行われている。
図2:B-F1RST試験での無増悪生存期間をbTMBのカットオフ値別に示したフォレストプロット
ペンブロリズマブの長期転帰:KEYNOTE-010試験
治療経験があり、PD-L1が発現している進行NSCLC患者を対象にした非盲検ランダム化試験の第Ⅲ相KEYNOTE-010試験では、ドセタキセル群よりも2通りの用量のペンブロリズマブ単独療法群にOSへの高い効果が見られた[11]。本総会ではHerbstらが、30か月延長した追跡期間のOSと安全性に関する成績のほか、ペンブロリズマブ療法を35サイクルまたは2年間の治療を完遂した患者の転帰を報告した[12]。 解析結果によると、ドセタキセル群に比べてペンブロリズマブ群でOSの延長が続いている。腫瘍細胞のうちPD-L1発現が陽性になる細胞の割合を表すTPSが50%以上の患者で、36か月目に生存していたのはペンブロリズマブ群の 35%、ドセタキセル群の13%だった(OSの中央値はペンブロリズマブ群が16.9か月、ドセタキセル群が8.2か月、HR:0.53、p<0.00001)。TPSが1%以上の患者の場合は、前者が23%、後者が11%である(OSの中央値はペンブロリズ ブ群が11.8か月、ドセタキセル群が8.4か月、HR:0.69、p<0.00001)。 79人の患者がペンブロリズマブ療法を35サイクルまたは2年間の治療を完遂した。独立評価委員会の判定によると、この患者群の95%が完全奏効または部分奏効に達している。解析時点で奏効状態が持続していたのは64%である。この時点では奏効期間の中央値だけでなく、PFSおよびOSの中央値にもまだ達していなかった。36か月目には98.7%の患者が生存しており、そのうち70.3%には増悪も認められなかった。ペンブロリズマブ療法を35サイクルもしくは2年間の治療の終了後、25人に病勢進行が見られた。そのうち14人が2コース目のペンブロリズマブ療法を始めることができ、部分奏効率は43%に達した。36%の患者が安定と判定された。ペンブロリズマブ療法を35サイクルまたは2年間の治療を完遂した患者のものも含めて、この薬剤の長期間の安全性プロファイルがコントロール可能であることが証明された。
参考文献:
- Howington JA et al., Treatment of stage I and II non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013; 143(5 Suppl): e278S-e313S
- Pignon JP et al., Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008; 26(21): 3552-3559
- NSCLC Meta-analysis Collaborative Group, Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data. Lancet 2014; 383: 1561-1571
- Forde PM et al., Neoadjuvant PD-1 blockade in resectable lung cancer. N Engl J Med 2018; 378(21): 1976-1986
- Cascone T et al., NEOSTAR: neoadjuvant nivolumab or nivolumab plus ipilimumab for resectable non-small cell lung cancer. ESMO 2018, abstract LBA49
- Antonia SJ et al., Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med 2017; 377(20): 1919-1929
- Antonia SJ et al., Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC. N Engl J Med 2018 Sep 25. doi: 10.1056/NEJMoa1809697
- Faivre-Finn C et al., Exploratory analyses of overall survival in PACIFIC. ESMO 2018, abstract 13630
- Cappuzzo F et al., IMpower130: efficacy and safety from a randomised phase 3 study of carboplatin and nab-paclitaxel with or without atezolizumab in 1L advanced non-squamous NSCLC. ESMO 2018, abstract LBA53
- Kim ES et al., Primary efficacy results from B-F1RST, a prospective phase II trial evaluating blood-based tumour mutational burden (bTMB) as a predictive biomarker for atezolizumab in 1L non-small cell lung cancer (NSCLC). ESMO 2018, abstract LBA55
- Herbst RS et al., Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387(10027): 1540-1550
- Herbst RS et al., Long-term survival in patients with advanced NSCLC in the KEYNOTE-010 study overall and in patients who completed 2 years of pembrolizumab. ESMO 2018, abstract LBA63
More posts
インタビュー:EGFR TKI療法の順番を重視するいくつかの理由
インタビュー:EGFR TKI療法の順番を重視するいくつかの理由 著者所有 Maximilian Hochmair, MD、オーストリア・ウィーン、Otto Wagner
EGFR遺伝子変異陽性肺がん:活性および耐性に関する新たな知見とは?
EGFR遺伝子変異陽性肺がん:活性および耐性に関する新たな知見とは? エルロチニブをネオアジュバント療法に使用する ⅢA~N2期のNSCLC患者に現在行っている集学的治療に
すべての治療ラインで免疫チェックポイント阻害薬が優位に
すべての治療ラインで免疫チェックポイント阻害薬が優位に ネオアジュバント療法:NEOSTAR試験 初期の局所進行(Ⅰ~ⅢA期)非小細胞肺がん(NSCLC)患者には通常、手術
巻頭言
巻頭言 著者所有 Sanjay Popat, PhD, FRCP 英国・ロンドン 王立マーズデン病院 胸部腫瘍内科コンサルタント 臨床医の皆様へ 欧州臨床腫瘍学会(ESM