まれな遺伝子変異:治療を一歩先へ進める
GEOMETRY mono-1試験:MET遺伝子変異陽性NSCLCへのカプマチニブ投与
NSCLC患者の3%から4%にMETエクソン14スキップ変異(METex14)を認める、という報告がある[1~3]。この遺伝子変異は予後だけでなく、免疫療法といった標準治療への反応が不良になることと関係している[4~8]。その上、MET遺伝子変異のある患者は高齢であることが多いため、忍容性を改善する対策が必要になる。カプマチニブは、非常に高い選択性とMET阻害作用を持つ薬剤として開発されており、MET遺伝子変異を生じさせたがん動物モデルに対してin vitroとin vivoの両方で効果を示している[9]。
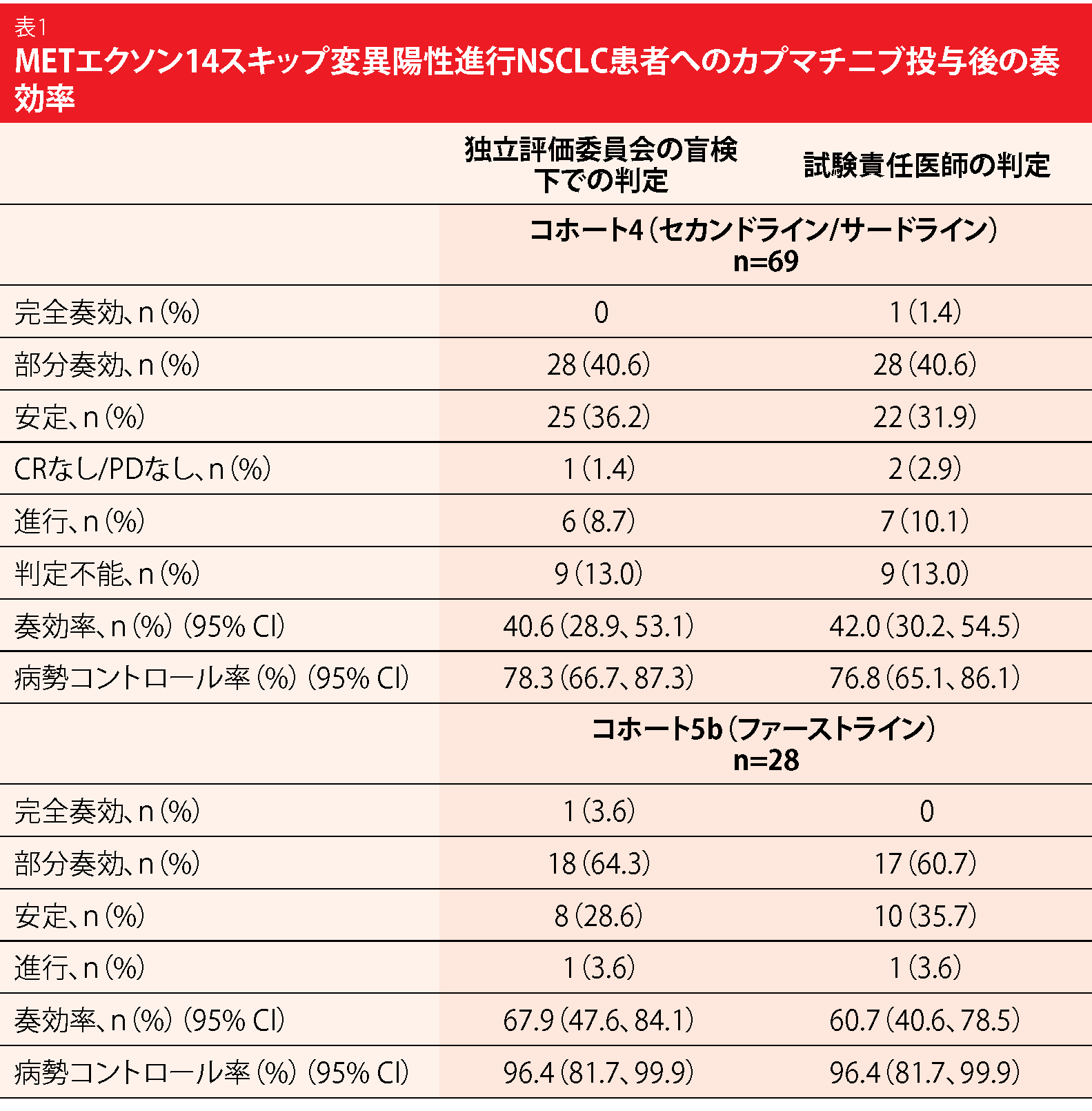
第Ⅱ相多施設共同マルチコホートGEOMETRY mono-1試験では、ⅢB期およびⅣ期のNSCLC患者で、 METex14を検出した患者を対象に、カプマチニブ400 mgの1日2回投与について調べているESMO 2018で発表のあった、有効性に関する先行データには、治療ラインだけでなく中枢神経系への臨床活性の程度にかかわらず、最大の腫瘍縮小の程度(奏効の深さ)が見られた[10]。本学会ではWolfらが、コホート4およびコホート5bへの有効性に関する一次解析結果を発表した[11]。コホート4ではセカンドライン治療やサードライン治療として投与したカプマチニブの有効性などを評価している(n=69)。それに対してコホート5bは治療歴のない患者(n=28)で構成した。コホート4の74%は治療ラインを1つは受けており、88.4%はプラチナ製剤ベースの化学療法を受けていた。両コホートの大部分の患者からはMET遺伝子増幅も検出した。各コホートを別々に解析して、前向きの独立した統計学的仮説を立てた。独立評価委員会が盲検下(BIRC)で判定したORRを主要評価項目とした。
頭蓋外・頭蓋内への作用
BIRCが判定したコホート4のORRは40.6%、副次評価項目の中で最重要視したDCRは78.3%となった(表1)。一方、コホート5bのORRは67.9%、DCRは96.4%だった。両コホートに、しっかりとした腫瘍縮小効果が急速に現れた。奏効期間の中央値はコホート4が9.72か月、コホート5bが11.14か月である。12か月目の無増悪生存率はコホート4が25.8%、コホート5bが49.7%、PFSの中央値は前者が5.42か月、後者が9.69か月だった。いずれの転帰も独立評価委員会と試験責任医師の間で一致していた。カプマチニブが脳転移巣に活性を示したことを神経放射線科の専門医が確認している。ベースライン時にCNS病変を認めた患者で、評価可能な13人のうちの7人を頭蓋内奏効と判定した。このうち4人の転移巣はすべて完全奏効の判定を受けた。頭蓋内の転移巣が病勢コントロールできていると判定されたのは12人である。頭蓋外と同様に頭蓋内でも急速な奏効が見られた。
METex14単独やMET遺伝子増幅との共存につながるタイプのMET遺伝子変異の存在にかかわらず、強い腫瘍縮小効果が持続したことを試験責任医師らが見いだした。腫瘍組織からのMETex14の検出感度の高さが、次世代シーケンシングと逆転写ポリメラーゼ連鎖反応の両方で示されており、一致率は99%に及んだ。ほかのドライバー遺伝子と同様に、今回の患者コホートの遺伝子変異量は野生型のMET遺伝子を検出したNSCLC患者に比べても低く(腫瘍細胞の遺伝子変量の中央値:6変異/メガベース(mut/Mb))、どの治療ラインでも同じ程度だった。
安全性解析のデータセットは、MET遺伝子変異陽性NSCLC患者のものとしては現在でも最大のデータセットである(n=334)。カプマチニブの忍容性は高く、グレード3や4のAEはわずかしか発現していない。特に報告の多かったAEは末梢性浮腫、悪心、クレアチニン増加だった。治療関連AEの発現により用量調節を必要としたのは21.9%、投与中止を必要としたのは11.1%の患者だった。コホート5bの患者のORRが良好だったことから、早い段階で遺伝子検査を行う重要性を、著者らは要旨の中で指摘した。MET遺伝子変異を検出している進行NSCLC患者で、極めてまれだが治療が困難になる患者にとって、カプマチニブは新しい治療の選択肢になる可能性がある。
テポチニブ:VISION試験
テポチニブは選択性の高い強力な、もう1つのMET阻害薬である。ⅢB期およびⅣ期のすべての組織型のNSCLC患者で、組織生検もしくはリキッドバイオプシーでMET遺伝子変異陽性を検出した患者を対象にした、第Ⅱ相単群VISION試験でその有効性と安全性を評価している。METエクソン14スキップ変異のある患者を割り付けたコホートAには、疾患が増悪するまでテポチニブ500 mgを1日1回投与している。テポチニブをファーストライン治療、セカンドライン治療、サードライン治療に使用した。独立評価委員会が判定したORR(主要評価項目)そして副次評価項目の一部を含む、コホートAの中間解析結果をPaikが発表した[12]。解析時点では87%の患者が投与を受けていた。
独立評価委員会が判定したテポチニブによるORRは、リキッドバイオプシーの結果に基づいたものが50.0%、組織生検に基づいたものが45.1%となり、奏効期間は前者に基づいたものが12.4か月、後者に基づいたものが15.7か月だった。病勢コントロール率については前者が66.7 %、後者が72.5%である。テポチニブの臨床活性はいずれの治療ラインでも同一だった。腫瘍縮小効果についても同様で、ファーストラインとセカンドラインで効果ありと独立評価委員会と試験責任医師の双方が判定した患者は92%に上った。サードライン以降の治療で腫瘍縮小効果が認められた患者は75%以上となった。すべての治療ラインで治療が早期に奏効し、しっかりとしていた。すべての解析対象集団で奏効期間の中央値が1年を超え、全体で14.3か月になった。ベースライン時に脳転移巣を認めた患者群にも、同等の治療効果があった。コホートA全体のPFSの中央値は、リキッドバイオプシーに基づいたものが9.5か月、組織生検に基づいたものが10.8か月だった。
同試験での安全性プロファイルも良好な内容で、発現率が最高レベルだったAEは末梢性浮腫、悪心、下痢となり、グレード4やグレード5の治療関連AEの報告はなかった。テポチニブがMETエクソン14スキップ変異のある患者に確実な臨床活性を示したことから、今後が期待できると試験責任医師らは結論づけた。同試験は現在も継続中で、METエクソン14スキップ変異はないがMET遺伝子増幅を認める患者で構成した、コホートBの成績が今後発表される。
RET融合遺伝子陽性NSCLCの新薬BLU-667
RET融合遺伝子がNSCLC患者から検出される率はおよそ1~2%である[13、14]。この遺伝子変異を認める患者には、化学療法や免疫療法、マルチキナーゼ阻害薬といった既存の治療法に顕著な効果が見られないため、そこにアンメットニーズがある[15~17]。RET遺伝子の選択的阻害薬として承認を受けたものはいまだない。
RET融合遺伝子変異そして薬剤耐性変異を強力かつ選択的に阻害する、新薬のBLU-667が[18、19]、アンメットニーズを満たすことになるかもしれない。 第I相ARROW試験の成績をGainorらが発表した[20]。同試験の用量漸増期の結果を基に、BLU-667の推奨用量を400 mgの1日1回投与と決定した。様々な種類のRET遺伝子変異を検出している進行性の固形がん患者を、現在、用量拡大期の7コホートに割り付けしている。症状がなければ脳転移巣のある患者も参加可能とした。2つのコホートにはNSCLC患者が割り付けられ、1つのコホートはプラチナ製剤による治療歴のない患者で構成し、もう1つのコホートはその治療歴のある患者で構成した。後者はこれまでに中央値にして2つの治療ラインを受けている。全NSCLC患者のうちの40%にCNS病変が認められた。RET遺伝子と融合した遺伝子は主にKIF5B遺伝子(66%)とCCDC6遺伝子(13%)だった。同試験での主要評価項目はORRおよび安全性である。
臨床効果とRET融合遺伝子の消失
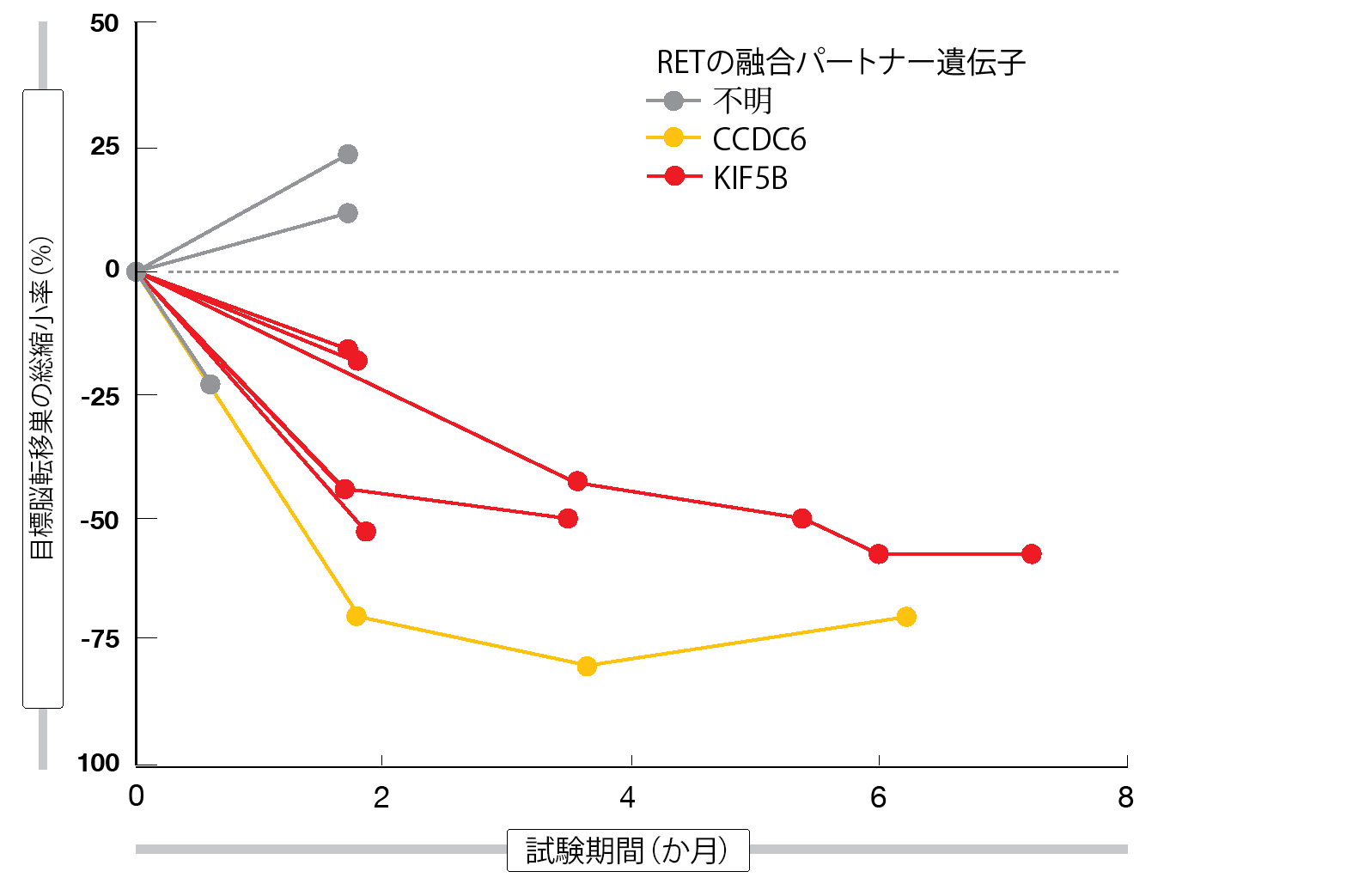
治療経験者が35人を占めたNSCLC患者48人を対象に行った有効性の事前解析結果によると、BLU-667は広範囲にしっかりとした抗腫瘍活性を示し、ORRはコホート全体で58%、治療歴のある患者群では60%になった。DCRについては前者が96%、後者が100%になっている。奏効を得た時期の大部分は、追跡期間中の1回目の画像検査を行うまでの間だった。データカットオフの時点でも奏効した患者の82%が投与を続けており、その時点では奏効期間の中央値には達していなかった。用量漸増期も含めると患者が投与を受けた期間は最長で24か月になる。免疫チェックポイント阻害薬の使用、RET融合遺伝子の遺伝子型、脳転移の有無にかかわらず、BLU-667の効果は持続した。ベースライン時に未治療の測定可能な脳転移巣があった患者9人のうちの7人に、その脳転移巣の縮小が認められた(図)。初回用量400 mgを1日1回投与した患者のうち、脳転移巣の新たな発現により増悪した患者はいなかった。ベースライン時にRET融合遺伝子のctDNAを検出した患者20人のうちの18人では、1コース目が終了するまでにctDNAが消失していた。
120人の安全性解析対象集団のうち91人が、プラチナ製剤ベースの化学療法を受けている。BLU-667の忍容性は高く、毒性についてはグレードの低いものが多く可逆的で、薬剤選択性のプロファイルと一致していた。非常によく見られたAEは便秘、好中球減少症、トランスアミナーゼ値上昇、疲労、高血圧だった。グレード3以上のAEの発現率は、好中球減少症、高血圧ともに13%だった。治療関連AEの発現により、合計で7%の患者へのBLU-667の投与が中止となった。著者らが述べるように、同試験の用量拡大期に入っても治療歴のないNSCLC患者にBLU-667を投与できることが、以上の結果から判明した。
図:BLU-667投与を受けたRET融合遺伝子陽性NSCLC患者における脳転移巣の縮小効果
ラロトレクチニブの説得力のある臨床活性
NTRK融合遺伝子はさまざまな悪性腫瘍で検出されており、その率は固形がん全体で1%と推測されている[21]。このクラスでは初となる、選択性の高いTRK阻害薬のラロトレクチニブの強固な有効性が、腫瘍の種類や年齢を問わず、109人分の拡大臨床データセットから示された[22]。局所進行性あるいは転移性の固形がんの成人患者83人に、3つの臨床試験(NCT02122913[SCOUT]、NCT02637687[NAVIGATE]、NCT02576431の第Ⅰ相試験に参加した成人患者)でラロトレクチニブ100 mgを1日2回投与した場合の有効性と安全性をHongらが検証した[23]。3試験で対象になった患者の固形がんの種類は12種類で、肺がんの診断を受けているのはそのうちの13%である。
いずれの患者集団にもラロトレクチニブはしっかりとした高い効果を見せた。独立評価委員会が判定したORRは68%で、17%の患者がCRと判定され、51%がPR、15%がSDと判定された。腫瘍の種類にかかわらず奏効が見られている。中央値にして17.5か月追跡した時点では、治療効果判定を受けた患者らの奏効期間の中央値にはまだ達していなかった。治療が奏効した患者の79%では、奏効期間が12か月を超えるものと推測した。PFSの中央値は25.8か月で、OSの中央値にはまだ至らなかった。
ラロトレクチニブの忍容性は高く、発現したAEの大半はグレード1もしくはグレード2だった。AEとして非常に多く見られたのは疲労(40%)、めまい(36%)、悪心(29%)である。これらのデータは、原発巣の部位を問わず、進行性の固形がんをわずらう成人患者のTRK融合遺伝子の検査を行うことを強く支持する内容になっていた。
NRG1融合遺伝子陽性肺がんの特徴
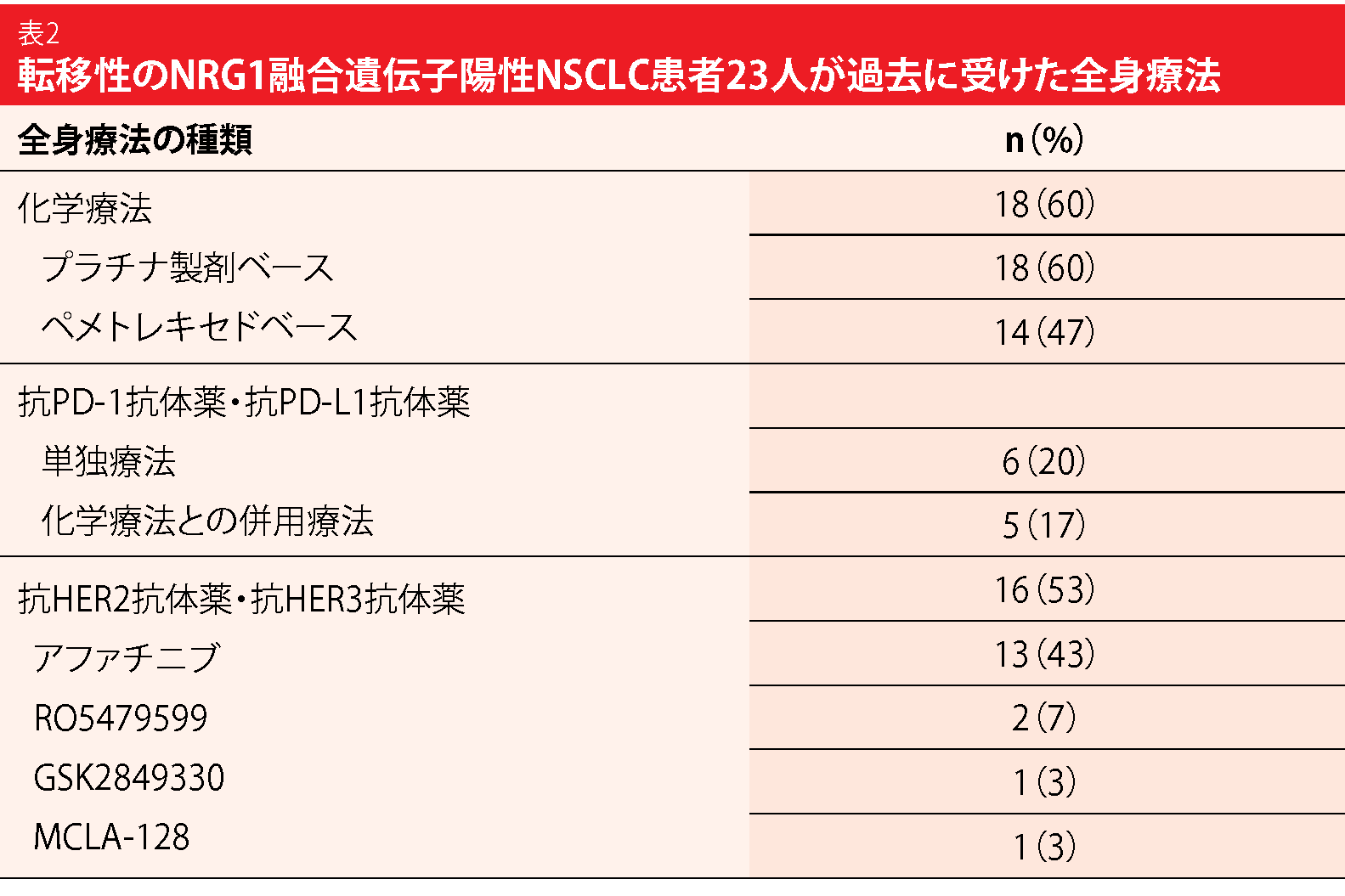
肺腺がん患者のおよそ1.7%からはNRG1融合遺伝子が検出される。同融合遺伝子がHER2-HER3シグナルを活性化するため、抗HER3抗体薬や抗HER2抗体薬を使用することには妥当性がある。しかし、NRG1融合遺伝子陽性肺がんの臨床病理学的特徴や遺伝子の特徴だけでなく、大規模な数の患者に行う全身療法の有効性を示すエビデンスも不足している。そこで、8か国の医療機関17施設の、胸部腫瘍科の専門医から成る国際共同多施設レジストリーを、Duruisseauxらが立ち上げた[25]。このレジストリーを通じて117人のNRG1融合遺伝子陽性NSCLC患者を特定した。臨床病理学的特徴や遺伝子の特徴と、臨床転帰のデータをそれぞれ集めた。
23人の患者から全身療法の有効性に関するデータが得られた。そのうちプラチナ製剤ベースの化学療法を受けた患者は18人である(表2)。そのうち2人がPR(11%)の判定を受け、9人がSD(50%)の判定を受けた。アファチニブの単独療法を受けた患者および他の薬剤との併用療法を受けた患者では(n=13、有効性のデータを得られたのは12人)、1人がCR(8%)の判定を受け、3人がPR(25%)、2人がSD(17%)の判定を受けた。2人の奏効期間は1年を超えた。アファチニブ単独・併用群のPFSの中央値は2.0か月で、OSの中央値の時期には達していなかった。ただ、転移巣の病期の診断を受けてからのOSについては、アファチニブの投与にかかわ
らず、患者群の間に差異は認められなかった。抗PD-1抗体薬・抗PD-L1抗体薬の単独療法を受けた患者群に奏効は認められず、免疫化学療法を受けた患者群でも同様だった。
参考文献:
- Ma PC, MET receptor juxtamembrane exon 14 alternative spliced variant: novel cancer genomic predictive biomarker. Cancer Discov 2015; 5(8): 802-805
- Reungwetwattana T et al., The race to target MET exon 14 skipping alterations in non-small cell lung cancer: The Why, the How, the Who, the Unknown, and the Inevitable. Lung Cancer 2017; 103: 27-37
- Tong JH et al., MET amplification and exon 14 splice site mutation define unique molecular subgroups of non-small cell lung carcinoma with poor prognosis. Clin Cancer Res 2016; 22(12): 3048-3056
- Dimou A et al., MET gene copy number predicts worse overall survival in patients with non-small cell lung cancer (NSCLC); a systematic review and meta-analysis. PLoS One 2014; 9(9): e107677
- Guo B et al., Prognostic value of MET gene copy number and protein expression in patients with surgically resected non-small cell lung cancer: a meta-analysis of published literatures. PLoS One 2014; 9(6): e99399
- Sabari JK et al., PD-L1 expression, tumor mutational burden, and response to immunotherapy in patients with MET exon 14 altered lung cancers. Ann Oncol 2018; 29(10): 2085-2091
- Baba K et al., Efficacy of pembrolizumab for patients with both high PD-L1 expression and a MET exon 14 skipping mutation: A case report. Thorac Cancer 2019; 10(2): 369-372
- Reis H et al., MET expression in advanced non-small-cell lung cancer: Effect on clinical outcomes of chemotherapy, targeted therapy, and immunotherapy. Clin Lung Cancer 2018; 19(4): e441-e163
- Baltschukat S et al., Capmatinib (INC280) is active against models of non-small cell lung cancer and other cancer types with defined mechanisms of MET activation. Clin Cancer Res 2019; 25(10): 3164-3175
- Wolf J et al., Results of the GEOMETRY mono-1 phase II for evaluation of the MET inhibitor capmatinib (INC280) in patients with METΔex14 mutated advanced non-small cell lung cancer. ESMO 2018, abstract LBA52
- Wolf J et al., Capmatinib (INC280) in METΔex14-mutated advanced non-small cell lung cancer (NSCLC): efficacy data from the phase II GEOMETRY mono-1 study. J Clin Oncol 37, 2019 (suppl; abstr 9004)
- Paik PK et al., Phase II study of tepotinib in NSCLC patients with METex14 mutations. J Clin Oncol 37, 2019 (suppl; abstr 9005)
- Lipson D et al., Identification of new ALK and RET gene fusions from colorectal and lung cancer biopsies. Nat Med 2012; 18(3): 382-384
- Takeuchi K et al., RET, ROS1 and ALK fusions in lung cancer. Nat Med 2012; 18(3): 378-381
- Mazieres J et al., Efficacy of immune-checkpoint inhibitors (ICI) in non-small cell lung cancer (NSCLC) patients harboring activating molecular alterations (ImmunoTarget). J Clin Oncol 36, 2018 (suppl; abstr 9010)
- Drilon A, Targeted therapy outcomes in RET-rearranged lung cancers: drug or driver? Lancet Respir Med 2017; 5(1): 5-6
- Yoh K et al., Vandetanib in patients with previously treated RET-rearranged advanced non-small-cell lung cancer (LURET): an open-label, multicentre phase 2 trial. Lancet Respir Med 2017; 5(1): 42-50
- Subbiah V et al., Precision targeted therapy with BLU-667 for RET-driven cancers. Cancer Discov 2018; 8(7): 836-884
- Blueprint internal data
- Gainor JF et al., Clinical activity and tolerability of BLU-667, a highly potent and selective RET inhibitor, in patients with advanced RET-fusion+ non-small cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 9008)
- Cocco E et al., NTRK fusion-positive cancers and TRK inhibitor therapy. Nat Rev Clin Oncol 2018; 15(12): 731-747
- Lassen UN et al., Larotrectinib efficacy and safety in TRK fusion cancer: an expanded clinical dataset showing consistency in an age and tumor agnostic approach. Ann Oncol 2018; 29 (suppl_8): viii133-viii148
- Hong DS et al., Larotrectinib efficacy and safety in adult TRK fusion cancer patients. J Clin Oncol 37, 2019 (suppl; abstr 3122)
- Fernandez-Cuesta L et al., CD74-NRG1 fusions in lung adenocarcinoma. Cancer Discov 2014; 4(4): 415-422
- Duruisseaux M et al., NRG1 fusion-positive lung cancers: clinicopathologic profile and treatment outcomes from a global multicenter registry. J Clin Oncol 37, 2019 (suppl; abstr 9081)
More posts
小細胞肺がん:セカンドライン治療の改善
小細胞肺がん:セカンドライン治療の改善 ルルビネクテジン単独療法 再発性小細胞肺がん(SCLC)患者への治療の選択肢は非常に限られている。プラチナ製剤感受性肺がんのセカンド
まれな遺伝子変異:治療を一歩先へ進める
まれな遺伝子変異:治療を一歩先へ進める GEOMETRY mono-1試験:MET遺伝子変異陽性NSCLCへのカプマチニブ投与 NSCLC患者の3%から4%にMETエクソン
ALK融合遺伝子陽性NSCLCにおける血液検体を用いたリキッドバイオプシー
ALK融合遺伝子陽性NSCLCにおける血液検体を用いたリキッドバイオプシー Rafał Dziadziuszko, MD, PhD, Department of Oncol
臨床試験の最新結果および免疫療法の新規バイオマーカー
臨床試験の最新結果および免疫療法の新規バイオマーカー ペンブロリズマブの長期成績:KEYNOTE-001試験 KEYNOTE-001試験は、進行NSCLCの治療歴のない患者
EGFR遺伝子変異陽性肺がんへの新規第一選択薬およびその他の知見
EGFR遺伝子変異陽性肺がんへの新規第一選択薬およびその他の知見 RELAY試験:ラムシルマブの追加 EGFR遺伝子変異陽性肺がん患者には、EGFR TKIがおおむね有効だ
早期NSCLC:期待を持てる(ネオ)アジュバント療法
早期NSCLC:期待を持てる(ネオ)アジュバント療法 NEOSTAR試験 切除可能な非小細胞肺がん(NSCLC)のⅠ期からⅢ期と診断された患者の半数以上は再発するため、効果