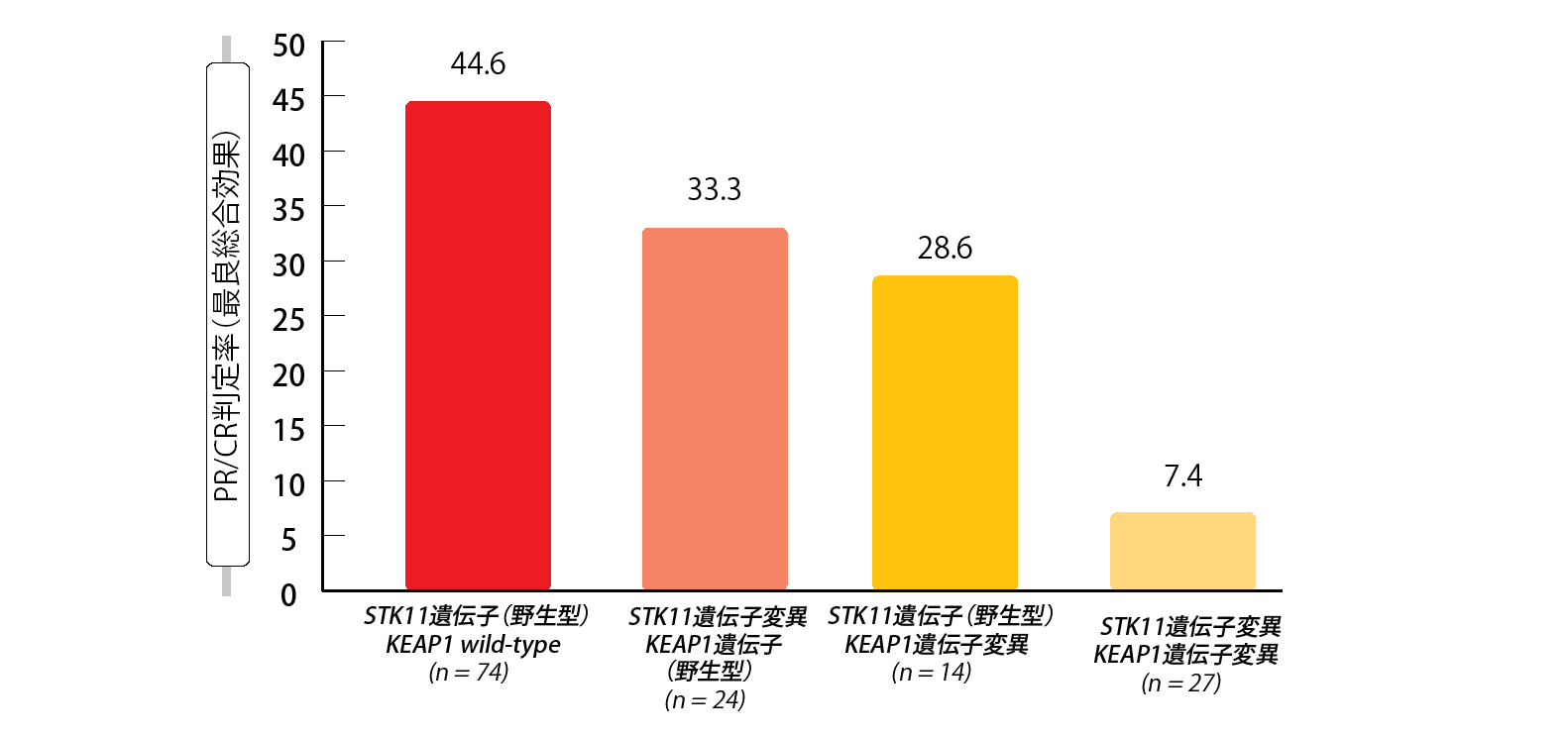臨床試験の最新結果および免疫療法の新規バイオマーカー
ペンブロリズマブの長期成績:KEYNOTE-001試験
KEYNOTE-001試験は、進行NSCLCの治療歴のない患者と治療歴のある患者に抗PD-L1抗体薬ペムブロリズマブの作用が見られた、初の臨床試験である[1]。このマルチコホート第IB相試験では、腫瘍細胞のうちPD-L1発現が陽性になる細胞の割合を表すTPSがペムブロリズマブ群で上昇し、より大きな効果が示された。2012年の5月から2014年の7月にかけて、進行NSCLC患者550人が非ランダム化比較試験の4試験と、ランダム化比較試験の2試験の患者コホートとして組み入れられた。患者の内訳は、治療歴のない患者が101人、治療歴のある患者が449人だった。同試験の5年時点の有効性および安全性の成績を、Garonらが報告した[2]。データカットオフの時点では100人が生存していた。進行NSCLC患者へのペムブロリズマブ投与に関する、現在に至るまでの長期成績が、最近の解析にまとめられている。
5年生存率は、治療歴のない患者群が23.3%、治療歴のある患者群が15.5%だった。これに対して、米国で2008年から2014年までに標準治療として細胞毒性化学療法を受けた患者の5年生存率は5.5%だったと、著者らは記している[3]。PD-L1 TPSが50%以上の患者の5年生存率については、治療歴のない患者群は29.6%、治療歴のある患者群では25.0%だった。TPSが1~49%の患者の場合、5年生存率は低下した(前者は15.7%、後者は12.6%)。ORRについては、治療歴のない患者群全体で41.6%、治療歴のある患者群では22.9%となり、DCRは前者が83.2%、後者は58.6%となった。ペムブロリズマブ投与を2年以上受けた患者60人のうち46人が、データカットオフの時点でも生存していた。この60人の5年生存率の予測値は、治療歴のない患者群が78.6%、治療歴のある患者群が75.8%である(前者は14人、後者は46人)。前者の86%、後者の91%に奏効が認められ、奏効期間の中央値は前者が52か月、後者に関しては判明していなかった。
最新の安全性データの内容は、ペムブロリズマブの既知のデータと一致していた。これまでにグレード3から5の免疫関連AEや晩発性のAEが発現した形跡はなかった。進行NSCLCの治療歴のない患者にも治療歴のある患者にも、ペムブロリズマブにより長期転帰が改善する可能性が最新データからも引き続き示された。
KEYNOTE-189試験: 最新成績およびPFS2
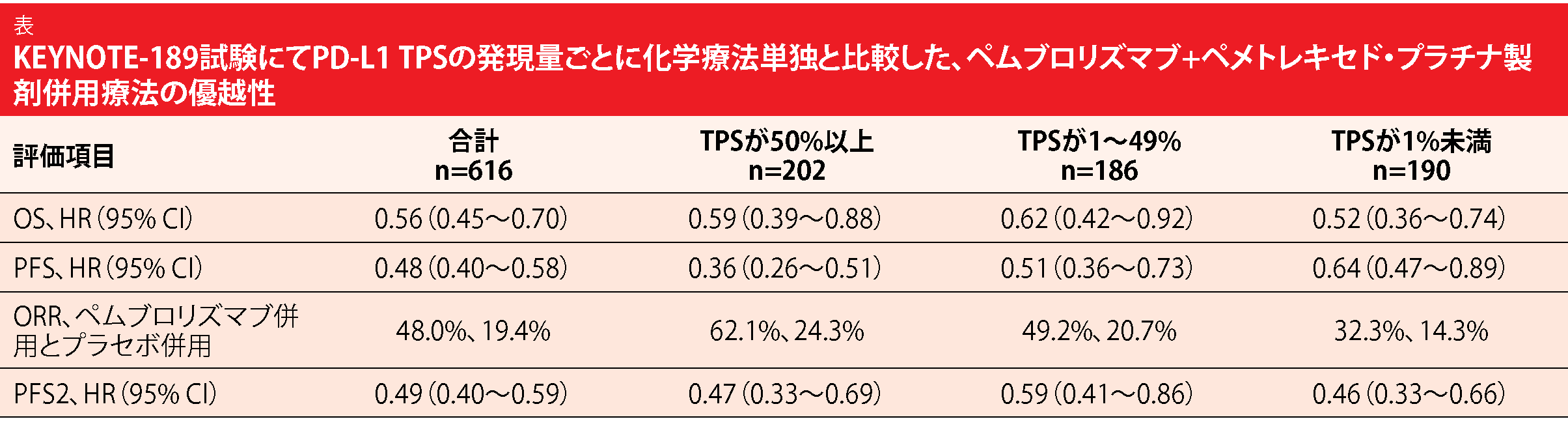
転移性非扁平上皮NSCLC患者を対象にした第Ⅲ相二重盲検ランダム化比較KEYNOTE-189試験では、プラセボとペメトレキセド/プラチナダブレット療法の併用に比べて、ペムブロリズマブとペメトレキセド/プラチナダブレット療法の併用をファーストライン治療として行うことに優れた結果が見られた[4]。OS、PFS、ORRにもベネフィットがあり、安全性についても対応可能な内容だった。長期にわたる追跡調査のデータおよび利用が初となるPFS2(ランダム割り付けから二度目の病勢進行または死因を問わない死亡の、どちらか先に起きるまでの期間)に基づいた、有効性に関する最新データをGadgeelらが発表した[5]。OSの評価へのクロスオーバーの影響を定量化したり、ある治療ラインで行った治療が次のラインの治療の効果に良い影響を与えるかそうでないかを判断したりすることに、PFS2は利用できる。
ITT解析対象集団のうち410人にペムブロリズマブベースの併用療法を行い、206人にプラセボを併用する化学療法を行った。いずれかの治療を受けた後に別のラインの治療を1つでも受けた患者は、前者で44.6%、後者で59.2%だった。次の治療ラインで抗PD-1抗体薬または抗PD-L1抗体薬を1剤以上投与された患者は、前者で13%、後者で54%に上った。試験期間中に対照群の40.8%の患者がクロスオーバーした。
ペムブロリズマブベースの併用療法群の生存期間に、統計学的有意性のあるベネフィットが引き続き認められた(OSの中央値はペムブロリズマブベースの併用療法群が22.0か月、対照群が10.7か月、HR:0.56)。24か月時点のOSは前者が45.5%、後者が29.9%となり、PFSも同様にほぼ二倍に延び(前者は9.0か月、後者は4.9か月、HR:0.48)、24か月時点のPFS率は20.5%と1.5%になった。また、PFS2に関してもペムブロリズマブベースの併用療法群に著しい効果のあることが、解析により判明した(前者は17.0月、後者は9.0か月、HR:0.49)。ORRも同併用療法群で高くなっていた(前者は48.0%、後者は19.4%)。かなりの割合の患者が次のラインの治療を受け、クロスオーバーも行っていたが、ペムブロリズマブを追加したことによるベネフィットが、すべての評価項目に見られた(表)。長期間の追跡期間を終えた後も、ペムブロリズマブベースの併用療法群の安全性と忍容性は良好な状態が続いた。著者らの結論からは、PD-L1の発現を問わず、転移性非扁平上皮NSCLC患者の転帰を最大限改善するためには、ペムブロリズマブをファーストライン治療の一環として使用すべきだということが、以上のデータで確認できる。
PD-L1絶対発現量の重要性
免疫チェックポイント阻害薬が適している患者を選定するための効果予測バイオマーカーは、PD-L1検査が臨床で重視されていることもあって、いまだに数が限られている。多施設共同後ろ向き研究の一環として、AguilarらがⅣ期のNSCLCでPD-L1 TPSが50%以上の患者を分析し、この範囲内に収まる特定の患者らには抗PD-1抗体薬の効果がより多く見込めるか否か、という疑問に答えた[6]。ペムブロリズマブによるファーストライン治療を受けた172人が、患者コホートの合計人数である。TPSが50%~74%(n=68)の患者群と75%~100%(n=104)の患者群、同50%~89%(n=99)の患者群と90%~100%(n=73)の患者群の臨床病理学的特徴および臨床転帰を比較した。
TPSが75%以上の患者群と90%以上の患者群で臨床転帰が改善しており、TPSの高さと改善の程度に相関性のあることが示された。喫煙未経験者、扁平上皮の組織型、遺伝子の変異状態を補正すると、TPSの少ない患者群に比べて、TPSの多い患者群の生存に関する項目により大きなベネフィットが見られた(TPS高発現群のHRは 0.63、低発現群は0.63)。また、PFSについても、50%~74%の患者群よりも75%~100%の患者群で(HR:0.61)、50%~89%の患者群よりも90%~100%の患者群(HR:0.52)で、統計学的有意に延長していた。ORRも高発現群により大きな改善が見られた。治療反応の良くない患者に比べて、それが良い患者の方がPD-L1 TPSが高くなった。部分奏効または完全奏効の判定を受けた患者のTPSの平均値は82.1%で、安定または進行の判定を受けた患者の平均値は73.7%となった(p=0.001)。ファーストライン治療をペムブロリズマブ単独療法にするか、ペムブロリズマブ+プラチナダブレット療法のどちらにするかを判断する際、以上の結果を考慮すべきだろうと著者らは語った。また、PD-L1 TPSが50%以上のNSCLC患者が参加する臨床試験の試験デザインや試験成績の解釈にも、注目すべきだろう。
新規ゲノムバイオマーカー: STK11遺伝子とKEAP1遺伝子
STK11(LKB1)遺伝子のゲノム異常は、免疫原性の低い腫瘍(“cold” tumor)の微小環境に介在し、非扁平上皮NSCLC患者での抗PD-1抗体薬に耐性を生じさせる主な原因であることが分かっている[7]。STK11は、この疾患のがん抑制遺伝子を不活化させるものとして高頻度で見つかっており、細胞の成長や代謝を抑制するタンパク質のLBK1をコードする。また、KEAP1遺伝子は遺伝学と機能の両面でSTK11とつながりがあり、両方遺伝子に変異が生じていることも多い[8、9]。
Skoulidisらは国際共同後ろ向き研究を行い、転移性非扁平上皮NSCLC患者のファーストライン治療に、ペムブロリズマブ+ペメトレキセド・プラチナ製剤を併用した場合の臨床転帰の分子決定基として、これらのバイオマーカーにどの程度の有用性があるのかを調査した[10]。STK11、KEAP1の両遺伝子の変異と、免疫化学療法後の臨床転帰の悪さとの間に、顕著な相関性が見られた。どちらか一方の遺伝子変異でも同様な結果が見られたが、両遺伝子に変異がある場合に顕著になった。両方が野生型の患者群のPFSの中央値は8.4か月だったが、両方に遺伝子変異のある患者群ではわずか2.7か月となった(p<0.0001)。OSの中央値も前者は20.4か月だが、後者は6.6か月である(p=0.005)。ORRもまた、変異の数が多いほど徐々に悪化していった(図1)。原発性で難治性の疾患をわずらう患者群では、STK11とKEAP1の両方あるいはどちらかに遺伝子変異を認める患者が76.5%にもなった。これらの遺伝子変異は、ペメトレキセド・プラチナ製剤併用療法にペムブロリズマブを追加しても、PFSとOSに明確な効果が現れないことと関係していた。STK11、KEAP1の両遺伝子変異が免疫化学療法後の臨床転帰に悪影響を及ぼすことが、とりわけ遺伝子変異量の多い、PD-L1陽性がん患者に最もはっきりと現れた。ただ、STK11とKEAP1の両方あるいはどちらかに遺伝子変異を認める患者の場合、遺伝子変異量もPD-L1の発現も臨床転帰に影響していない。
これらの知見を踏まえて、STK11とKEAP1の両遺伝子変異を、免疫化学療法後の転帰不良を予測する複合ゲノムバイオマーカーとするよう、著者らは提案している。これを利用することで、新薬のアンメットニーズがあるNSCLC患者約25%への、有効な治療法を確立できるようになるだろう。
図1:STK11遺伝子およびKEAP1遺伝子の各サブグループへのペムブロリズマブ+化学療法実施後の奏効率
NLR、PLR、LDH
免疫療法を行う患者の選定には、簡単に測定できる好中球・リンパ球比(NLR)、血小板・リンパ球比(PLR)、乳酸脱水素酵素(LDH)が役立つ可能性をRussoらが示している[11]。ニボルマブまたはペムブロリズマブによる治療を受けた同一のNSCLC患者71人で、これらの炎症マーカーが経時的にどのように変化するか、また臨床転帰がどのようになるかを評価した。NLRは5以上、PLRは200以上、LDHは基準値の上限(UNL)以上であれば、高値とみなした。
NLRが5以上であるとPFSもOSも減少しており、ベースライン時から12週目までにこの予測値は上昇していた。ベースライン時と12週目に、PLRが200以上であったこととOSの短さにとの間の相関性には統計学的有意性があったが、PFSにはそれがなかった。ベースライン時のLDHがUNL以上だった場合、PFSとOSの短さとの間に相関性があることが解析結果に見られた。ベースライン時に比べて12週目のLDHが低下していると、OSが改善していた。ベースライン時のNLR、PLR、LDHそして12週目のLDHの変化の大きさが、免疫チェックポイント阻害薬の単剤投与を受ける患者の転帰を予測するための有用な要素になると、著者らは総括した。
自己免疫疾患は治療の妨げになるのか?
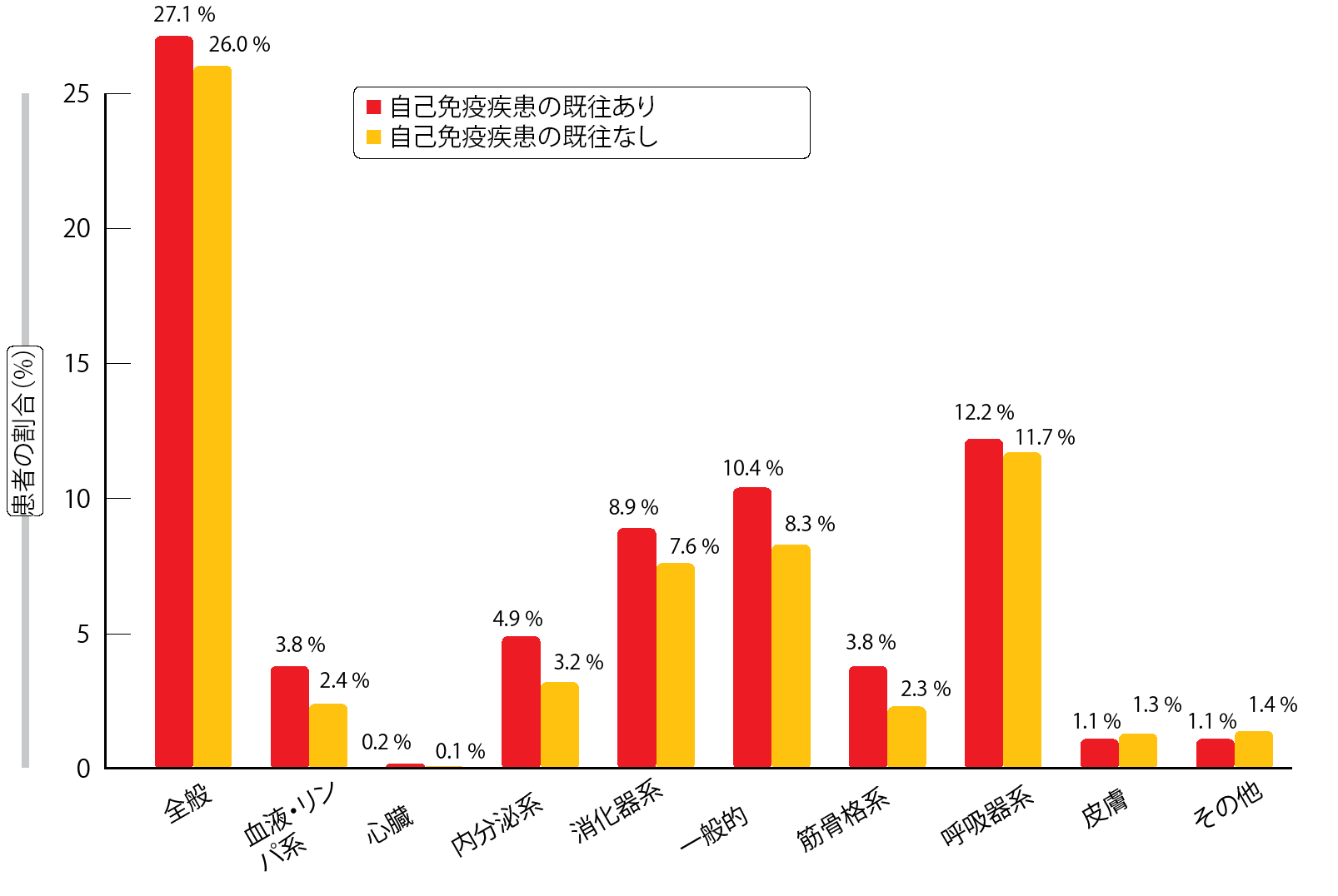
患者に自己免疫疾患の既往があると、ほとんどの場合、免疫療法の臨床試験から除外されてしまう。しかし、自己免疫疾患を併発していても、進行NSCLCの治療には日頃から免疫チェックポイント阻害薬を使用していることが、最近の事例から見て取れる[12]。この事実を踏まえて、実際に見られる特徴およびAEを含めた転帰を検証するために、観察研究である後ろ向きコホート研究を行った。対象になったのは、自己免疫疾患の既往は問わず、主に米国の市中病院49施設の腫瘍内科で免疫チェックポイント阻害薬の承認薬を少なくとも1回分投与された、進行NSCLC患者である[13]。免疫チェックポイント阻害薬の投与開始までの1年以内に、Ⅲ期の疾患に手術などの局所療法および化学療法を受けた患者は、同研究から除外した。患者2,402人分の診療記録が解析対象になった。なお、このうちの22%(n=531)に自己免疫疾患の既往がある。自己免疫疾患の既往のない患者コホートと既往のある患者コホートとを比較しても、女性患者の割合が多い(既往あり群54.6%、既往なし群43.5%)点を除いて、患者特性にも疾患特性にもほとんど差異はなかった。
治療転帰については両患者コホートとも同様だったと、著者らは述べている。OS、実際のPFS、治療開始から中止までの期間、次の治療開始までの期間に関しては、すべてのカプランマイアー生存曲線が重なりを見せており、統計学的有意差は認められなかった。忍容性に関しては、自己免疫疾患の既往のある患者コホートで、免疫関連AEの発現率が高くなった。一般的な自己免疫疾患はもとより、内分泌系、消化器系、血液・リンパ系の自己免疫疾患の既往のある患者で特に同AEの発現率が上昇した(図2)。免疫関連AEの発現率そして患者転帰への自己免疫疾患の影響力をより深く理解するために、さらに研究を重ねる必要がある。
図2:免疫チェックポイント阻害薬を投与した自己免疫疾患の既往のある群(ない群)で記録した免疫関連 AEの発現率
参考文献:
- Garon EB et al., Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 2015; 372(21): 2018-2028
- Garon EB et al., 5-year long-term overall survival for patients with advanced NSCLC treated with pembrolizumab: results from KEYNOTE-001. J Clin Oncol 37, 2019 (suppl; abstr LBA9015)
- Leighl NB et al., Pembrolizumab in patients with advanced non-small-cell lung cancer (KEYNOTE-001): 3-year results from an open-label, phase 1 study. Lancet Respir Med 2019; 7(4): 347-357
- Gandhi L et al., Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N Engl J Med 2018; 378(22): 2078-2092
- Gadgeel S et al., KEYNOTE-189: updated overall survival and progression after the next line of therapy with pembrolizumab plus chemotherapy with pemetrexed and platinum vs placebo plus chemotherapy for metastatic nonsquamous non-small-cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 9013)
- Aguilar EJ et al., Comparison of outcomes with PD-L1 tumor proportion score (TPS) of 50-74% vs 75-100% in patients with non-small cell lung cancer (NSCLC) treated with first-line PD-1 inhibitors. J Clin Oncol 36, 2018 (suppl; abstr 9037)
- Skoulidis F et al., STK11/LKB1 mutations and PD-1 inhibitor resistance in KRAS-mutant lung adenocarcinoma. Cancer Discov 2018; 8(7): 822-835
- Skoulidis F et al., Co-occurring genomic alterations define major subsets of KRAS-mutant lung adenocarcinoma with distinct biology, immune profiles, and therapeutic vulnerabilities. Cancer Discov 2015; 5(8): 860-877
- Galan-Cobo A et al., LKB1 and KEAP1/NRF2 pathways cooperatively promote metabolic reprogramming with enhanced glutamine dependence in KRAS-mutant lung adenocarcinoma. Cancer Res 2019 Apr 30. pii: canres.3527.2018. doi: 10.1158/0008-5472.CAN-18-3527. [Epub ahead of print]
- Skoulidis F et al., Association of STK11/LKB1 genomic alterations with lack of benefit from the addition of pembrolizumab to platinum doublet chemotherapy in non-squamous non-small cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 102)
- Russo A et al., Dynamic changes of neutrophil-to-lymphocyte ratio (NLR), platelet-to-lymphocyte ratio (PLR), and lactate dehydrogenase (LDH) during treatment with immune checkpoint inhibitors (ICIs) in non-small cell lung cancer (NSCLC). J Clin Oncol 37, 2019 (suppl; abstr 2596)
- Darvin P et al., Immune checkpoint inhibitors: recent progress and potential biomarkers. Exp Mol Med 2018; 50(12): 165
- Khozin S et al., Real-world outcomes of patients with advanced non-small cell lung cancer (aNSCLC) and autoimmune disease receiving immune checkpoint inhibitors. J Clin Oncol 37, 2019 (suppl; abstr 110)
More posts
小細胞肺がん:セカンドライン治療の改善
小細胞肺がん:セカンドライン治療の改善 ルルビネクテジン単独療法 再発性小細胞肺がん(SCLC)患者への治療の選択肢は非常に限られている。プラチナ製剤感受性肺がんのセカンド
まれな遺伝子変異:治療を一歩先へ進める
まれな遺伝子変異:治療を一歩先へ進める GEOMETRY mono-1試験:MET遺伝子変異陽性NSCLCへのカプマチニブ投与 NSCLC患者の3%から4%にMETエクソン
ALK融合遺伝子陽性NSCLCにおける血液検体を用いたリキッドバイオプシー
ALK融合遺伝子陽性NSCLCにおける血液検体を用いたリキッドバイオプシー Rafał Dziadziuszko, MD, PhD, Department of Oncol
臨床試験の最新結果および免疫療法の新規バイオマーカー
臨床試験の最新結果および免疫療法の新規バイオマーカー ペンブロリズマブの長期成績:KEYNOTE-001試験 KEYNOTE-001試験は、進行NSCLCの治療歴のない患者
EGFR遺伝子変異陽性肺がんへの新規第一選択薬およびその他の知見
EGFR遺伝子変異陽性肺がんへの新規第一選択薬およびその他の知見 RELAY試験:ラムシルマブの追加 EGFR遺伝子変異陽性肺がん患者には、EGFR TKIがおおむね有効だ
早期NSCLC:期待を持てる(ネオ)アジュバント療法
早期NSCLC:期待を持てる(ネオ)アジュバント療法 NEOSTAR試験 切除可能な非小細胞肺がん(NSCLC)のⅠ期からⅢ期と診断された患者の半数以上は再発するため、効果