CNS転移巣への多様な治療法および予防法
EGFR変異陽性肺がんへのアファチニブおよびオシメルチニブの臨床活性
NSCLC患者の40%超に、生存中のCNSへの転移が見られている。[1、2]。脳に転移した場合、生活の質と生存期間の両面に悪影響を及ぼすことから、血液脳関門を通過できる治療薬の開発が研究の重要な焦点になっている。
EGFR TKIの中でもとりわけ第二世代の阻害薬アファチニブと第三世代の阻害薬オシメルチニブが、EGFR変異陽性肺がん患者のCNSに臨床活性を発揮している。EGFR TKIを投与されたことのないアジア人患者を対象に実臨床と同様な条件で行った、第Ⅲb相大規模非盲検単群試験の解析結果から、アファチニブのこの活性を示すエビデンスがさらに得られている[3]。患者479人のうち92人にCNS病変を認めた。脳転移巣のない患者群に比べ脳転移巣のある患者群のPFSは数字上短くなったが(脳転移巣あり10.9か月、脳転移巣なし12.4か月)、症状増悪までの期間の中央値は両患者群の間に差異は見られなかった(脳転移巣あり14.8か月、脳転移巣なし15.4か月)。これまでの観察結果によると、忍容性にもとづいたアファチニブの用量調節により、発現することが多いAEの発現率が減少しても治療効果を損ねないことを、コホート全体の解析結果で確認している。
非盲検単群試験であり実臨床の治療を行うASTRIS試験で、韓国で対象になった脳転移患者へのオシメルチニブの臨床活性のデータを、Kangらが報告した[4]。同試験では、これまでにEGFR TKIの投与を受けた、T790M変異陽性進行NSCLCの各国の患者にオシメルチニブ80 mgを1日1回投与して、調査している。症状はなく、CNS転移巣が安定しており、オシメルチニブの投与開始までの2週間に副腎皮質ホルモンの投与量を増量する必要がなかった患者も、この試験に組み入れた。この条件が該当したのは211人である。
同試験で得た知見は、EGFR変異陽性NSCLC患者とCNS転移巣のある患者へのオシメルチニブの臨床的有用性を、強く支持する内容だった。PFSの中央値はNSCLC患者で10.8か月、CNS転移巣のある患者で11か月となり、1年後のPFS率はそれぞれ39.6%、47.3%となった。奏効したのは前者が68%、後者が79.6で、治療開始から中止までの期間はそれぞれ11.2か月と14.7か月である。
治療経験のあるALK陽性NSCLC患者:ロルラチニブ
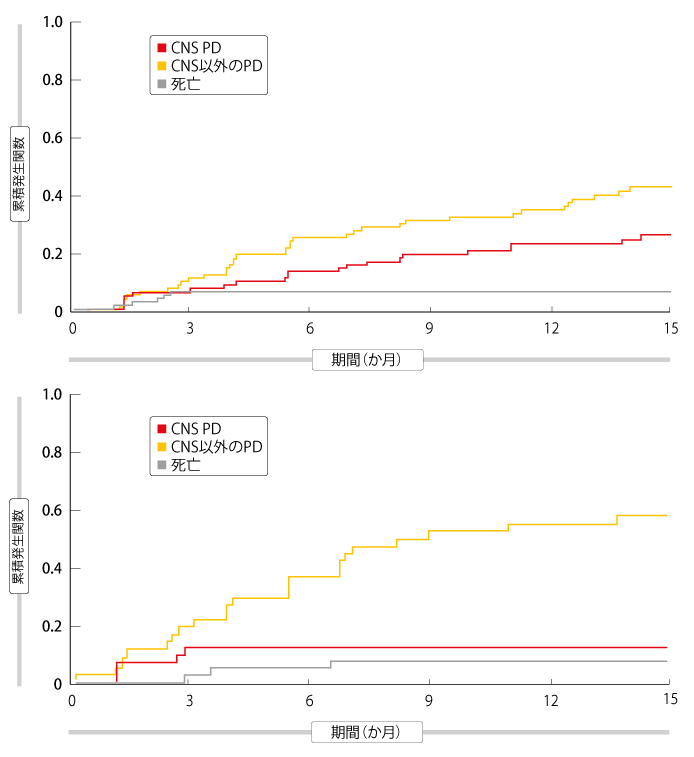
選択性が高く強力なALK/ROS1 TKIのロルラチニブは、血液脳関門を通過できるように設計された治療薬だ。第Ⅱ相試験および第Ⅲ相試験では、CNS転移巣があり、ALK TKIを用いた治療に1回以上失敗した患者が大部分を占めるALK陽性NSCLC患者に、ロルラチニブはしっかりとした臨床活性を示した。脳脊髄液検査を行ったところ、ロルラチニブの脳脊髄液−血漿中遊離型濃度比の平均は0.73で、ロルラチニブがCNSにまでかなり到達していることがわかった。Bauerらは、独立評価委員会の評価にもとづいてCNS転移巣の進行(PD)ありまたは進行なしと分類した患者と、死亡した患者を解析した[7]。複数のサブセットが存在する、現在進行中の第Ⅱ相試験の全コホートに、競合リスクモデルを用いて累積罹患率を算出した。
クリゾチニブと第二世代のALK TKIの両方またはいずれかによる治療後に病勢が進行した患者で、ベースライン時にCNSの転移巣があった患者となかった患者の脳病変に対して、ロルラチニブ100 mgの1日1回投与が顕著な臨床活性を示したことが、解析によって判明した。以前にクリゾチニブを用いた治療を受けた患者群では、頭蓋内病変のORR(IC-ORR)は70%だが、奏効期間(IC-DOR)の中央値にはまだ達していなかった。ベースライン時にCNSの転移巣を認めた患者の場合、12か月後にCNS転移巣が進行する確率とそれ以外の病変が進行する確率は双方とも22%だった。脳病変のない患者の場合、CNS転移巣の進行よりもそれ以外の病変が進行する確率が高くなった(12か月後のCNS病変以外の進行43%、CNS転移巣の進行9%)。これと同様に、クリゾチニブ以外のTKIを1種類投与された患者群では、IC-ORRが46%となったが、IC-DORの中央値にはまだ達していなかった。これまでに2種類または3種類のTKIを試した患者では、IC-ORRが48%、IC-DORは15か月になった。クリゾチニブ以外のTKIを1種類投与された患者群と、2種類または3種類のTKIを試した患者群のプールデータからは、ベースライン時にCNS転移巣があった患者でもそれがなかった患者でも、CNS転移巣の進行(CNS PD)よりも頭蓋外転移巣の進行する確率が高いことが判明した(ベースライン時にCNS転移巣を認めた患者の12か月後の進行は頭蓋外転移巣が35%、CNS転移巣が23%、CNS転移巣を認めなかった患者の場合は前者が55%、
後者が12%、図)。第二世代のALK TKIがTKI療法の最後になった患者にも、これと同じことが認められた。これらの知見を総合して考えると、CNS転移巣へのロルラチニブの臨床活性が浮かび上がり、肺がんが脳に転移するのを防ぐ可能性も示唆した。今のところこのデータが、第二世代のALK TKIを用いた治療の後の病勢の進行を前向きに調査した唯一のデータである。
図:以前に第二世代のALK TKIを1種類以上試したことのあるロルラチニブによる治療を受ける患者で、ベースライン時にCNS転移巣を認めた患者(上)と認めなかった患者(下)のCNSへの転移、CNS以外への転移、死亡の累積罹患係数
高リスク患者への予防的全脳照射
NSCLC患者への予防的全脳照射(PCI)に関しては、放射線による神経学的後遺症の懸念があり、OSの延長を示すデータが不足しているため、いまだ議論が交わされている。Arrietaらは、脳転移の危険性が高い患者にPCIが有用だという結果を提示している[8]。診断時に標的遺伝子変異(EGFR遺伝子またはALK融合遺伝子の感受性変異のどちらか)、CEA値上昇(20 pg/ml超)の両方もしくはいずれかがある患者を、高リスク患者と定義した。第一世代と第二世代のTKIを用いる治療に加えて、PCIを受ける群(25 Gyを10分割、1週間に5日間の照射、n=41)もしくは経過観察のみの群(n=43)に、この患者らを無作為に割り付けた。頭蓋内転移に関するPFSを主要転帰とした。補正後、2016年1月以降にPCIを受けた患者には、海馬回避全脳照射を行った。
多変量解析結果によると、PCIにより頭蓋内転移巣が進行するリスクと死亡が60%低下している(p=0.006)。24か月後のCNS転移巣の進行の累積罹患率はPCI群で22%だが、対照群ではこれが52%にのぼった。これと同じような傾向がOSにも認められた(OSの中央値はPCI群で42.8か月、対照群で25.9か月、HR:0.47、p=0.035)。認知機能の評価にはミニメンタルステート検査(MMSE)を、生活の質の評価にはEORTC-QLQ-30質問票を用いた[9]。 MMSEの点数とGlobal Quality of Life尺度の点数の中央値、疲労と認知機能は、両群間でもベースライン時と追跡期間中でも差異はなかった。ただし、長期評価は必要だ。
これらの結果全体を見渡すと、脳転移のリスクが高い患者ほどPCIが有用であることが現れている。CNSへの到達量はより多いが、新興国では手に入りづらい第三世代のTKIを用いた治療を受ける患者にも、このデータを外挿できるだろうと著者らは述べている。
免疫療法は脳に有効なのか
多施設共同非介入後ろ向きコホート研究であるIMMUNOBrainZH試験は、脳転移のある進行NSCLC患者で、化学療法の治療ラインを1つ以上受けたがうまくいかなかった患者への、抗PD-L1抗体薬ニボルマブ3 mg/kgの隔週投与を評価するようデザインされている[10]。同試験に組み入れられた患者77人のうち50人が定位放射線治療(SRT:n=17)または全脳照射(WBRT:n=33)を受けたが、27人がこれまでに頭蓋内転移巣の局所療法を受けたことがなかった。なお、PD-L1の発現量は不明である。
主要評価項目である脳内転移巣の奏効率を解析したところ、20.8%となった。脳外転移巣の奏効率は22.1%、ORRは23.4%となった。先に行った局所療法別に脳内転移巣の奏効率を解析した場合、放射線治療を受けなかった患者(29.6%)とSRTを受けた患者(23.5%)の方が、WBRTを受けた患者(12.1%)よりも高くなった。ニボルマブの投与開始までの3か月以内に放射線治療を受けた患者の治療効果は、3か月以上たって受けた患者の効果を大きく上回った(脳内転移巣のRR:3か月未満は30.0%、3か月以上は 6.7%、表)。脳内転移巣のPFSはコホート全体で8.0か月、OSは9.0か月となった。
脳内転移巣と脳外転移巣へのニボルマブの効果は同等だと著者らは結論づけた。ニボルマブの投与開始までの3か月以内に放射線治療を行うと、抗腫瘍効果を相乗させる可能性もある。免疫療法も他の全身療法と同様に、NSCLCの脳転移への効果を期待できることが示された。
参考文献:
- Oxnard GR et al., Acquired resistance to EGFR tyrosine kinase inhibitors in EGFR mutant lung cancer: Distinct natural history of patients with tumors harboring the T790M mutation. Clin Cancer Res 2011; 17: 1616-1622
- Yu HA et al, Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers. Clin Cancer Res 2013; 19(8): 2240-2247
- Wu YL et al., A phase IIIb trial of afatinib in EGFRm+ NSCLC: analysis of outcomes in patients with brain metastases or dose reductions. WCLC 2018, P1.01-98
- Kang JH et al., Real world data of osimertinib in patients with central nervous system (CNS) metastasis in ASTRIS Korean subgroup. WCLC 2018, MA08.07
- Shaw AT et al., Lorlatinib in non-small-cell lung cancer with ALK or ROS1 rearrangement: an international, multicentre, open-label, single-arm first-in-man phase 1 trial. Lancet Oncol 2017; 18: 1590-1599
- Solomon B et al., Lancet Oncol 2018, in press.
- Bauer TM et al., Brain penetration of lorlatinib and cumulative incidence rates for CNS and non-CNS progression from a phase 1/2 study. WCLC 2018, MA08.05
- Arrieta O et al., Prophylactic cranial irradiation reduces the risk of brain metastases in high-risk lung cancer patients: EGFR and ALK mutations. WCLC 2018, MA08.02
- Arrieta O et al., Effect of prophylactic cranial irradiation on cognitive function and QoL in NSCLC patients at high risk of brain metastases. WCLC 2018, P01.01-03
- Geier M et al., Real-life intracerebral efficacy of nivolumab in non-small cell lung cancer patients with brain metastases. WCLC 2018, MA08.10
More posts
患者の見解:生活の質の評価と肺がんに関わるスティグマ
患者の見解:生活の質の評価と肺がんに関わるスティグマ 肺がんによる負担 生活の質(QoL)評価は患者に大変重要視されていて、肺がん治療の評価に欠かせない要素ではあるが、日常
肺がん検診にボリュームCTを用いることで肺がんの死亡率が大幅に低下:NELSON試験
肺がん検診にボリュームCTを用いることで肺がんの死亡率が大幅に低下:NELSON試験 2011年に発表のあった全米肺がん検診試験(NLST)からは、3年にわたり低線量CTを
インタビュー:第I相試験であっても新薬には劇的な効果が見られる
第I相試験であっても新薬には劇的な効果が見られる Herbert Ho Fung Loong, MD中国、香港中文大学、一期臨床研究中心、臨床腫瘍科次長、臨床准教授 現時
抗EGFR抗体薬:実臨床での使用経験と治験で得た感想
抗EGFR抗体薬:実臨床での使用経験と治験で得た感想 治療の選択肢を決めるのはそれぞれの因子 ⅢB期・Ⅳ期のEGFR遺伝子変異NSCLCへの治療法がここ数年の間に大きく変わ
まれなドライバー遺伝子変異のある腫瘍への新しい標準治療
まれなドライバー遺伝子変異のある腫瘍への新しい標準治療 ファーストライン治療のブリガチニブ:ALTA-1L試験 ALK陽性NSCLCの治療におけるファーストラインの標準治療
免疫療法を受ける患者の転帰への抗PD-L1抗体薬の活性および決定因子に関する新データ
免疫療法を受ける患者の転帰への抗PD-L1抗体薬の活性および決定因子に関する新データ PACIFIC試験ではデュルバルマブ群の生存率が優位に 切除が不可能なⅢ期の非小細胞肺