抗血管生成疗法的现状和未来展望
口服三联血管激酶抑制剂尼达尼布(nintedanib)已在欧盟和其他国家批准与多西他赛联用,用于治疗一线化疗后的晚期肺腺癌。它通过靶向血管内皮生长因子(VEGF)受体1-3、血小板衍生生长因子(PDGF)受体α/β和成纤维细胞生长因子(FGF)受体1-3,以及RET来发挥作用[1,2]。
鉴于晚期NSCLC中治疗环境的变化,在以前接受过免疫检查点抑制剂(ICI)治疗的患者中,尼达尼布加多西他赛的活性是特别令人关注的。该疗法在进展后的最佳顺序尚未阐明,但潜在的肿瘤生物学可能有助于指导治疗的选择。
血管生成在ICI抵抗中发挥作用,因为过量的VEGF释放可产生免疫抑制性肿瘤微环境[3,4]。因此,涉及抑制VEGF、PDGF和FGF的抗血管生成策略可能支持血管正常化并改善免疫细胞对肿瘤的可及性。这可能会在所谓的血管免疫原性开关中朝向免疫支持性肿瘤微环境的方向倾斜。
ICI治疗后的尼达尼布加多西他赛
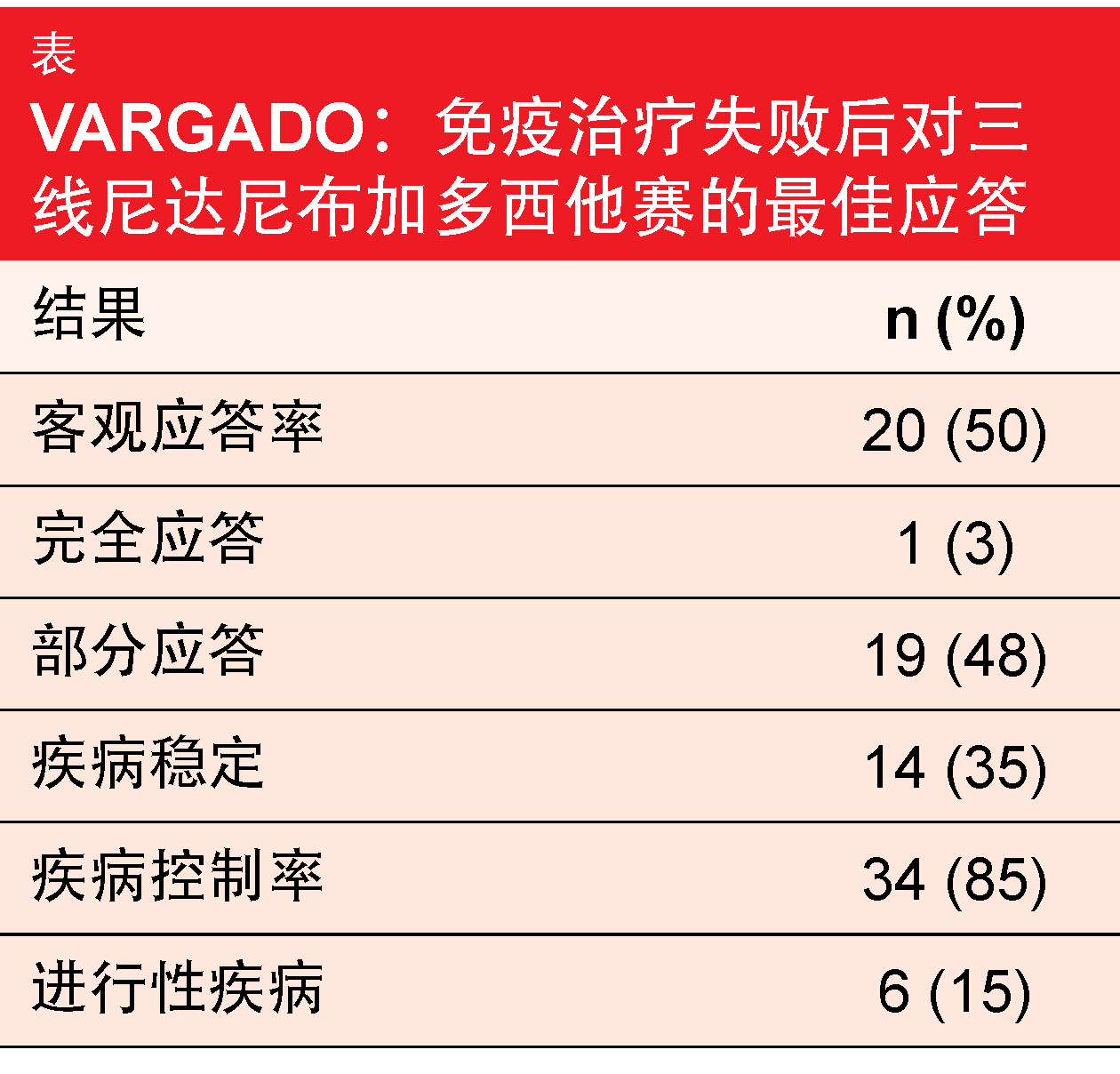
在ASCO大会上,Grohé等人报告了正在进行的非干预性前瞻性VARGADO试验的队列B中所包括的57名患者的最新结果[5]。在这一队列中,患有局部晚期、转移性或局部复发性肺腺癌的患者在一线化疗和二线ICI治疗后接受了尼达尼布加多西他赛。
最新的分析继续显示令人鼓舞的临床益处,以及尼达尼布加多西他赛的可控的安全性特征。从三线治疗开始,患者保持无进展的中位时间为6.5个月,且存活的中位时间为12.4个月。从一线治疗开始的OS为34.5个月。20名患者对该治疗有应答,这转化成ORR为50%(表)。一名患者完全应答。在65%的患者中发生了与治疗有关的AE,最常见的事件是腹泻(所有等级,37%)、口腔炎(12%)和白细胞数量减少(11%)。对于尼达尼布和多西他赛,分别有26%和19%的患者进行了至少一次剂量减少。因治疗发生的AE导致30%的患者终止研究治疗。
正如作者指出的,这些数据与评估尼达尼布加多西他赛的LUME-BioNIs研究的ICI预治疗亚组分析[6]以及以尼达尼布命名的患者使用程序的先前数据[7]一致。ICI治疗后抗血管生成剂的合理用药顺序可能是一种有前途的方法,值得进一步研究。
RELAY+:雷莫芦单抗(ramucirumab)联合吉非替尼
临床前和临床研究已证明在EGFR突变NSCLC中VEGF和EGFR通路的双重抑制活性[8-11]。在III期RELAY研究中,抗VEGFR2抗体雷莫芦单抗与EGFR TKI厄洛替尼联合使用与单独使用厄洛替尼相比可以延长PFS(19.4与12.4个月;HR,0.59)[12]。由于吉非替尼在日本比厄洛替尼更常用,探索性开放标签的RELAY+队列在80名先前未经治疗的EGFR突变IV期NSCLC患者中对每两周10 mg/kg的雷莫芦单抗加每天250 mg吉非替尼进行了评估[13]。
构成主要探索性目标的1年PFS率在雷莫芦单抗加吉非替尼方案(65%)与RELAY中的雷莫芦单抗加厄洛替尼方案(71.9%)相似[12]。ORR(分别为71%和76%)和DCR(分别为99%和95%)也是如此。此外,当按照RELAY+组内的EGFR突变亚型观察时,一年PFS率也相似(对于L858R突变和外显子19缺失分别为63%和67%)。雷莫芦单抗联合吉非替尼被证明是可耐受的,并且总体安全性特征与EGFR突变阳性转移性NSCLC中每种药物的已确定的安全性特征一致。
NEJ026:贝伐珠单抗加厄洛替尼对OS无影响
随机化、开放标签、III期NEJ026期试验在具有激活EGFR突变的非鳞状IIIB/IV期或术后复发性NSCLC患者中测试了贝伐珠单抗加厄洛替尼与厄洛替尼单药治疗。贝伐珠单抗加厄洛替尼的PFS明显更好(16.9与13.3个月;HR,0.605;p = 0.016)[10]。但是,组合策略的优势会随着时间而减弱。对于PFS2,该组合的活性仅略有改善,PFS2的定义是首次进展后进行二线治疗的时间(28.6与24.3个月;HR,0.773;p = 0.205)[14]。最后,关于OS,为厄洛替尼增加贝伐珠单抗没有进一步的益处(50.7与46.2个月;HR,1.007)。似乎没有亚组可以从该方案中获得显著的生存获益。这些观察结果与II期JO25567研究的结果相吻合,即贝伐珠单抗加厄洛替尼与厄洛替尼相比显著改善了PFS,但在OS方面,这两组的结果类似[15]。
作者推测,组合方案的疗效下降可能与进展后生存期较长以及研究治疗结束时开始的二线奥西替尼相关。在试验的两个组中,奥西替尼均优于不使用奥西替尼的治疗。根据液体活检研究,贝伐珠单抗加厄洛替尼引起的T790M耐药性突变的发生频率与第一代EGFR TKI相同。
元分析:抗血管生成剂加厄洛替尼与厄洛替尼
Landre等人进行了五项随机化试验的元分析,在携带EGFR突变的晚期NSCLC的一线治疗中比较了VEGF抑制剂加厄洛替尼与单独厄洛替尼[16]。分析包括NEJ026、ARTEMIS、RELAY和J025567研究,以及Stinchcombe等人基于美国的试验。RELAY使用雷莫芦单抗外加厄洛替尼进行,而其他所有研究均使用贝伐珠单抗作为EGFR TKI的抗血管生成伴侣药。对于所有研究,PFS被定义为主要终点。
根据结果,与单独使用厄洛替尼相比,VEGF和EGFR的组合抑制与PFS和应答持续时间的显著改善相关联。但是,需要成熟的OS数据才能确认这种策略的益处。此外,结果表明,该组合可能减慢对EGFR TKI的耐药性的出现。在ARTEMIS试验中,在进展时,与单药治疗组相比,联合治疗组的患者显示出较少的获得性耐药突变,诸如T790M。在RELAY中观察到相同的趋势。
安罗替尼(anlotinib)抑制VEGR
TKI安罗替尼是一种靶向包括VEGFR2和VEGFR3在内的多种受体酪氨酸激酶的抗血管生成药物。由于其口服施用途径,安罗替尼优于静脉内施用的贝伐珠单抗和雷莫芦单抗。Huang等人进行了单组研究,以便探讨在未经治疗的带有EGFR突变的、IIIB、IIIC或IV期非鳞状NSCLC患者中,安罗替尼联合口服EGFR TKI埃克替尼的活性[17]。评估了在35名患者中的毒性,其中有30名患者可评估疗效。
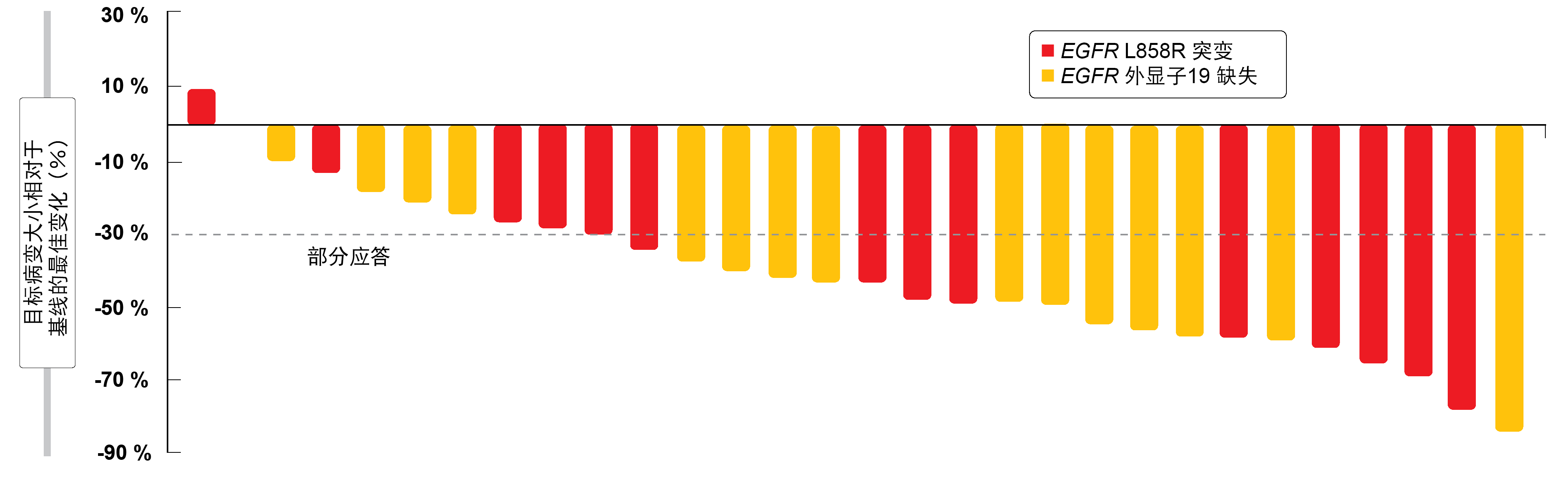
在一线治疗条件下,安罗替尼加埃克替尼显示出令人鼓舞的疗效。 总体而言,有21名患者(占70.0%)产生应答,全部获得部分缓解。11名外显子19缺失的患者获得了PR(73.3%),10名L858R突变的患者获得了PR(66.7%;图)。另有8名患者经历疾病稳定,疾病控制率为96.7%。18名患者在致癌驱动因子(PIK3CA或AKT1)和/或肿瘤抑制因子(TP53、RB1、PTEN)方面存在其他畸变;此处ORR为83.3%。安罗替尼加埃克替尼的耐受性良好,并且AE可控。最常见的AE包括高胆固醇血症、高甘油三酯血症、高血压、腹泻和皮疹。在3级AE中,高血压(17%)和高甘油三酯血症(6%)最常见。唯一的4级事件是高甘油三酯血症(6%)。PFS和OS结果需要等待,因为需要进行更长的随访以进行进一步评估。
图: 根据EGFR突变的类型,对安罗替尼联合埃克替尼的目标病变应答
VEGF/Ang-2阻断和检查点抑制
基于抗血管生成的另一种潜在的组合策略包括抑制VEGF/血管生成素-2(Ang-2)与免疫治疗方法。一项Ib期试验确定了VEGF/Ang2-blocking nanobody® BI 836880联合抗PD-1抗体BI754091的初步抗肿瘤活性,剂量分别为每三周720 mg和240 mg [18]。12名局部晚期或转移性非鳞状NSCLC患者中有10名获得部分缓解或疾病稳定。其中三分之二的患者在登记前已经接受了ICI治疗。在接过受ICI预治疗的患者和ICI初治患者中观察到靶病灶的变化。
该组合显示出可控的安全性特征。所有级别的不良事件包括高血压、呕吐、恶心和乏力。没有发生4级事件。扩展队列仍在进行中,可以期待进一步的结果。
参考文献
- Hilberg F et al., BIBF 1120: Triple angiokinase inhibitor with sustained receptor blockade and good antitumor efficacy. Cancer Res 2008; 68(12): 4774-4782
- Hilberg F et al., Triple angiokinase inhibitor nintedanib directly inhibits tumor cell growth and induces tumor shrinkage via blocking oncogenic receptor tyrosine kinases. J Pharmacol Exp Ther 2018; 364(3): 494-503
- Fukumura D et al., Enhancing cancer immunotherapy using antiangiogenics: Opportunities and challenges. Nat Rev Clin Oncol 2018; 15(5): 325-340
- van der Woude LL et al., Migrating into the tumor: A roadmap for T cells. Trends Cancer 2017; 3(11): 797-808
- Grohé C et al., Nintedanib plus docetaxel in lung adenocarcinoma patients following treatment with immune checkpoint inhibitors: updated efficacy and safety results of the ongoing non-interventional study VARGADO (NCT02392455). J Clin Oncol 38: 2020 (suppl; abstr 9604)
- Reck M et al., Nintedanib + docetaxel after immunotherapy in adenocarcinoma non-small cell lung cancer: first results from the non-interventional LUME-BioNIS study. Ann Oncol 2019; 30(Suppl. 11): abstract 180
- Corral J et al., Efficacy of nintedanib and docetaxel in patients with advanced lung adenocarcinoma treated with first-line chemotherapy and second-line immunotherapy in the nintedanib NPU Program. Clin Transl Oncol 2019; 21(9): 1270-1279
- Seto T et al., Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations (JO25567): An open-label, randomised, multicentre, phase 2 study. Lancet Oncol 2014; 15(11): 1236-1244
- Ichihara E et al., Phase II trial of gefitinib in combination with bevacizumab as first-line therapy for advanced non-small cell lung cancer with activating EGFR gene mutations: The Okayama Lung Cancer Study Group Trial 1001. J Thorac Oncol 2015; 10(3): 486-491
- Saito H et al., Erlotinib plus bevacizumab versus erlotinib alone in patients with EGFR-positive advanced non-squamous non-small-cell lung cancer (NEJ026): Interim analysis of an open-label, randomised, multicentre, phase 3 Trial. Lancet Oncol 2019; 20(5): 625-635
- Byers LA, Heymach JV, Dual targeting of the vascular endothelial growth factor and epidermal growth factor receptor pathways: Rationale and clinical applications for non-small-cell lung cancer. Clin Lung Cancer 2007; 8(suppl 2): S79-S85
- Nakagawa K et al., Ramucirumab plus erlotinib in patients with untreated, EGFR-mutated, advanced non-small-cell lung cancer (RELAY): A randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2019; 20(12): 1655-1669
- Nishio M et al., RELAY+: Exploratory study of ramucirumab plus gefitinib in untreated patients with epidermal growth factor receptor (EGFR)-mutated metastatic non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9564)
- Maemondo M et al., NEJ026: final overall survival analysis of bevacizumab plus erlotinib treatment for NSCLC patients harboring activating EGFR mutations. J Clin Oncol 38: 2020 (suppl; abstr 9506)
- Yamamoto N et al. Erlotinib plus bevacizumab (EB) versus erlotinib alone (E) as first-line treatment for advanced EGFR mutation–positive non-squamous non–small-cell lung cancer (NSCLC): Survival follow-up results of JO25567. J Clin Oncol 36, 2018 (suppl; abstr 9007)
- Landre T et al., Angiogenesis inhibitor plus erlotinib versus erlotinib alone as first-line for advanced non-small cell lung cancer harboring EGFR mutation. J Clin Oncol 38: 2020 (suppl; abstr 9569)
- Huang D et al., Study of anlotinib combined with icotinib as the first-line treatment in NSCLC patients harboring activating EGFR mutations (ALTER-L004). J Clin Oncol 38: 2020 (suppl; abstr 9573)
- Girard N et al., Phase Ib study of BI 836880, a VEGF/Ang2-blocking nanobody®, in combination with BI 754091, an anti-PD-1 antibody: initial results in patients with advanced non-small cell lung cancer. J Clin Oncol 38: 2020 (suppl; abstr 9566)
© 2019 Springer-Verlag GmbH, Impressum