ALK融合遺伝子変異陽性肺がんおよびMET遺伝子変異陽性肺がんへの効果の高い選択肢
ALESIA試験:ALEX試験で得た知見を確認
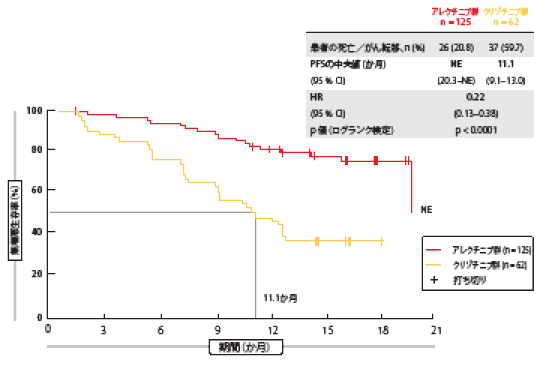
非常に選択性が高くCNS転移に有効なALK阻害薬のアレクチニブがALK融合遺伝子変異陽性NSCLC患者へのファーストライン治療としてクリゾチニブを上回る成績を収めたことが、国際共同試験の第Ⅲ相ALEX試験および、日本人患者を対象にしたJ-ALEX試験の第Ⅲ相試験で示された[2]。アレクチニブは米国と欧州で承認を受けており、最近中国でも優先審査を経て承認されたばかりである。ALK融合遺伝子変異陽性進行NSCLCのアジア人患者を対象に、国際的な承認用量のアレクチニブをファーストライン治療として用いて、クリゾチニブと比較評価するALESIA試験の第Ⅲ相試験で得た主要評価項目の結果を、Zhouらが本総会で報告した[3]。同試験の第一目標は、ALEX試験で認められたPFSへのアレクチニブの効果と同等な結果を得ることである。クリゾチニブ群のPFSが10.9か月であるのに対してアレクチニブ群では34.8か月となった(HR:0.43)ALEX試験で見られた、50%以上のリスク低下の維持を同等な結果の定義とした[1]。中国、韓国、タイの21の医療機関で合計187人の患者を無作為に割り付けた。アレクチニブ群の患者125人には600 mgを1日に2回投与し、対照のクリゾチニブ群の患者62人には250 mgを1日に2回投与した。試験責任医師が判定したPFSを主要評価項目とした。 同試験でも主要評価項目の基準を満たしたため、ALK融合遺伝子変異陽性進行NSCLC患者へのファーストライン治療にはアレクチニブが標準となることをさらに確認できた。試験責任医師らの判定では、クリゾチニブ群のPFSに比べてアレクチニブ群のPFSに有意な改善が見られた(アレクチニブ群は判明せず、クリゾチニブ群のPFS群は11.1か月、HR:0.22、p<0.0001、図1)。これは、副次評価項目である独立評価委員会が判定したPFSとも一致しており(アレクチニブ群は判明せず、クリゾチニブ群のPFS群は10.7か月、HR:0.37、 p<0.0001)、すべてのサブグループでアレクチニブ群に優位性があった。さらにORR(アレクチニブ群91.2%、クリゾチニブ群77.4%)と奏効期間(アレクチニブ群は判明せず、クリゾチニブ群は9.3か月、HR:0.22、p<0.0001)にもアレクチニブの効果が見られている。頭蓋内転移の奏効率に関しては、ベースライン時に測定可能なCNS病変のあった患者でも(アレクチニブ群94.1%、クリゾチニブ群28.6%)、測定可能かどうかを問わず脳転移のある患者でも(アレクチニブ群72.7%、クリゾチニブ群21.7%)、クリゾチニブ群よりアレクチニブ群で高くなった。競合リスクに関する解析結果によると、CNS転移の初めての増悪もしくは死亡の数値も、クリゾチニブ群に比べてアレクチニブ群で有意に低くなっている (アレクチニブ群7.3%、クリゾチニブ群35.5%、原因別HR:0.14、p<0.0001)。 OSに関するデータはこの時点ではまだそろっていなかった。同試験で対象になったアジア人患者の安全性に関するデータも、アレクチニブの既知の安全性プロファイルとほぼ同様だった。
図1:ALESIA試験の主要評価項目:試験責任医師が判定する無増悪生存期間
頭蓋内転移へのブリガチニブの効果
ALK阻害薬による治療を受けたことのない患者に対して説得力のある効果を見せたのが、次世代のALK/ROS1阻害薬、ブリガチニブである。非盲検ランダム化試験の第Ⅲ相ALTA-1L試験の、初回の中間解析結果からは、ブリガチニブ群のPFSがクリゾチニブ群のPFSを上回ったことが示された(HR:0.49、 p=0.0007)[4]。頭蓋内転移への効果について、この中間解析結果の詳細が本総会で報告されている[5]。ベースライン時には両群の1/3の患者にCNS病変が認められた。 ベースライン時に脳転移のあった患者では、全身の病変に関するPFSのHRが0.20だったため、サブグループ解析での最小レベルのひとつに数えられた。CNS病変のない患者のPFSのHRは、統計学的有意性のある水準に届かなかった。その原因はおそらく、追跡期間が短かったためにCNS病変の増悪が脳転移のある患者にとっての初期の増悪として、特に強調されたからだろう。ベースライン時に測定可能な脳転移のあった患者(ブリガチニブ群78%、クリゾチニブ群29%、OR:10.42、p=0.0028)と、あらゆる脳転移を認めた患者(ブリガチニブ群67%、クリゾチニブ群17%、OR: 13.00、p<0.0001)の両者で確認した頭蓋内病変のORRを、ブリガチニブが有意に改善させた。頭蓋内転移に関するPFSについては、ITT解析集団(HR:0.42、p=0.0006)とベースライン時に脳転移のあった患者集団(HR:0.27、p<0.0001)のどちらも、クリゾチニブ群よりもブリガチニブ群で有意に長くなっていた。ベースライン時に脳転移のなかった患者では、頭蓋内転移に関するPFSは判明していない。 探索的な競合リスク解析を行って、ITT解析対象集団のCNS病変の増悪、全身進行、死亡の累積罹患率を推定した。その結果、CNS病変の無増悪期間(これまでに全身進行がない)も全身進行までの期間(これまでにCNS病変が増悪していない)も、クリゾチニブ群に対してブリガチニブ群で有意に延長したことが判明した。
ASCEND-3試験の最終成績
多施設共同単群試験の第Ⅱ相ASCEND-3試験で行った有効性と安全性に関する最終解析でも他の試験と同様に、ALK融合遺伝子変異陽性NSCLCに対する次世代のALK阻害薬セリチニブの優れたベネフィット・リスクプロファイルを確認した[6]。最多で3コースの化学療法を受け、最後の化学療法の実施中または終了後に増悪した、ALK阻害薬による治療を受けたことのない患者124人にセリチニブ750 mg/日を投与したASCEND-3試験で、すでに臨床的意義のあるORR(67.6%)とPFS(16.6か月)が示されている。ベースライン時に認めた脳転移が無症候性もしくは神経学的に安定していれば、適格とした。同試験の登録時にCNS病変が発現していた患者は合計で49人(39.5%)である。 中央値にして52.2か月追跡した時点で、主要評価項目である試験責任医師が判定するORRは67.7%だった(表)。病勢コントロール率は90.3%に、奏効期間の中央値は24.0か月になった。脳転移のあることは転帰に影響せず、病勢コントロール率については脳転移のある患者で87.8%、脳転移のない患者で92.0%となった。患者群全体でPFSは16.6か月、OSは51.3か月に達した。 患者の55%が2コース以上の化学療法を受けているので、これまでに数コースの化学療法を受けたことのある患者にも、セリチニブによって臨床的に意義あるOSの延長があったと著者らは総括している。18か月目に生存していたのは脳転移のある患者の65.5%、脳転移のない患者の78.4%だった。安全性で問題になるようなことは新たに生じず、安全性プロファイルも既知のデータと同様だった。同試験では患者報告アウトカムも評価しており、それによるとセリチニブによる治療中も生活の質をほぼ維持できていた。
セリチニブの投与:空腹時投与か食後投与か?
セリチニブは当初、ALK融合遺伝子変異陽性NSCLCへのファーストライン治療もしくはクリゾチニブ療法の失敗後に、750 mg/日を空腹時に服用することで承認を受けていた。非盲検ランダム化試験である第Ⅰ相ASCEND-8試験では、450 mg/日と600 mg/日を低脂肪食の後に、750 mg/日を空腹時に投与して調べている。この試験で450 mg食後投与群を750 mg空腹時投与群と比べても、定常状態での薬物動態は同等で、消化器症状の発現も少ないことが判明したため、米国やEU加盟国をはじめそれ以外の国でも450 mg/日の食後投与を初回推奨投与量に改めることとなった[8]。未治療患者の主要評価項目および、セリチニブ750 mg空腹時投与群(n=111)に比べた450 mg食後投与群(n=108)と600 mg食後投与群(n=87)の全患者に関する安全性の新データを、Choらが報告した[9]。 450 mgの食後投与は750 mgの空腹時投与と同等の薬物動態および有効性を示し、消化器症状の発現についてはより良い結果を示したことを同試験のデータで確認できた。ORRは450 mg食後投与群が78.1%、600 mg食後投与群が72.5%、750 mg空腹時投与群が75.7%だった。PFSの中央値は450 mg食後投与群が推定不能、600 mg食後投与群が17.0か月、750 mg空腹時投与群が12.2か月である。投与期間中の相対用量強度の中央値は450 mg食後投与群が最高で、3群のうち投与量を減量した患者の割合がこの群で最も少なくなった。消化器症状の発現については、重症度を問わず、750 mg空腹時投与群よりも450 mg食後投与群で少なくなった。
GEOMETRY試験:カプマチニブ
METエクソン14スキップ変異は新規のドライバー変異であり、NSCLC患者の 3~4%で検出されていて[10~12]、これが進行NSCLCの予後不良因子であることも知られている[13]。PD-L1の発現量や遺伝子変異量の多さが顕著であっても、免疫療法も含めた標準治療に反応しづらいことが事前データに現れていた[14、15]。選択性が高い不可逆的MET阻害薬の経口薬カプマチニブ(INC280)は、最も効果の高いMETΔエクソン14変異阻害薬であることが示されている[16]。この阻害薬は血液脳関門を通過するので、脳転移に臨床活性を示すことも事前データに現れている[17、18]。 GEOMETRY mono-1試験の第Ⅱ相試験では、MET遺伝子増幅、METΔエクソン14スキップ変異の両方またはいずれかを検出したⅢB期およびⅣ期のNSCLC患者を対象に、カプマチニブ400 mgの1日2回投与について調べている[19]。両遺伝子変異のほか、これまでの治療経験(未治療患者、これまでに1つまたは2つの治療ラインを受けた患者)も個別に解析した。患者の脳転移が神経学的に安定しているもしくは無症候性であれば、同試験に登録した。 METΔエクソン14変異のある患者集団を、治療経験のある患者で構成するコホート4(n=69)と未治療患者で構成するコホート5b(n=28)に 分けた。両コホートの全員が試験に組み入れられ、募集を締め切った同試験の成績を、本総会でWolfらが報告した[19]。独立評価委員会が盲検下(BIRC)で判定したORRを主要評価項目とし、コホートごとに解析した。
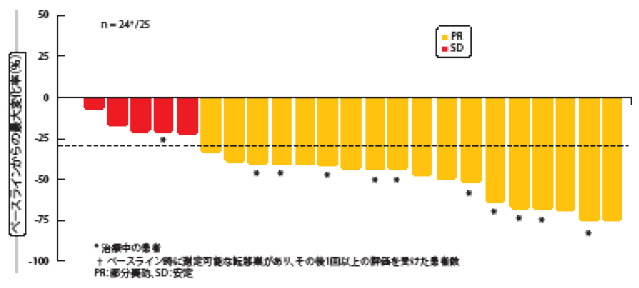
未治療患者への優れた活性
独立評価委員会が盲検化で判定した、治療経験のあるコホート4のORRは39.1%で、病勢コントロール率は78.3%となった。未治療患者で構成するコホート5bでは、ORRが72.0%、病勢コント ロール率が96.0%に達した。この数値は、カプマチニブによるファーストライン治療で、ほぼ完全に腫瘍を制御できたことを示唆している。奏効期間の中央値についてはどちらのコホートのデータもまだそろっていないため、報告はなかった。とりわけコホート5bの大部分の患者に、最大の腫瘍縮小の程度(奏効の深さ)が認められた(図2)。脳転移への活性に関する事前データには、同試験の登録時に未治療のCNS転移巣が複数あった80歳の患者の例が示されていたが、試験開始後1回目のCT検査の画像では脳の転移巣が完全奏効に至っていた。この患者の奏効期間は11.3か月となったが、頭蓋外転移巣が増悪したため最終的にカプマチニブの投与を中止した。 発現率の高さが最高レベルだった有害事象は末梢浮腫、嘔気、血中クレアチニン上昇、下痢、食欲不振、疲労などである。血中クレアチニン値の上昇は腎機能の低下によるものというより、腎臓トランスポーターの阻害によりクレアチニン値が上昇したと思われた。カプマチニブが原因と思われる有害事象により、全体で10.3%の患者への投与が中止となった。 試験責任医師らは結論の中で、METΔエクソン14変異陽性の進行NSCLC患者にカプマチニブをどの治療ラインで使用しても、奏効率には臨床的意義があり、有害事象のプロファイルもコントロール可能だったと指摘した。また、ファーストライン治療でカプマチニブを投与した患者群と、セカンドライン治療あるいはサードライン治療で投与した患者群とに異なる効果が見られため、早期診断・分子標的薬による早期治療の必要性も強調した。
図2:未治療の患者コホートに対して独立評価委員会が盲検下で判定した、腫瘍へのセリチニブの奏効状態
MET/EGFR遺伝子変異陽性NSCLCへのテポチニブ+ゲフィチニブ療法
EGFR-TKI耐性のNSCLC患者には、MET、EGFRの双方を阻害することが有効だと考えられている[20]。非常に選択性の高い経口薬のMET TKIテポチニブは、前臨床試験でMET遺伝子変異のある動物モデルに活性を示したため、EGFR TKIの耐性化を克服しうることを示した[21]。EGFR遺伝子変異とMET遺伝子変異が陽性のNSCLC患者を対象に、テポチニブ+ゲフィチニブ療法を評価する第Ⅰb相試験と第Ⅱ相試験のうち、第Ⅱ相試験で得たデータの報告が本総会でなされた[22]。第Ⅰb相非盲検単群試験の用量漸増期の結果に基づいて、テポチニブ500 mg/日とゲ フィチニブ250 mg/日の併用療法を第Ⅱ相試験での推奨投与量にすることとなった[23]。EGFR遺伝子変異は陽性だがT790M遺伝子変異は陰性の局所進行のNSCLC患者および転移性NSCLC患者で、in situハイブリダイゼーション法によりMET遺伝子の過剰発現(免疫組織化学検査によりMET2+ または3+を検出)とMET遺伝子増幅の両方またはいずれかを検出した患者に、テポチニブ500 mg/日+ゲフィチニブ250 mg/日またはペメトレキセド+シスプラチンとカルボプラチンのどちらかを併用投与した。EGFR TKIへの耐性を獲得していることを組み入れ基準とした。なお、患者はこれまでにHGF-MET経路のシグナル伝達を阻害する分子標的薬の治療を一切受けていない。全体で患者55人が参加し、そのうち31人がテポチニブ+ゲフィチニブの併用療法を受けた。参加患者の応募が低調だったため募集を早い段階で打ち切った。 試験責任医師が判定する無増悪生存期間に関しては、両治療群の間に差異は認められなかった(テポチニブ+ゲフィチニブ群4.9か月、ペメトレキセド+シスプラチン+カルボプラチン群4.4か月、HR:0.71)。しかし、MET遺伝子が過剰発現している(IHC3+)患者については、テポチニブ+ゲフィチニブ群の患者のPFSがほぼ2倍になった(テポチニブ+ゲフィチニブ群8.3か月、ペメトレキセド+シスプラチン+カルボプラチン群4.4か月、HR:0.35)。 MET遺伝子増幅を検出した患者群のPFSに最大の差異が見られ、テポチニブ+ゲフィチニブ群は21.2か月、ペメトレキセド+シスプラチン+カルボプラチン群は4.2か月となった(HR:0.17)。また、MET遺伝子の過剰発現を検出した患者(テポチニブ+ゲフィチニブ群68.4% 、ペメトレキセド+シスプラチン+カルボプラチン群33.3%)と、同増幅を検出した患者(テポチニブ+ゲフィチニブ群66.7%、ペメトレキセド+シスプラチン+カルボプラチン群42.9%)のORRに多大な効果が見られている。 全体で、テポチニブ+ゲフィチニブ群の患者の45.2%、ペメトレキセド+シスプラチン+カルボプラチン群の患者の33.3%が治療に反応した。テポチニブ+ゲフィチニブの忍容性は比較的高く、大半のAEは軽度もしくは中等度だった。
参考文献:
- Camidge DR et al., Updated efficacy and safety data from the global phase III ALEX study of alectinib (ALC) vs crizotinib (CZ) in untreated advanced ALK+ NSCLC. J Clin Oncol 36, 2018 (suppl; abstr 9043)
- Hida T et al., Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer (J-ALEX): an open-label, randomised phase 3 trial. Lancet 2017; 390(10089): 29-39
- Zhou C et al., Primary results of ALESIA: a randomised, phase III, open-label study of alectinib versus crizotinib in Asian patients with treatment-naïve ALK+ advanced NSCLC. ESMO 2018, abstract LBA10
- Camidge DR et al., Brigatinib versus crizotinib in ALK-positive non-small cell lung cancer. N Engl J Med 2018
- Popat S et al., Intracranial efficacy of brigatinib vs crizotinib in the phase 3 ALTA-1L trial. ESMO 2018, abstract LBA58
- Felip E et al., Phase II study of ceritinib in ALK inhibitor (ALKi)-naïve patients with ALK-rearranged non-small cell lung cancer: final efficacy and safety results from ASCEND-3. ESMO 2018, abstract LBA57
- Felip E et al., Phase 2 study of ceritinib in ALKi-naïve patients (pts) with ALK-rearranged (ALK+) non-small cell lung cancer (NSCLC): whole body responses in the overall pt group and in pts with baseline brain metastases (BM). Ann Oncol 2016; 27(suppl 6): 416-454
- Cho B et al., ASCEND-8: A Randomized Phase 1 Study of Ceritinib, 450 mg or 600 mg, Taken with a Low-Fat Meal versus 750 mg in Fasted State in Patients with Anaplastic Lymphoma Kinase (ALK)-Rearranged Metastatic Non-Small Cell Lung Cancer (NSCLC). J Thorac Oncol 2017; 12(9): 1357-1367
- Cho B et al., Primary efficacy and updated safety of ceritinib (450 mg or 600 mg) with food vs. 750 mg fasted in ALK+ metastatic NSCLC (ASCEND-8). ESMO 2018, abstract LBA59
- Reungwetwattana T et al., The race to target MET exon 14 skipping alterations in non-small cell lung cancer: The Why, the How, the Who, the Unknown, and the Inevitable. Lung Cancer 2017; 103: 27-37
- Gelsomino F et al., MET and small-cell lung cancer. Cancers (Basel) 2014; 6(4): 2100-2115
- Ma PC, MET receptor juxtamembrane exon 14 alternative spliced variant: novel cancer genomic predictive biomarker. Cancer Discov 2015; 5(8): 802-805
- Awad MM et al., Impact of MET inhibitors on survival among patients (pts) with MET exon 14 mutant (METdel14) non-small cell lung cancer (NSCLC). J Clin Oncol 35, 2017 (suppl; abstr 8511)
- Sabari JK et al., PD-L1 expression and response to immunotherapy in patients with MET exon 14-altered non-small cell lung cancers (NSCLC). J Clin Oncol 35, 2017 (suppl; abstr 8512)
- Sabari JK et al., PD-L1 expression, tumor mutational burden, and response to immunotherapy in patients with MET exon 14 altered lung cancers. Ann Oncol 2018; 29(10): 2085-2091
- Fujino T et al., In vitro evaluation for optimal MET-TKI selection in lung cancers with MET mutations including exon 14 skipping WCLC 2018, abstract P1.13-41
- Wolf J et al., GEOMETRY Mono-1: phase II, multicenter study of MET inhibitor capmatinib (INC280) in EGFR wt, MET-dysregulated advanced NSCLC. WCLC 2017, abstract P2.04-005
- Shih K et al., SNO 2016, Poster ACTR-45
- Wolf J et al., Results of the GEOMETRY mono-1 phase II for evaluation of the MET inhibitor capmatinib (INC280) in patients with METΔEx14 mutated advanced non-small cell lung cancer. ESMO 2018, abstract LBA52
- Baldacci S et al., Outcome of EGFR-mutated NSCLC patients with MET-driven resistance to EGFR tyrosine kinase inhibitors. Oncotarget 2017; 8(62): 1051030-105114
- Friese-Hamim M et al., The selective c-Met inhibitor tepotinib can overcome epidermal growth factor receptor inhibitor resistance mediated by aberrant c-Met activation in NSCLC models. Am J Cancer Res 2017; 7(4): 962-972
- Cheng Y et al., Phase 2 study of tepotinib + gefitinib in MET-positive/epidermal growth factor receptor-mutant NSCLC. ESMO 2018, abstract 13770
- Wu YL et al., Phase Ib study of tepotinib in EGFR-mutant/c-Met-positive NSCLC: Final data and long-term responders. J Clin Oncol 35, 2017 (suppl; abstr 8547)
More posts
インタビュー:EGFR TKI療法の順番を重視するいくつかの理由
インタビュー:EGFR TKI療法の順番を重視するいくつかの理由 著者所有 Maximilian Hochmair, MD、オーストリア・ウィーン、Otto Wagner
EGFR遺伝子変異陽性肺がん:活性および耐性に関する新たな知見とは?
EGFR遺伝子変異陽性肺がん:活性および耐性に関する新たな知見とは? エルロチニブをネオアジュバント療法に使用する ⅢA~N2期のNSCLC患者に現在行っている集学的治療に
すべての治療ラインで免疫チェックポイント阻害薬が優位に
すべての治療ラインで免疫チェックポイント阻害薬が優位に ネオアジュバント療法:NEOSTAR試験 初期の局所進行(Ⅰ~ⅢA期)非小細胞肺がん(NSCLC)患者には通常、手術
巻頭言
巻頭言 著者所有 Sanjay Popat, PhD, FRCP 英国・ロンドン 王立マーズデン病院 胸部腫瘍内科コンサルタント 臨床医の皆様へ 欧州臨床腫瘍学会(ESM


![頭蓋内転移へのブリガチニブの効果 ALK阻害薬による治療を受けたことのない患者に対して説得力のある効果を見せたのが、次世代のALK/ROS1阻害薬、ブリガチニブである。非盲検ランダム化試験の第Ⅲ相ALTA-1L試験の、初回の中間解析結果からは、ブリガチニブ群のPFSがクリゾチニブ群のPFSを上回ったことが示された(HR:0.49、 p=0.0007)[4]。頭蓋内転移への効果について、この中間解析結果の詳細が本総会で報告されている[5]。ベースライン時には両群の1/3の患者にCNS病変が認められた。 ベースライン時に脳転移のあった患者では、全身の病変に関するPFSのHRが0.20だったため、サブグループ解析での最小レベルのひとつに数えられた。CNS病変のない患者のPFSのHRは、統計学的有意性のある水準に届かなかった。その原因はおそらく、追跡期間が短かったためにCNS病変の増悪が脳転移のある患者にとっての初期の増悪として、特に強調されたからだろう。ベースライン時に測定可能な脳転移のあった患者(ブリガチニブ群78%、クリゾチニブ群29%、OR:10.42、p=0.0028)と、あらゆる脳転移を認めた患者(ブリガチニブ群67%、クリゾチニブ群17%、OR: 13.00、p](https://memoinoncology.com/wp-content/uploads/2020/03/Grafik-9-esmo-lung-cancer-2018-jp.png)