Inmunoterapia: actualizaciones sobre ensayos clínicos y otras perspectivas
Nivolumab más ipilimumab: Estudio CheckMate 012
Además de los fármacos dirigidos contra mutaciones iniciadoras, las inmunoterapias representan uno de los dos avances recientes más importantes del último decenio en el tratamiento del cáncer de pulmón no microcítico (CPNM) metastásico. Nivolumab e ipilimumab potencian la actividad antitumoral de linfocitos T por mecanismos diferentes y complementarios. La combinación de estos dos fármacos ya ha sido autorizada en los EE.UU. y la UE para tratar el melanoma metastásico. En el CPNM, la monoterapia con nivolumab se encuentra autorizada como tratamiento de segunda línea de la enfermedad localmente avanzada o metastásica, mientras que el estándar de tratamiento de primera línea sigue consistiendo en un doblete de quimioterapia con platino. Los progresos hacia mejores opciones terapéuticas de primera línea se han estabilizado en el último decenio y la necesidad de mejoras en este contexto clínico resulta esencial.
Por consiguiente, en el ensayo fase I, aleatorizado y con tres brazos CheckMate 012 se investigó la utilidad de la inmunoterapia combinada en pacientes con CPNM avanzado (estadio IIIB/IV) de cualquier histología. El tratamiento consistió en nivolumab 1 mg/kg cada dos semanas más ipilimumab 1 mg/kg cada seis semanas, nivolumab 3 mg/kg cada dos semanas más ipilimumab 1 mg/kg cada 12 semanas o nivolumab 3 mg/kg cada dos semanas más ipilimumab 1 mg/kg cada seis semanas. Datos anteriores indicaron que la eficacia fue máxima en los dos brazos que recibieron nivolumab 3 mg/kg. El análisis actualizado que se presentó en el congreso de la ASCO se llevó a cabo tras un seguimiento ampliado de estos dos brazos, que contaron con 38 (nivolumab más ipilimumab cada 12 semanas) y 39 (nivolumab más ipilimumab cada seis semanas) pacientes, respectivamente [1]. La seguridad y tolerabilidad se definieron como objetivos principales.
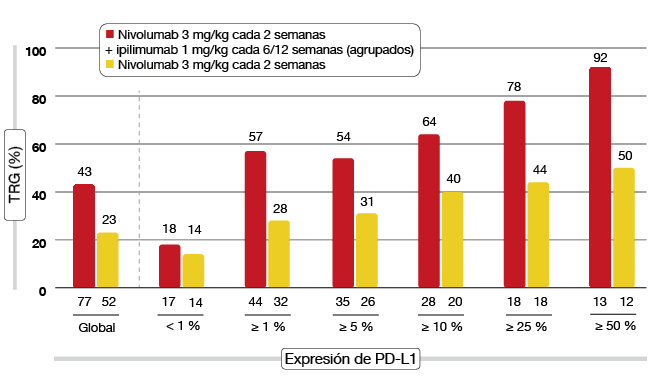
Figura 1: Estudio CheckMate 012: análisis conjunto de TRG con dos pautas de nivolumab más ipilimumab con diferentes grados de expresión de PD-L1, comparadas con nivolumab en monoterapia.
Tolerabilidad mejorada y eficacia prometedora
Comparados con regímenes combinados más antiguos incluidos en el estudio CheckMate 012, en los que se utilizaron dosis más altas o más frecuentes de ipilimumab, estos regímenes posológicos mostraron una mejor tolerabilidad y un perfil de seguridad controlable. Se produjeron acontecimientos adversos (AA) grado 3/4 relacionados con el tratamiento en el 37 % y 33 % de los pacientes, respectivamente: la tasa de discontinuaciones motivadas por estos AA fue equivalente a una tercera parte de la observada en los brazos del estudio más antiguos (5 % y 8 %, respectivamente). No se observaron muertes relacionadas con el tratamiento. De modo tranquilizador, la incidencia global de AA relacionados con la inmunidad grado 3/4 fue baja en todos los brazos de tratamiento. Estos datos fueron similares a los de un brazo independiente del estudio CheckMate 012 en el que se empleó monoterapia con nivolumab 3 mg/kg cada dos semanas.
El análisis deparó una eficacia prometedora, con una tasa de respuesta global (TRG) del 47 % y 39 %, respectivamente. Estas TRG superaron a las obtenidas con la monoterapia con nivolumab (23 %). Aún no se había alcanzado la mediana de duración de la respuesta. Según un análisis conjunto de biomarcadores, la eficacia aumentó al hacerlo la expresión de PD-L1 y los pacientes tratados con la combinación mostraron una mejor evolución que el grupo histórico tratado únicamente con nivolumab con todos los grados de expresión de PD-L1 (Figura 1). Además, se observó superioridad de la combinación respecto a la monoterapia con nivolumab en los no fumadores y los fumadores activos o ex fumadores por igual. Los pacientes con mutaciones en EGFR presentaron TRG notablemente mayores con nivolumab más ipilimumab que con nivolumab en monoterapia. Las respuestas obtenidas con la combinación tendieron a ser profundas y duraderas y se lograron pronto en la mayoría de los casos. La pauta de nivolumab 3 mg/kg cada dos semanas más ipilimumab 1 mg/kg cada seis semanas se está evaluando en otros estudios, entre ellos, el ensayo fase III CheckMate 227.
Beneficio en supervivencia duradero de nivolumab en los estudios CheckMate 017 y 057
Nivolumab en monoterapia produjo un beneficio significativo en supervivencia global (SG) comparado con docetaxel en el CPNM avanzado en los ensayos fase III CheckMate 017 (histología epidermoide) [2] y CheckMate 057 (histología no epidermoide) [3]. Borghaei y cols. presentaron los resultados actualizados de SG y seguridad de estos dos estudios, basados en un seguimiento mínimo de dos años [4]. Además, se realizaron análisis exploratorios de la asociación entre perfiles basales de citocinas séricas y SG en ambas histologías.
En ambos ensayos, nivolumab deparó una SG y supervivencia libre de progresión (SLP) a largo plazo duraderas comparado con docetaxel. Las diferencias en SG y SLP entre los brazos de nivolumab y docetaxel siguieron siendo consistentes al cabo de entre uno y dos años. A los dos años, el 23 % y 8 % de los pacientes de los brazos de nivolumab y docetaxel, respectivamente, seguían vivos en el estudio CheckMate 017 (HR, 0,62). En el estudio CheckMate 057, estos porcentajes fueron del 29 % y 16 %, respectivamente (HR, 0,75). En el estudio CheckMate 057, al igual que en el análisis principal, el grado de expresión de PD-L1 se asoció a la magnitud del beneficio en SG. En ambos estudios se notificaron AA relacionados con el tratamiento en una menor proporción de pacientes tratados con nivolumab que con docetaxel . En conjunto, las tasas de AA a los dos años se asemejaron a las observadas al cabo de un año.
Las puntuaciones de citocinas, que reflejan el perfil de citocinas en el momento basal, parecieron asociarse al pronóstico en la histología epidermoide y no epidermoide, aunque estos resultados solo sirven para generar hipótesis y requieren validación prospectiva. Las puntuaciones de citocinas no se asociaron a efectos terapéuticos de nivolumab con respecto a docetaxel.
Resultados a largo plazo con pembrolizumab
A tenor de los resultados obtenidos en el estudio KEYNOTE-001, un ensayo fase Ib extenso con varias cohortes [5, 6], pembrolizumab fue objeto de aprobación acelerada en los Estados Unidos como tratamiento del CPNM avanzado que muestra expresión de PD-L1 y ha presentado progresión tras administrar quimioterapia con platino y, en caso de positividad para EGFR o ALK, un inhibidor de EGFR o ALK autorizado. En el estudio KEYNOTE-001 se constató una correlación entre expresión de PD-L1 y mejor pronóstico.
El análisis a largo plazo del estudio KEYNOTE-001 reveló que la monoterapia con pembrolizumab depara un beneficio mantenido en SG en pacientes con CPNM avanzado [7]. Una mayor expresión de PD-L1 se asoció a un mayor beneficio en supervivencia. Pembrolizumab siguió teniendo un perfil de seguridad controlable; durante el seguimiento a largo plazo no se produjo toxicidad inesperada. Junto con el estudio KEYN0TE-010, en el que se demostró una mejoría en SG con pembrolizumab en pacientes con CPNM tratado previamente y expresión de PD-L1 en ≥ 1 % de las células tumorales [8], estos datos respaldan el uso de PD-L1 como biomarcador predictivo de pembrolizumab y confirman el perfil de seguridad controlable de este fármaco.
La mejoría en SG con atezolizumab se manifiesta con el tiempo
Atezolizumab, un anticuerpo anti-PD-L1 humanizado y obtenido mediante genomanipulación, se comparó con docetaxel en el estudio fase II, abierto, multicéntrico y aleatorizado POPLAR en pacientes con CPNM localmente avanzado o metastásico tratados previamente que habían mostrado progresión durante o después de administrar quimioterapia basada en platino. Al cabo de un seguimiento mínimo de 13 meses se realizó el análisis principal, que puso de manifiesto un beneficio en SG de atezolizumab respecto a docetaxel en pacientes no seleccionados y seleccionados por PD-L1 [9, 10]. Una mayor expresión de PD-L1 en células tumorales o inmunitarias se asoció a un mayor beneficio en SG. Las curvas de supervivencia mostraron una separación tardía, lo que recalca la necesidad de un seguimiento a largo plazo para identificar plenamente los beneficios de este tratamiento anti-PD-L1.
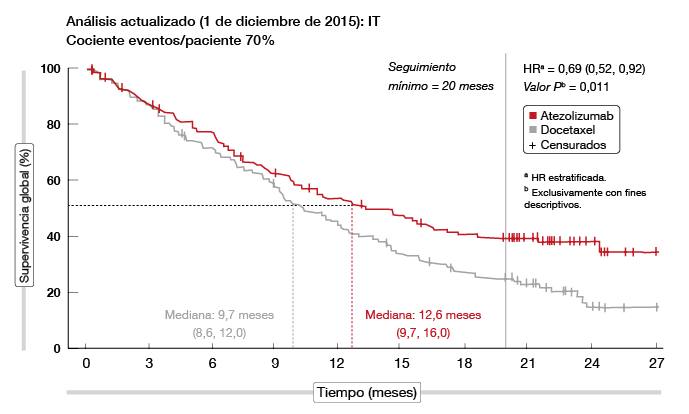
Por consiguiente, Smith y cols. presentaron un análisis actualizado al cabo de un seguimiento mínimo de 20 meses [11]. En él se constató una mayor separación de las curvas de supervivencia en la población IT (Figura 2). En consonancia con el patrón anterior, las hazard ratios (HR) de SG mejoraron a favor de atezolizumab a lo largo del tiempo. El beneficio en SG se observó en todos los subgrupos de PD-L1. Además, las curvas de supervivencia correspondientes a los subgrupos histológicos presentaron una separación continuada a lo largo del tiempo, con una mejoría más pronunciada en HR en el subgrupo de CPNM epidermoide. La SLP y TRG fueron semejantes en los brazos de atezolizumab y docetaxel en la población IT; en este caso, los datos no variaron significativamente respecto a los del análisis principal.
Según indicaron los autores, la falta de correlación entre beneficio en SG y hallazgos de SLP y TRG supone que la mejoría en SG con atezolizumab podría ampliarse tras la progresión de la enfermedad según los criterios RECIST. No obstante, las respuestas observadas con atezolizumab fueron duraderas (mediana, 18,6 y 7,2 meses con atezolizumab y docetaxel, respectivamente). En conjunto, estos resultados aportan nuevas evidencias de que los beneficios en supervivencia de atezolizumab se extienden a todos los pacientes con CPNM.
Figura 2: Resultados actualizados de SG con atezolizumab frente a docetaxel en el estudio POPLAR
Durvalumab muestra eficacia en la histología epidermoide y no epidermoide
En un ensayo fase I/II, abierto, multicéntrico, de escalada y ampliación de dosis se investigó la seguridad y eficacia clínicas de durvalumab en pacientes con CPNM avanzado no tratados previamente [12]. Durvalumab es un anticuerpo monoclonal humano anti-PD-L1, obtenido mediante genomanipulación, selectivo y de elevada afinidad. La expresión de PD-L1 se evaluó de manera prospectiva (alta: tinción de células tumorales ≥ 25 %; baja o negativa: tinción de células tumorales < 25 %). Se trató a 59 pacientes que no habían recibido tratamiento sistémico previo para la enfermedad avanzada. Cuarenta y nueve de ellos mostraron una expresión alta de PD-L1.
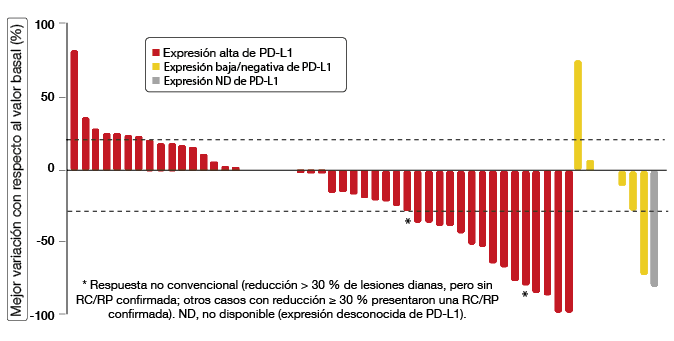
Se comprobó que durvalumab 10 mg/kg cada dos semanas tiene un perfil controlable de seguridad. La TRG fue del 27 %; se produjeron respuestas en el 29 % de los pacientes con expresión alta de PD-L1 y en el 11 % de aquellos con expresión baja o negativa. Un paciente con expresión alta presentó una remisión completa. Se observaron reducciones de lesiones diana en pacientes con expresión alta y baja/negativa de PD-L1, así como en uno con expresión desconocida de PD-L1 (Figura 3). La TRG fue similar con independencia de la histología (epidermoide o no) en los pacientes con expresión alta de PD-L1. En tres pacientes con histología no epidermoide y expresión baja o negativa de PD-L1 no se produjeron respuestas. Los fumadores activos o ex fumadores con expresión alta presentaron una TRG > 30 %, En general, las respuestas fueron rápidas y duraderas; en la fecha de corte de los datos, seguían en curso en el 69 % de los casos. Durvalumab está investigándose actualmente en diversos estudios realizados en pacientes con CPNM avanzado no tratados previamente.
Figura 3: Mejores variaciones del tamaño tumoral con respecto al momento basal según la expresión de PD-L1 obtenidas con durvalumab
JAVELIN: avelumab en el mesotelioma refractario a quimioterapia
En los EE.UU. se diagnostican unos 3000 casos de mesotelioma maligno cada año. No existen opciones terapéuticas autorizadas por la FDA para los pacientes que muestran progresión tras la quimioterapia de primera línea. En el estudio JAVELIN, un ensayo fase Ib, internacional, con varias cohortes, de escalada y ampliación de dosis, se investigó el uso de avelumab, un anticuerpo anti-PD-L1 totalmente humano, en el mesotelioma basándose en la expresión de PD-L1 en la superficie de las células mesoteliomatosas [13]. En el estudio JAVELIN participó un total de 1600 pacientes con diferentes tipos de tumores. Cincuenta y tres pacientes con mesotelioma pleural o peritoneal avanzado e irresecable, que habían mostrado progresión tras un tratamiento con platino y pemetrexed, recibieron avelumab 10 mg/kg cada dos semanas. Se evaluó la expresión de PD-L1, que reveló la presencia de tinción de cualquier intensidad (≥ 1 % de las células tumorales) en el 51,3 % de los casos.
La monoterapia con avelumab deparó una tasa de control de la enfermedad del 56,6 %, que se debió principalmente a estabilización de la enfermedad (47,2 %). Cinco pacientes presentaron respuestas parciales (9,4 %), en cuatro de los cuales seguían en curso en el último seguimiento. No se alcanzó la mediana de duración de la respuesta. La TRG y SLP no difirieron en función del grado de expresión de PD-L1.
En conjunto, la mediana de SLP fue de 17,1 semanas. Avelumab mostró un perfil de seguridad aceptable. La mayoría de los AA relacionados con el tratamiento fueron grado 1 o 2. Se observaron AA de mediación inmunitaria de cualquier grado en el 13,2 % de los pacientes, pero solo se produjeron acontecimientos grado 3 en el 1,9 %. El seguimiento en curso definirá mejor la duración de la actividad clínica.
¿Es viable el tratamiento después de la progresión según los criterios RECIST?
En el contexto de la inmunoterapia, existe incertidumbre respecto al uso como objetivo de las reducciones tumorales según los criterios RECIST, ya que parece que la evaluación de la contracción tumoral infravalora la verdadera magnitud del beneficio en supervivencia. Ello podría estar justificado, dado que los criterios de respuesta convencionales se basan en la quimioterapia citotóxica tradicional y la exacerbación o seudoprogresión tumoral puede conllevar la discontinuación prematura del tratamiento. Algunos casos anecdóticos de reducción del tamaño tumoral tras progresión inicial definida según los criterios RECIST han dado lugar a ensayos en los que se permite el tratamiento tras la primera progresión definida según los criterios RECIST.
Un análisis exploratorio retrospectivo presentado en el congreso de la ASCO describió los hallazgos observados en pacientes con CPNM metastásico que recibieron tratamiento anti-PD-1 después de progresión convencional (tratamiento tras progresión, TTP) [14]. Los investigadores agruparon tres ensayos clínicos multicéntricos que se habían presentado ante la FDA, en los que se evaluó la monoterapia anti-PD-1 en 535 pacientes que habían mostrado progresión después del tratamiento inicial. De ellos, se identificó a 121 pacientes que recibieron TTP. A partir de datos de mediciones radiológicas del tumor se evaluaron las variaciones de la carga tumoral tras progresión definida según los criterios RECIST.
Comparado con todos los pacientes tratados con anti-PD-1 (n = 535), el subgrupo con TTP presentó una frecuencia ligeramente mayor de histología no epidermoide (59 % frente al 54 %). La mayoría de los pacientes solo habían recibido una línea previa de quimioterapia y todos ellos tenían un estado funcional del ECOG de 0 o 1, aunque un ECOG 0 fue más frecuente en el grupo de TTP (36 % frente al 25 %). Los pacientes que recibieron TTP mostraron progresión inicial según los criterios RECIST debido a progresión inequívoca de lesiones no diana (38 %), aparición de lesiones nuevas (32 %) o aumento ≥ 20 % con respecto al nadir de lesiones diana (30 %). Se observaron superposiciones de dos causas o de las tres causas.
Un efecto pequeño, pero no insignificante
De los 121 pacientes que recibieron TTP, 10 (8,3 %) manifestaron una contracción tumoral adicional, que se definió como una disminución posterior de las lesiones diana ≥ 30 %, comparada con el momento basal. En la Tabla se resumen las características de estos pacientes. Este grupo representa el 1,9 % de todos los pacientes tratados con fármacos anti-PD-1 en estos ensayos. Las mayores reducciones tumorales con respecto al momento basal durante el TTP oscilaron entre el 35 % y 100 % (mediana, 58 %). Con TTP, no se alcanzó la mediana de duración de la respuesta después de una reducción ≥ 30 %. En el momento de recogida de datos, al menos 5 de los 10 pacientes presentaban respuestas de seis meses, como mínimo, y tres, respuestas en curso de más de un año.
Además, las mayores reducciones de las lesiones diana se dieron en pacientes que lograron una reducción mínima del 30 %, comparadas con las mediciones nadir globales. Siete de los 10 pacientes cumplieron estos criterios. La mayor contracción tumoral comparada con el nadir osciló entre el 13 % y 100 %, con una mediana de reducción del 35 %, La duración de las respuestas nuevas mostró un rango amplio, de 1,3 meses a más de un año.
Según las conclusiones de los autores, no está claro si las reducciones tumorales observadas se debieron al TTP o a un efecto diferido de la inmunoterapia que habían recibido previamente los pacientes. Ello supone que el riesgo de continuar con el tratamiento (reacciones adversas relacionadas con la inmunidad) tras la primera progresión debe sopesarse con la posibilidad de una contracción tumoral adicional. A medida que se adquieran más conocimientos sobre el uso de inmunoterapias, quizá sea posible identificar mejor a los pacientes con más probabilidades de beneficiarse del TTP (por ejemplo, biomarcadores, características de los pacientes). Se precisan ensayos aleatorizados y controlados para determinar de manera prospectiva los beneficios de tratar a los pacientes tras la primera progresión. Sin embargo, es poco probable que el TTP modifique significativamente los resultados de los principales objetivos administrativos de la FDA o la determinación de beneficios/riesgos.
BIBLIOGRAFÍA
- Hellmann MD et al., CheckMate 012: safety and efficacy of first-line nivolumab and ipilimumab in advanced NSCLC. J Clin Oncol 34, 2016 (suppl; abstr 3001)
- Brahmer J et al., Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373: 123-135
- Borghaei H et al., Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373: 1627-1639
- Borghaei H et al., Nivolumab vs. docetaxel in patients with advanced NSCLC: CheckMate 017/057 2-year update and exploratory cytokine profile analyses. J Clin Oncol 34, 2016 (suppl; abstr 9025)
- Garon EB et al., Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 2015; 372: 2018-2028
- Chatterjee M et al., Systematic evaluation of pembrolizumab dosing in patients with advanced non-small-cell lung cancer. Ann Oncol. 2016 Apr 26. pii: mdw174. [Epub ahead of print]
- Hui R et al., Long-term overall survival for patients with advanced NSCLC enrolled in the KEYNOTE-001 study of pembrolizumab. J Clin Oncol 34, 2016 (suppl; abstr 9026)
- Herbst RS et al., Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387: 1540-1550
- Vansteenkiste J et al., Atezolizumab monotherapy vs docetaxel in 2L/3L non-small cell lung cancer: Primary analyses for efficacy, safety and predictive biomarkers from a randomized phase II study (POPLAR). ECC 2015, abstract 14LBA
- Fehrenbacher L et al., Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016; 387(10030): 1837-1846
- Smith DA et al., Updated survival and biomarker analyses of a randomized phase II study of atezolizumab vs. docetaxel in previously treated NSCLC (POPLAR). J Clin Oncol 34, 2016 (suppl; abstr 9028)
- Antonia S et al., Safety and clinical activity of durvalumab (MEDI4736), an anti-PD-L1 antibody, in treatment-naïve patients with advanced non-small cell lung cancer. J Clin Oncol 34, 2016 (suppl; abstr 9029)
- Hassan R et al., Avelumab (MSB0010718C; anti-PD-L1) in patients with advanced unresectable mesothelioma from the JAVELIN solid tumor phase Ib trial: Safety, clinical activity, and PD-L1 expression. J Clin Oncol 34, 2016 (suppl; abstr 8503)
- Kazandjian D et al., Characterization of patients treated with a programmed cell death protein 1 inhibitor (anti-PD-1) past RECIST progression from a pooled analysis of metastatic non-small cell lung cancer (mNSCLC) trials. J Clin Oncol 34, 2016 (suppl; abstr 3000)