(新)辅助策略改善早期条件下的结果
约30%的NSCLC患者在诊断时表现出可切除的疾病[1-3]。手术是早期NSCLC的主要治疗方法。切除后,对于II/IIIA期肺癌患者和IB期疾病的选定患者,会建议采用基于顺铂的辅助化疗[4]。然而,手术和辅助化疗后疾病复发率或死亡率仍然很高,从IB期的45%至III期的76% [5]。显然,对改善临床结果的有效新疗法的需求尚未得到满足。
ADAURA:奥希替尼的辅助使用
第三代EGFR TKI奥希替尼已被确立为EGFR突变晚期NSCLC患者的一线和二线标准治疗方案。基于观察到该药物的疗效和安全性特征提示在早期疾病中具有活性[6],通过双盲、随机、III期ADAURA试验在已经历完全切除的EGFR突变(即,外显子19缺失或L858R突变)的非鳞状肺癌患者中,对每日80 mg奥希替尼(n = 339)与安慰剂(n = 343)进行了比较。组织学显示切缘阴性,包括脑部CT或MRI扫描在内的成像均未发现疾病。允许在随机分组前给予术后标准辅助化疗,但不允许放疗。在无辅助化疗或有辅助化疗的情况下,手术与随机分组之间的最大间隔分别为10或26周。计划的治疗时间为三年。两组分别有大约三分之一的患者属于IB、II和IIIA期,并且55%的患者接受了辅助化疗。
II/IIIA期患者的无病生存被定义为主要终点。
根据独立数据监测委员会的建议,由于奥希替尼治疗的压倒性优势,该研究提前两年揭盲。在ASCO大会上,Herbst等人报告了ADAURA试验的计划外中期分析[7]。在揭盲时,该研究已完成登记,并且所有患者均已随访至少一年。
风险大幅降低
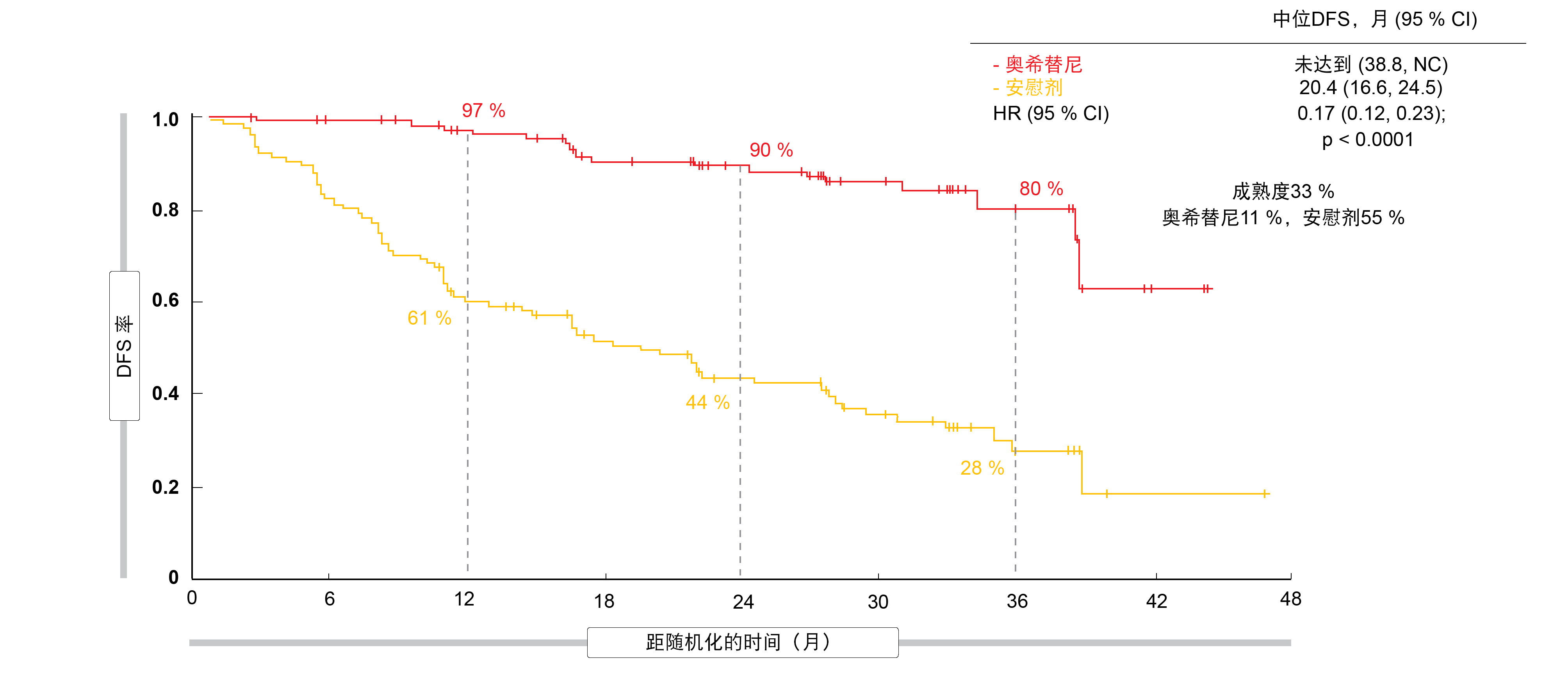
对于主要终点,奥希替尼治疗可导致II/IIIA期疾病患者的疾病复发或死亡风险降低83%。中位DFS在实验组中尚未达到,在对照组中为20.4个月(HR,0.17;p < 0.0001;图1)。还达到了DFS在总体群体中的关键次要终点。即使增加IB期疾病的低风险患者,风险降低仍达到79%(未达到与28.1个月;HR,0.21;p < 0.0001)。在两年时,DFS率分别为89%和53%。
所有预先指定的亚组均受益于奥希替尼治疗;值得注意的是,无论患者是否曾接受过先前的辅助化疗,DFS均得到改善。根据疾病分期进行的分析显示,在奥希替尼组中,两年DFS率在IB期(87%)、II期(91%)和IIIA期(88%)中保持较高,而在安慰剂组中,两年DFS率随期数增加而迅速下降。因此,风险比表明,II期(0.17)和IIIA期(0.12)的风险降低最大。OS的结果还不完善,但中期分析已经提示60%的获益(HR,0.40)。辅助奥希替尼的安全性特征符合已建立的安全性。腹泻是在46%的患者中出现的最常见AE,其次是甲沟炎(25%)和皮肤干燥(23%)。AE通常较轻。在10名接受奥希替尼治疗的患者中报告了1/2级间质性肺疾病(3%),并且分别有22名(7%)和4名(1%)患者出现QTc延长。
作者在其总结中指出,辅助奥希替尼是全球性试验中的首个靶向药物,在IB/II/IIIA期、EGFR突变的NSCLC患者中,DFS显示出统计学显著且有临床意义的改善。因此,奥希替尼代表了一种完全切除肿瘤后的高效、可改变实践的治疗方法。
图1: ADAURA研究的主要终点:II/IIIA期疾病患者的无病生存率
CTONG1104:吉非替尼与化疗的OS
随机III期CTONG 1104试验已证实,在EGFR突变、完全切除的II/IIIA期NSCLC中,与包括长春瑞滨加顺铂的标准双药化疗相比,每天250 mg的第一代EGFR TKI吉非替尼辅助治疗具有明显的DFS益处[8]。Wu等人在ASCO大会上提出了在中位随访80.0个月后的最终OS结果[9]。意向性治疗(ITT)群体在每个治疗组中包括111名患者,而按方案(PP)群体在吉非替尼组和化疗组分别包括106名和87名患者。
根据分析,在两个群体中,吉非替尼与化疗相比提高了生存益处,中位OS分别为75.5和62.8个月,尽管这一差异并不显著(HR,0.92)。在ITT组中,五年OS率为53.2%和51.2%,PP群体的结果类似。作者指出,与历史数据相比,吉非替尼组的OS结果是在完全切除的IIB/IIIA NSCLC中观察到的最佳值之一[10]。DFS的最新研究结果显示,吉非替尼有显著益处(30.8个月与19.8个月),ITT和PP群体中的复发和死亡风险分别降低44%和49%(分别为p = 0.001和< 0.001)。然而,这种优势并没有转化为显著的OS差异。
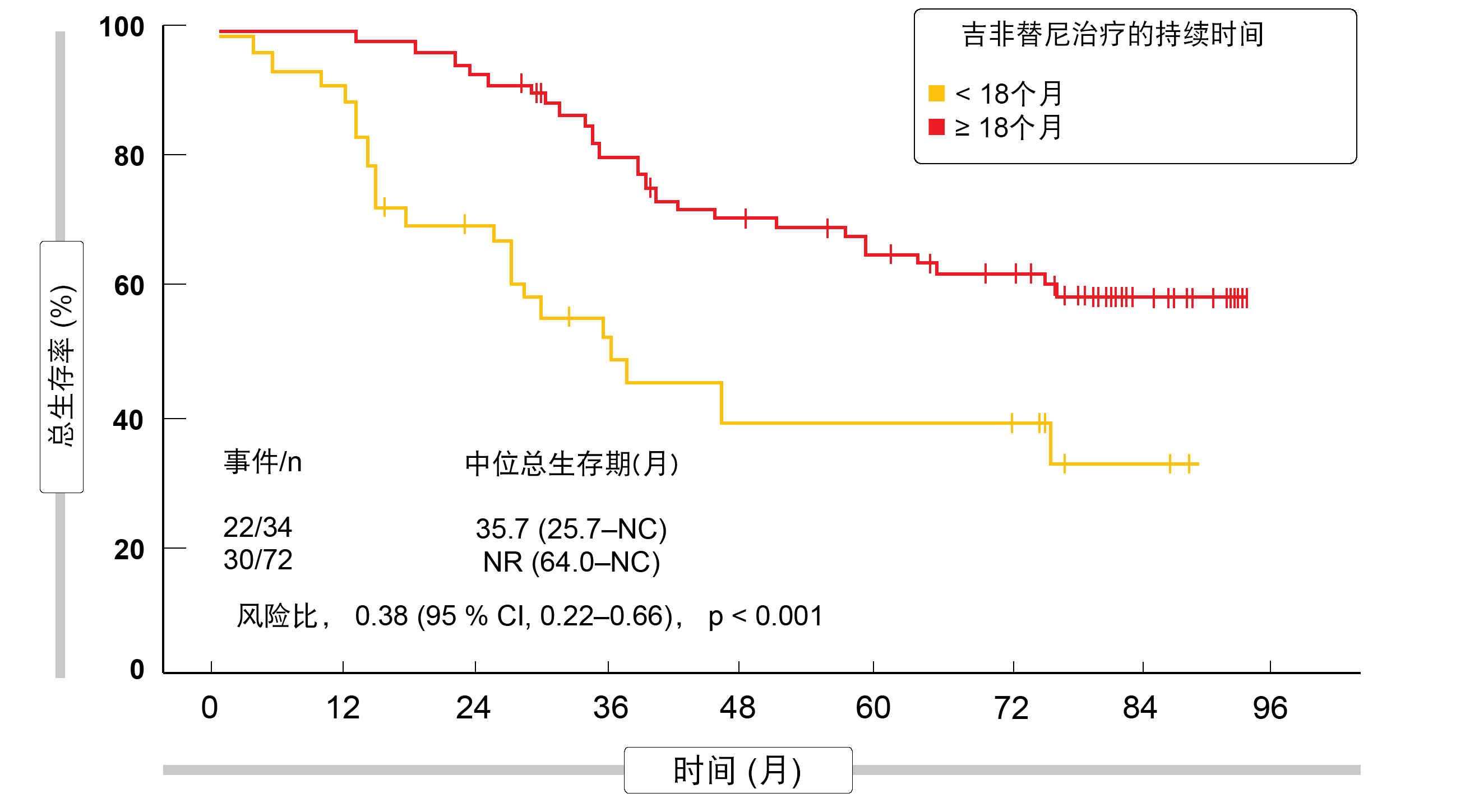
根据事后分析,吉非替尼组中接受后续TKI治疗的患者与两组中接受其他后续治疗或没有后续治疗的患者相比,实现了最长的OS(p < 0.001)。在接受吉非替尼然后接受奥希替尼治疗的个体中,应答率最高,为55.6%。此外,接受吉非替尼治疗至少18个月的患者的OS明显优于治疗持续时间<18个月的患者(HR,0.38;p <0.001;图2)。作者得出结论,对于完全切除的、EGFR突变的II/IIIA期NSCLC患者,应将辅助EGFR TKI治疗视为改善DFS并获得可能延长的OS的最佳方式。
图2: CTONG1104试验中与辅助吉非替尼治疗时间有关的总生存率
放化疗前的阿特朱单抗
早期NSCLC的新辅助PD-1/PD-L1阻断已被证明是可行的,并且与高病理学应答率相关[11-14]。因此,单组的II期AFT-16试验探讨了在无法切除的IIIA/B期NSCLC患者中,在根治性放化疗(CRT)之前使用新辅助阿特朱单抗的风险和益处[15]。分析中包括62人。他们在CRT前接受了共四个周期的每三周1200 mg阿特朱单抗的治疗。CRT后,施用辅助阿特朱单抗完成一年的治疗。
构成主要终点的12周疾病控制率为77.4%。49名患者的基线PD-L1表达状态可用。在PD-L1表达< 1%和≥ 1%的组中,疾病控制率分别为82.4%和90.9%。CRT前后的阿特朱单抗都良好耐受,AE主要报道为1级事件。特别感兴趣的AE包括出现在共10名患者中的甲亢、甲状腺功能减退症、皮疹、过敏反应、结肠炎和格林巴利综合征。如作者所述,有必要在无法切除的III期NSCLC的条件下进一步研究诱导免疫检查点抑制剂疗法。
SABR联合阿特朱单抗
立体定向消融放疗(SABR)用于无法手术的早期NSCLC,但局部和远距离失败仍然是问题[16]。数据表明放疗与免疫检查点抑制之间有协同作用,提示给予检查点阻断的新辅助疗法可能优于仅给予辅助疗法[17,18]。基于这些观察结果,Kelly等人进行了一项I期研究,以评估在高风险、早期NSCLC中新辅助、同步和辅助的阿特朱单抗联合SABR的安全性和最大耐受剂量[19]。患者患有无法手术的NSCLC(T1-3 N0 M0)且至少有一项预示高复发风险的特征,如某些肿瘤直径或组织学分化不良,他们在三个剂量水平下接受了六个周期的阿特朱单抗治疗,在第3周期中以每份10 Gy至12.5 Gy的剂量并行地递送了5份SABR。20名患者中有15名完成了全部6个周期。
阿特朱单抗1200 mg/kg被确定为推荐的II期剂量。在最初两个周期的阿特朱单抗后的重新分期已显示出抗肿瘤活性的迹象,未经证实的部分缓解率为22%。在20名患者的总队列中,中位PFS为25.5个月。在PD-L1阳性肿瘤患者中,PFS几乎是PD-L1阴性组的两倍(分别为30.0个月和16.3个月)。总体而言,在SABR之前、期间和之后施用阿特朱单抗被证明是可行的,且耐受性良好。与治疗相关的AE,如血细胞减少、疲劳、皮疹和腹泻,主要限于1级和2级事件。两例肺炎分别为1级和2级。更多的血液和组织生物标志物分析正在进行中,因为炎性肿瘤微环境可能与应答有关。此外,目前正在随机III期SWOG/NRG S1914试验中测试阿特朱单抗和SABR的组合。
围手术期的度伐鲁单抗
通过多中心、单组、II期SAKK 16/14试验研究了手术前的新辅助化疗,采用三个周期的顺铂和多西他赛,然后是两个周期的每两周750 mg /m²的度伐鲁单抗[20]。手术后,度伐鲁单抗治疗持续了一年。该研究包括67名可切除的IIIA期NSCLC(T1-3 N2 M0)患者。12个月无事件生存率(EFS)被定义为主要终点。
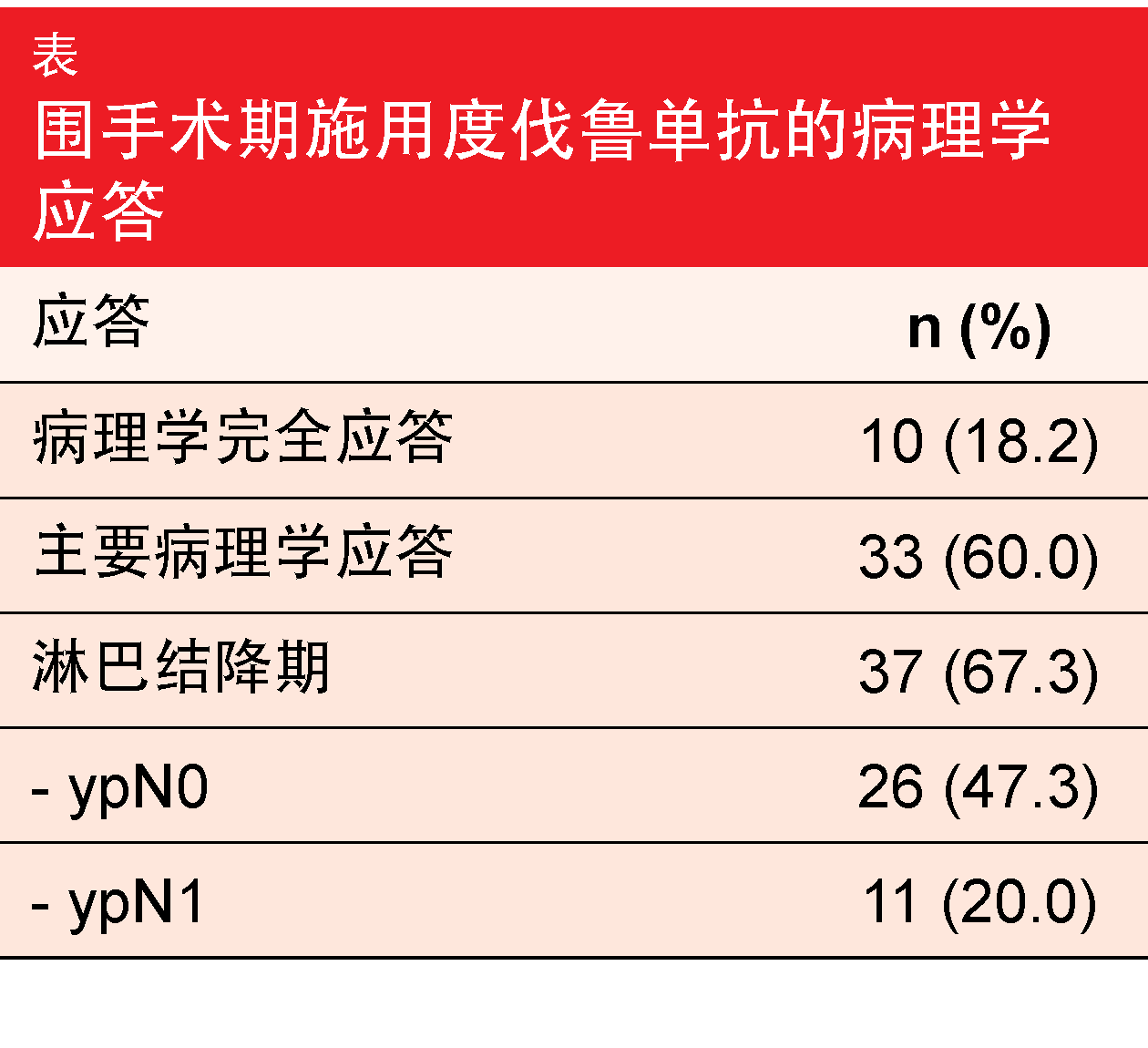
58名患者完成了新辅助免疫治疗,并且55名接受了手术。在91%的病例中,实现了R0切除。患者的病理完全应答率为18.2%,并且在67.3%的患者获得了淋巴结降期(表)。此外,分析还显示出较高的主要病理应答率。12个月的EFS为73.3%,分析时尚未达到中位EFS。同样,尚未达到中位OS。术后30天死亡率为1.8%。
作者认为,向标准护理顺铂/多西他赛增加围手术期度伐鲁单抗是安全的,并导致令人鼓舞的1年EFS率,这超过了单独化疗的历史数据。除了标准的新辅助化疗外的围手术期PD-L1抑制是SAKK 16/18研究的主要方向,该研究将评估新辅助免疫调节放疗的益处。
诱导化疗加放疗或贝伐珠单抗(bevacizumab)
随机II期PIT-1研究在88名IIIA期(N2)非鳞状NSCLC患者中评估了含铂双药化疗加并行胸部放疗(TRT)或贝伐珠单抗并随后手术的疗效[21]。在TRT和贝伐珠单抗组中,分别有37和38名患者接受了手术。R0切除的可能性分别为97%和89%。
关于构成主要终点的2年PFS率,分析表明TRT方案可带来50%的益处,优于贝伐珠单抗组的36.8%的益处。此外,在TRT组中,主要病理应答的发生频率更高(49%与14%)。两组的两年OS率均为80%。大多数与治疗有关的AE很均衡,尽管1-3级高血压在贝伐单抗治 疗中更常发生,而1/2级食管炎和皮炎仅限于基于TRT的方案。仅在贝伐珠单抗组中观察到由支气管胸膜瘘导致的致命手术并发症(2例)。基于这些发现,作者选择了培美曲塞/顺铂加并行TRT作为未来III期研究的探索性诱导方案。
参考文献
- Datta D, Lahiri B, Preoperative evaluation of patients undergoing lung resection surgery. Chest 2003; 123(6): 2096-2103
- Le Chevalier T, Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going? Ann Oncol 2010; 21 Suppl 7: vii196-vii198
- Cagle PT et al., Lung cancer biomarkers: Present status and future developments. Arch Pathol Lab Med 2013; 137(9): 1191-1198
- Kris MG et al., Adjuvant systemic therapy and adjuvant radiation therapy for stage I to IIIA completely resected non-small-cell lung cancers: American Society of Clinical Oncology/Cancer Care Ontario Clinical Practice Guideline update. J Clin Oncol 2017; 35(25): 2960-2974
- Pignon JP et al., Lung Adjuvant Cisplatin Evaluation: A pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008; 26(21): 3552-3559
- Soria JC et al., Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018; 378(2): 113-125
- Herbst RS et al., Osimertinib as adjuvant therapy in patients with stage IB-IIIA EGFR mutation positive NSCLC after complete tumor resection: ADAURA. J Clin Oncol 38: 2020 (suppl; abstr LBA5)
- Zhong WZ et al., Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage II-IIIA (N1-N2) EGFR-mutant NSCLC (ADJUVANT/CTONG1104): A randomised, open-label, phase 3 study. Lancet Oncol 2018; 19(1): 139-148
- Wu YL et al., CTONG1104: Adjuvant gefitinib versus chemotherapy for resected N1-N2 NSCLC with EGFR mutation – final overall survival analysis of the randomized phase 3 trial. J Clin Oncol 38: 2020 (suppl; abstr 9005)
- Goldstraw P et al., The IASLC Lung Cancer Staging Project: Proposals for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer. J Thorac Oncol 2016; 11(1): 39-51
- Forde PM et al., Neoadjuvant PD-1 blockade in resectable lung cancer. N Engl J Med 2018; 378(21): 1976-1986
- Kwiatkowski DJ et al., Neoadjuvant atezolizumab in resectable non-small cell lung cancer (NSCLC): Interim analysis and biomarker data from a multicenter study (LCMC3). J Clin Oncol 37, 2019 (suppl; abstr 8503)
- Cascone T et al., Neoadjuvant nivolumab or nivolumab plus ipilimumab for resectable non-small cell lung cancer (NSCLC): Clinical and correlative results from the NEOSTAR study. J Clin Oncol 37, 2019 (suppl; abstr 8504)
- Provencio M et al., NEO-adjuvant chemo-immunotherapy for the treatment of stage IIIA resectable non-small-cell lung cancer (NSCLC): A phase II multicenter exploratory study – final data of patients who underwent surgical assessment. J Clin Oncol 37, 2019 (suppl; abstr 8509)
- Ross HJ et al., AFT-16: Phase II trial of atezolizumab before and after definitive chemoradiation (CRT) for unresectable stage III non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9045)
- Timmerman R et al., Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA 2010; 303(11): 1070-1076
- Young KH et al., Optimizing timing of immunotherapy improves control of tumors by hypofractionated radiation therapy. PLoS One 2016; 11(6): e0157164
- Dovedi SJ et al., Acquired resistance to fractionated radiotherapy can be overcome by concurrent PD-L1 blockade. Cancer Res 2014; (74)19: 5458-5468
- Kelly K et al., Atezolizumab plus stereotactic ablative therapy for medically inoperable patients with early-stage non-small cell lung cancer. J Clin Oncol 38: 2020 (suppl; abstr 9011)
- Rothschild SI et al., SAKK 16/14: Anti-PD-L1 antibody durvalumab in addition to neoadjuvant chemotherapy in patients with stage IIIA(N2) non-small cell lung cancer (NSCLC) – a multicenter single-arm phase II trial. J Clin Oncol 38: 2020 (suppl; abstr 9016)
- Takamochi K et al., PIT-1: Randomized phase II trial of pemetrexed-cisplatin plus bevacizumab or concurrent thoracic radiation therapy followed by surgery in stage IIIA (N2) nonsquamous non-small cell lung cancer. J Clin Oncol 38: 2020 (suppl; abstr 9014)
© 2019 Springer-Verlag GmbH, Impressum