小细胞肺癌:进一步突破极限
高剂量辐射被证明是可行的
自1990年代初以来,并行的化疗和胸部放疗(TRT)一直是局限期小细胞肺癌(SCLC)的标准治疗方法,最常用的推荐方案是每日两次TRT,剂量为45 Gy。但是,放化疗后仅可以治愈不到三分之一的患者。在高达50%的患者中,会发生与较低的生存率有关的局部失败[1, 2]。Hallqvist等人表明,每天两次60 Gy高剂量的TRT是可行且安全的[3]。基于该策略是可耐受的并改善局部控制和生存率的假设,Grønberg等人进行的随机II期试验比较了60 Gy分40份和45 Gy分30份,每天两次(每周10次)[4]。在第0、3、6和9周,进行了四个疗程的顺铂或卡铂加依托泊苷(EP)的化疗。所有患者均在第二个化疗疗程的过程中开始TRT。在第四个化疗周期后对放化疗产生应答的任何患者都进行了预防性颅脑照射(PCI)。招募了没有接受任何先前的全身治疗或TRT的II/III期或不能手术的I期患者,分别在高剂量和标准剂量组中分析了84和76个人。两年生存率构成该研究的主要终点。
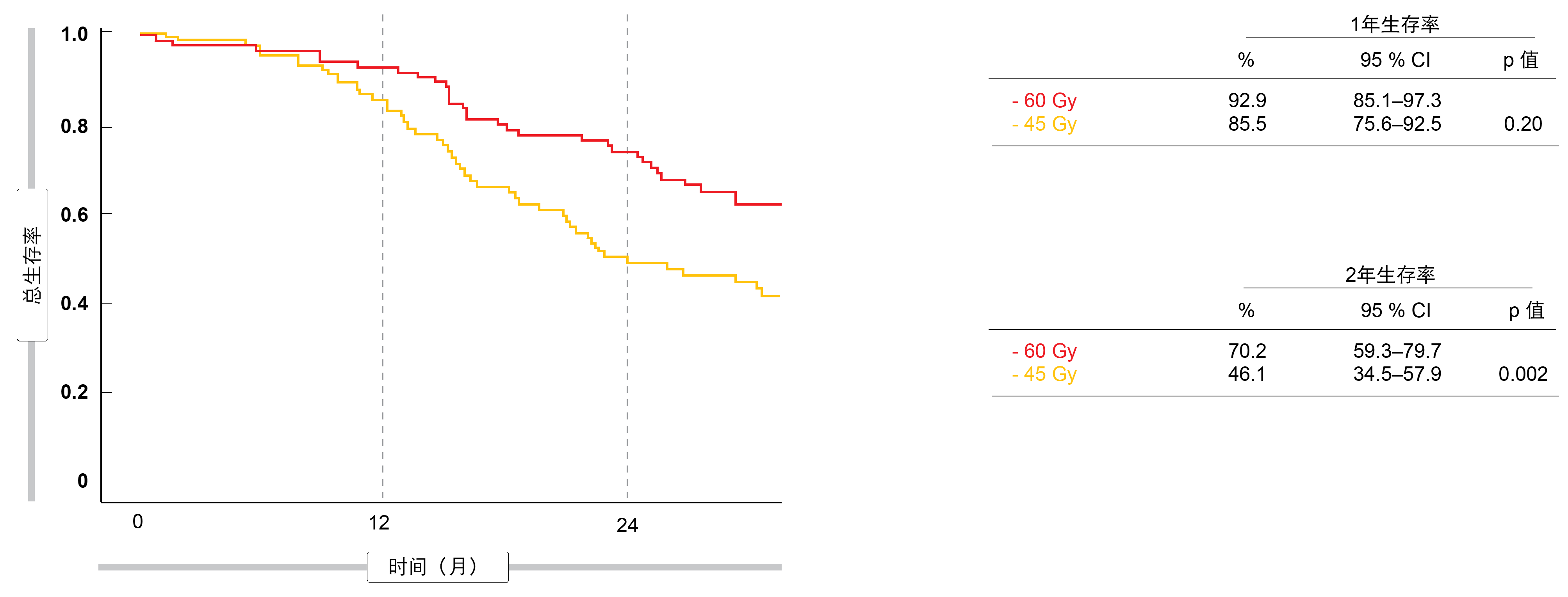
几乎在所有情况下,提供60 Gy都是可行的。在两组中,96%的患者完成了TRT,超过80%的患者接受了PCI。高剂量和标准剂量的TRT的客观应答率相似(分别为88.5%和84.9%)。完全应答也是如此(20.5%和23.2%)。关于主要终点,分析显示高剂量方案有显著和实质性改善:2年时OS率分别为70.2%和46.1%(p = 0.002;图1)。中位OS差异显著(41.6个月与22.9个月;HR,0.63;p = 0.027),而PFS没有差异(19.9个月与14.4个月;HR,0.80;p = 0.257)。
重要的是,较高剂量不会引起比标准剂量更大的放射毒性。整个治疗组中,血细胞减少、中性粒细胞减少性感染、食管炎和肺炎的3/4级AE发生率相似。
图1: 在局限期SCLC中60 Gy剂量与45 Gy剂量的胸部照射的1年和2年生存率
ES-SCLC:CASPIAN试验的新发现
对于广泛期SCLC(ES-SCLC),经过超过三十年的有限进展之后,为铂化疗增加免疫疗法已改善了一线条件下的OS[5, 6]。一项全球性、开放标签、随机化、多中心III期CASPIAN研究表明,与单独使用EP相比,用PD-L1抑制剂度伐鲁单抗加EP进行一线治疗可显著改善OS(HR,0.73;p = 0.0047)[5]。在对照组中,PCI是可选的。度伐鲁单抗加EP已于2020年3月被美国当局批准用于ES-SCLC,并且正在接受全球其他卫生当局的审查。
CASPIAN研究除度伐鲁单抗和EP之外,还包括评估CTLA-4抑制剂替西木单抗的另一个实验组,该抑制剂每3周用一次,持续4个周期,随后进行度伐鲁单抗维持治疗。在ASCO大会上,Paz-Ares等人提供了对该组与仅EP对照患者进行比较的主要分析[7]。据所述,向度伐鲁单抗和EP中增加替西木单抗并没有比单独使用EP显著改善OS(10.4个月与10.5个月;HR,0.82)。此外,研究人员报告了针对度伐鲁单抗加EP与EP的计划内最新分析结果。经过额外的11个月随访,与允许最多进行6个周期并使用EP和PCI的强效对照组相比,度伐鲁单抗联合化疗持续显示OS改善(12.9个月与10.5个月;HR,0.75;标称p = 0.0032)。OS曲线显示持续分离,在24个月时存活的患者为22.%与14.4%。在所有预先指定的亚组和主要的次要疗效结果(包括PFS(24个月PFS率,11.0%与2.9%)、客观应答率(67.9%与58.0%;OR,1.53)以及应答持续时间(24个月应答率,13.5%与3.9%))中都观察到了与度伐鲁单抗相关的益处。所有组的安全性结果均与所有药剂的已知安全性特征保持一致。这些结果进一步支持了度伐鲁单抗加EP作为一线ES-SCLC的新的标准治疗,提供了铂类选择(顺铂与卡铂)的灵活性。
KEYNOTE-604:派姆单抗加化疗
在KEYNOTE-028和KEYNOTE-158研究的基础上,派姆单抗已在多个国家或地区被批准用于转移性SCLC患者的三线或之后的治疗[8]。随机化、安慰剂对照的KEYNOTE-604试验在228名IV期 SCLC初治患者中评估了派姆单抗加EP,持续4个3周周期[9]。该方案后,维持派姆单抗长达31个周期。在对照组(n = 225)中,患者接受EP加安慰剂,然后进行安慰剂维持治疗。不允许有不稳定的脑转移。
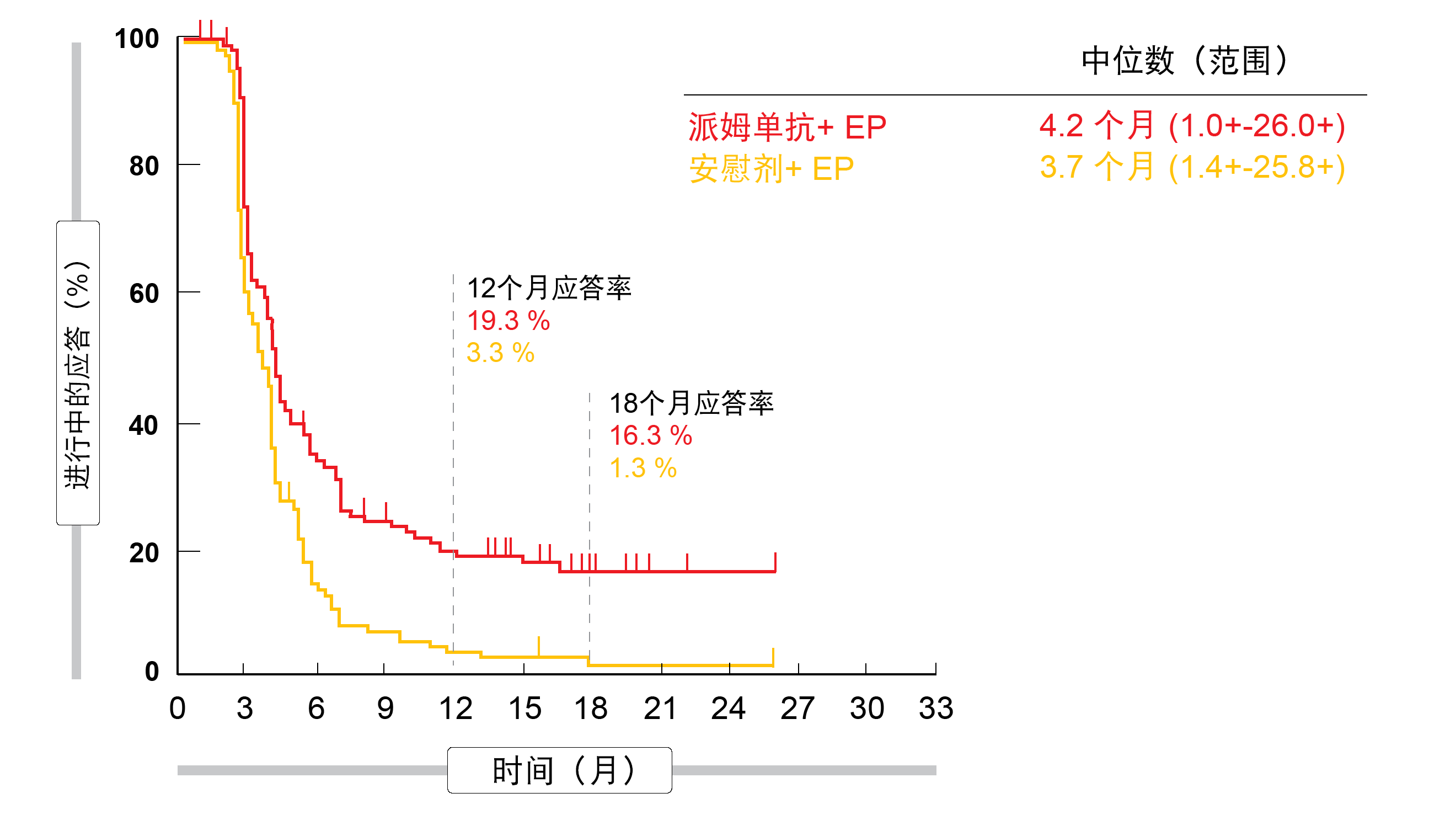
在第二次中期分析时,EP加派姆单抗作为一线治疗与单独使用EP相比显著改善了PFS,第二次中期分析提供了根据方案的最终PFS分析(4.5个月与4.3个月;HR,0.75;p = 0.0023)。根据试验的最终分析,18个月的PFS率为10.8%与2.1%(HR,0.73)。ITT群体的OS结果显示死亡风险降低了20%(10.8与9.7个月;HR,0.80;p = 0.0164),但超过了显著性阈值(p = 0.0128)。在24个月时,存活的患者为22.5%与11.2%。PFS和OS亚组分析均表明,除基线脑转移患者外,实验组中各亚组的结果均有改善。派姆单抗加EP和EP的ORR分别为70.6%与61.8%。完全应答率为1.8%与0.9%。在接受派姆单抗治疗的受试者子集中,应答似乎是持久的,18个月应答率分别为16.3%和1.3%(图2)。
该组合的AE符合预期且可控。在接受治疗的群体中,所有等级的免疫介导的AE的发生率分别为24.7%与10.3%,其中终止率5.8%与0.9%。据作者称,这些数据支持派姆单抗的益处以及免疫疗法在SCLC治疗中的价值。
图2: 在KEYNOTE-604试验中,派姆单抗+化疗与安慰剂+化疗的应答持续时间
在ECOG-ACRIN EA5161中评估纳武单抗
进行了ECOG-ACRIN EA5161试验以评估纳武单抗在ES-SCLC中的作用[10]。之前未接受过化疗的患者被随机分配至EP加纳武单抗并随后进行纳武单抗维持治疗(n=75),或仅接受化疗并随后进行观察(n = 70)。已接受脑转移治疗的患者包含在内。
对于被定义为主要终点的PFS,基于纳武单抗的方案显示出优势,中位PFS为5.5个月与4.7个月(HR,0.68;p = 0.047)。作为次要终点的OS也更有利于实验组,尽管并不明显(11.3个月与9.3个月;HR,0.73;p = 0.14)。客观应答率为52%与47%,中位应答持续时间为5.6个月与3.3个月。纳武单抗和化学疗法的组合的耐受性良好,毒性可控,治疗组之间发生3/4级AE的频率相似。研究人员在结论中指出,ECOGACRIN EA5161证实了纳武单抗在ES-SCLC中的疗效。
参考文献
- Turrisi AT et al., Twice-daily compared with once-daily thoracic radiotherapy in limited small-cell lung cancer treated concurrently with cisplatin and etoposide. N Engl J Med 1999; 340(4): 265-271
- Kubota K et al., Etoposide and cisplatin versus irinotecan and cisplatin in patients with limited-stage small-cell lung cancer treated with etoposide and cisplatin plus concurrent accelerated hyperfractionated thoracic radiotherapy (JCOG0202): a randomised phase 3 study. Lancet 2014; 15(1): 106-113
- Hallqvist A et al., Accelerated hyperfractionated radiotherapy and concomitant chemotherapy in small cell lung cancer limited-disease. Dose response, feasibility and outcome for patients treated in western Sweden, 1998-2004. Acta Oncol 2007; 46(7): 969-974
- Grønberg BH et al., Randomized phase II study comparing the efficacy of standard-dose with high-dose twice-daily thoracic radiotherapy in limited stage small-cell lung cancer. J Clin Oncol 38: 2020 (suppl; abstr 9007)
- Paz-Ares L et al., Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet 2019; 394: 1929-1939
- Horn L et al., First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379: 2220-2229
- Paz-Ares L et al., Durvalumab ± tremelimumab + platinum-etoposide in first-line extensive-stage SCLC: updated results from the phase 3 CASPIAN study. J Clin Oncol 38: 2020 (suppl; abstr 9002)
- Chung JC et al., Pembrolizumab after two or more lines of previous therapy in patients with recurrent or metastatic SCLC: results from the KEYNOTE-028 and KEYNOTE-158 studies. J Thorac Oncol 2020; 15: 618-627
- Rudin CM et al., KEYNOTE-604: pembrolizumab or placebo plus etoposide and platinum as first-line therapy for extensive-stage small-cell lung cancer. J Clin Oncol 38: 2020 (suppl; abstr 9001)
- Leal TA et al., Randomized phase II clinical trial of cisplatin/carboplatin and etoposide alone or in combination with nivolumab as frontline therapy for extensive stage small cell lung cancer: ECOG-ACRIN EA5161. J Clin Oncol 38: 2020 (suppl; abstr 9000)
© 2019 Springer-Verlag GmbH, Impressum