EGFR突变疾病:外显子20插入阳性肺癌的早期组合和新方法
寡转移条件下的先期辐射加TKI
寡转移性疾病通常由一至五个转移病灶定义。由于进展最经常发生在原发病部位,因此推测积极的局部治疗可能会阻止进一步的传播。基于这一理论,在中国进行的开放标签、随机、Ⅲ期SINDAS试验探索了体部立体定向放疗(SBRT)和EGFR TKI疗法在寡转移、EGFR突变的NSCLC患者中的并行使用[1]。患者在任何一个器官的转移病灶不超过两个,总共最多五个转移病灶。在实验组(n = 68)中,SBRT以25至40 Gy的剂量分5部分施用,而对照组(n = 65)的患者仅接受TKI治疗(即,吉非替尼(gefitinib)、厄洛替尼(erlotinib)、埃克替尼(icotinib))。
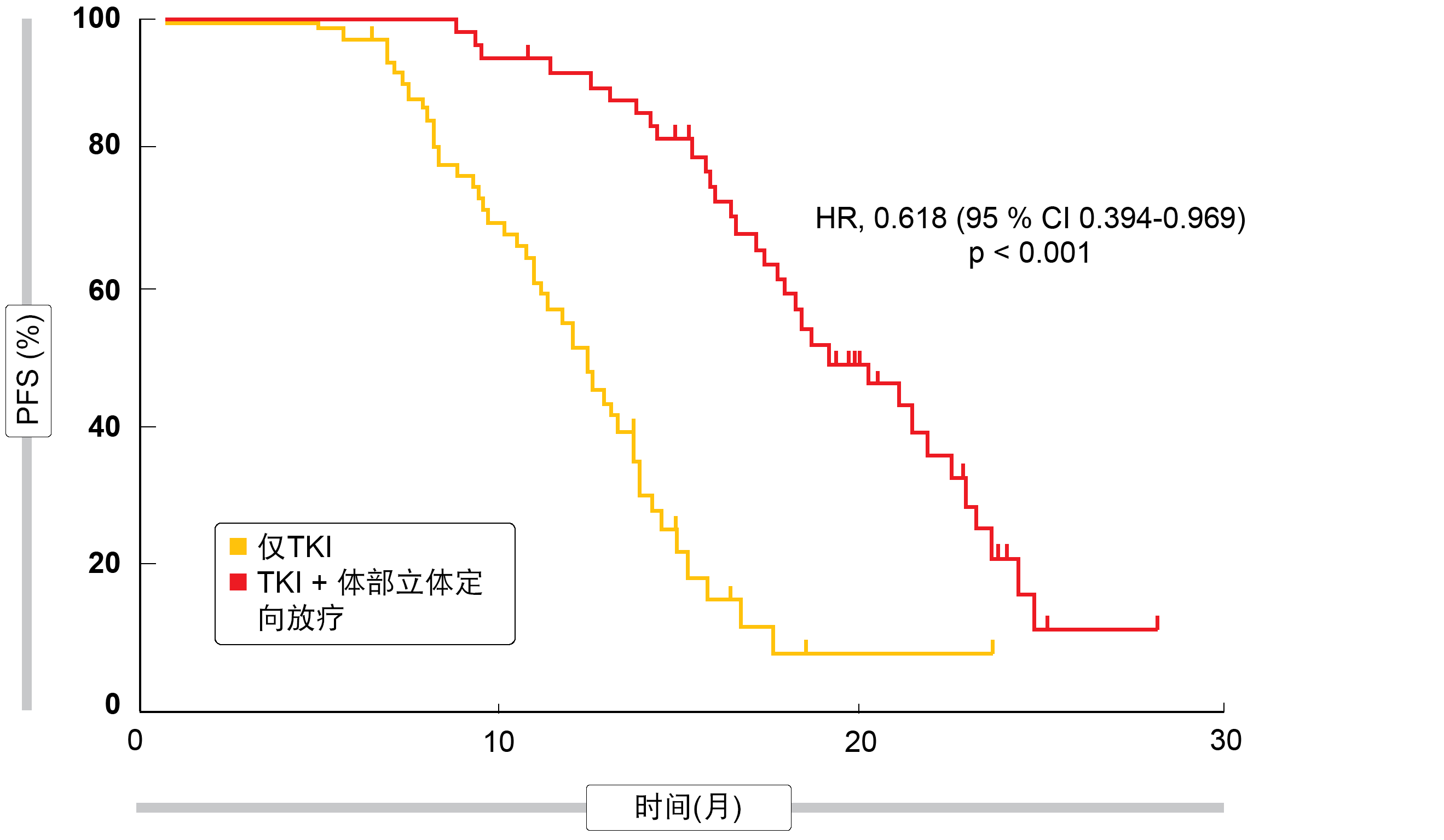
PFS被定义为主要终点。在此,联合治疗方案的益处显著,使进展或死亡风险降低38%(HR,0.618;p < 0.001;图1)。此外,增加放疗显著延长了OS(HR,0.682;p < 0.001)。同时,在治疗组之间,包括皮疹、严重肝损伤、肺炎、食管炎和病理性肋骨骨折在内的3级AE的发病率无显著差异。总体而言,这些发现证实了先前的假设,即巩固性SBRT对于有限转移性NSCLC有益。作者得出结论,积极的先期局部疗法应该在大型的III期试验中进一步研究才能作为这种临床场景下的一项标准选择。
图1: 放疗加EGFR TKI治疗与仅TKI治疗在寡转移、EGFR突变肺癌中的无进展生存率
一线双重TKI治疗:奥希替尼(osimertinib)加吉非替尼
众所周知,第一代EGFR TKI吉非替尼和第三代EGFR TKI奥希替尼产生不同的主要第二位点EGFR耐药性突变(即,分别对应吉非替尼和奥希替尼的T790M和C797S)。每种药物对另一种药物观察到的主要耐药机制保持活性。基于通过组合策略可能延长治疗应答的假设,目前,一项I/II期研究正在评估吉非替尼加奥希替尼的一线治疗方案,用于EGFR突变(即,EGFR L858R突变或外显子19缺失)的IV期NSCLC患者。
在ASCO大会上提供的分析中包括27名患者[2]。其中大多数为白种人(占81%),超过半数从未吸烟。允许有经治疗的或无症状的未治疗CNS疾病;分别有33%和26%的患者具有经治疗的和未治疗的脑损伤,且在41%的患者中无CNS转移。主要终点包括最大耐受剂量和治疗可行性,这被定义为接受至少六个28天周期的组合疗法。在剂量递增阶段,每天250 mg吉非替尼和80 mg奥希替尼没有出现剂量限制毒性,并且AE与EGFR TKI治疗的已知毒性特征一致。皮疹(96%)、腹泻(85%)和皮肤干燥(70%)是最常见的事件。患者没有患上肺炎。
在剂量扩大阶段,接受至少六个周期的患者中有81.5%达到了可行性终点。客观应答和疾病控制分别为88.9%和100%。中位PFS为22.5个月,但这些数据和OS数据仍不成熟。此外,该组合诱导了突变EGFR等位基因的快速和近乎通用的血浆清除,88%的患者在两周时表现出无法检测到的突变状态。就获得性耐药而言,疾病进展的下一代测序显示,在7名患者中未发现已知的致病性EGFR第二位点突变。而且,没有患者经历组织学转化。
研究者在其总结中指出,观察到的ORR为88.9%,与一线使用奥希替尼所获得的应答率相当。对PFS和OS的进一步分析将有助于理解一线双重EGFR TKI疗法的临床应用。
Mobocertinib对于伴有EGFR外显子20插入的NSCLC
在激活性EGFR突变中,外显子20插入标志着一种难以治疗且预后不良的NSCLC。这些肿瘤通常对EGFR TKI治疗不敏感,并且在铂化疗进展后,治疗选择受到限制。
新型EGFR TKI mobocertinib(TAK-788)目前正在开发中,用于伴有外显子20插入的肺癌,并且已经获得美国食品和药物管理局的突破性疗法认定,用于治疗在铂化疗之时或之后疾病进展的携带EGFR外显子20插入的转移性NSCLC患者。
在没有头对头证据的情况下,Horn等人间接比较了单组I/II期研究中获得的mobocertinib的临床试验数据与真实世界的结果[3]。从美国Flatiron Health HER衍生的去识别数据库中获得该真实世界数据,以便了解具有外显子20插入的患者的自然病史和治疗方式。在正在进行的I/II期试验中,mobocertinib的口服剂量为每日160 mg。分析中总共纳入了99名带有EGFR外显子20插入的局部晚期或转移性NSCLC患者(mobocertinib和真实世界患者分别为n = 28和n = 71);报告了二线条件的数据。真实世界群体中的治疗包括化疗、免疫治疗、EGFR TKI治疗及其组合;此外,还使用了化疗和/或EGFR TKI与单克隆抗体的组合。免疫治疗最普遍,为29.6%,其次是EGFR TKI治疗(25.4%)和多西他赛(10.0%)。
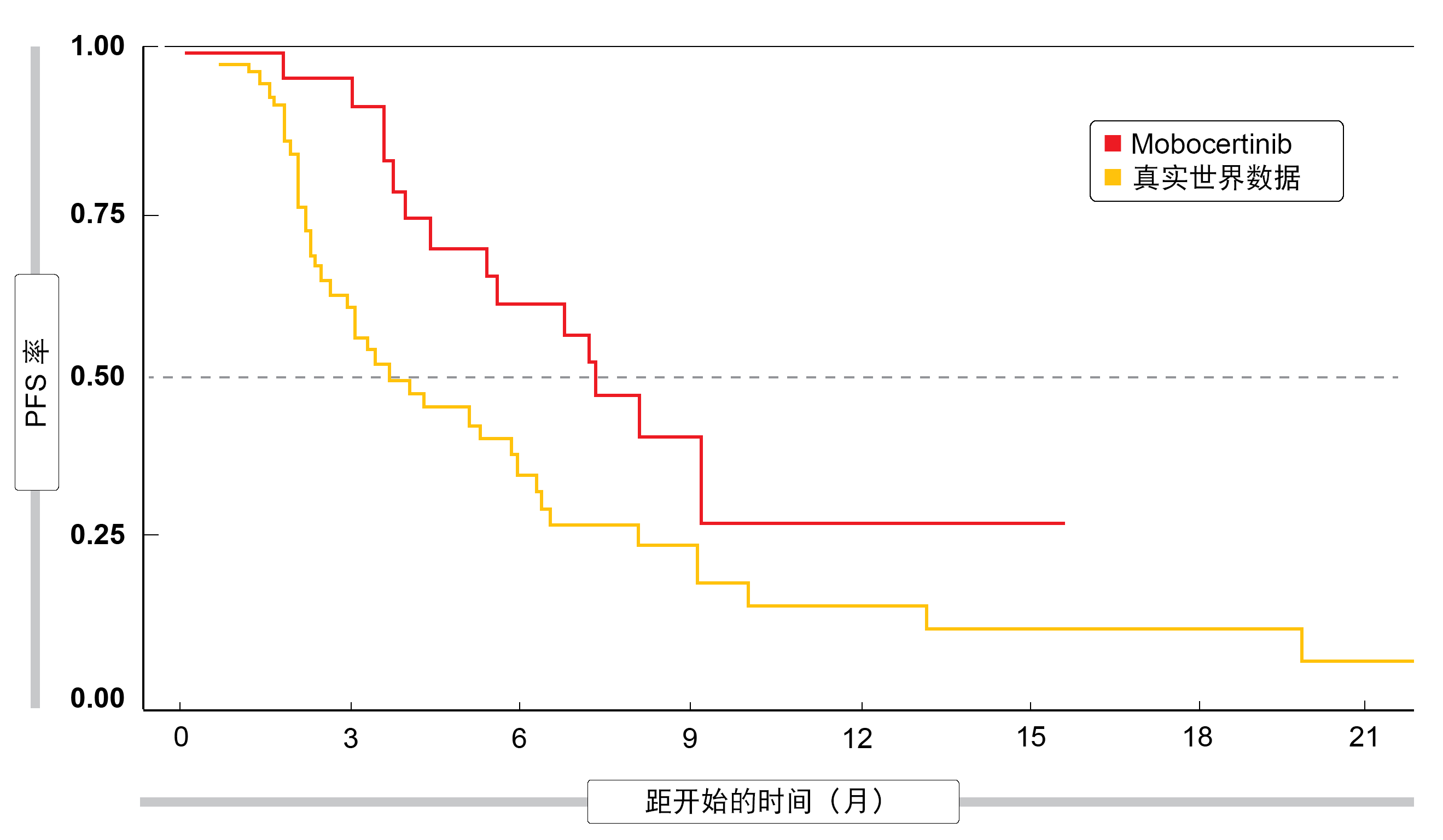
即使与基线倾向匹配,mobocertinib的表现也优于比较方案。mobocertinib组中患者的ORR(43%与14%;p = 0.003)和PFS(7.3个月与3.7个月;p = 0.0235;图2)更优。目前正在招募一项比较一线mobocertinib与铂化疗用于带有EGFR外显子20插入的NSCLC患者的试验(NCT04129502)。
图2: 与携带EGFR外显子20插入的NSCLC患者的真实世界发现相比,mobocertinib的无进展生存率的改善
波齐替尼(Poziotinib):ZENITH20研究的队列1
同样,口服的不可逆EGFR TKI波齐替尼已开发用于靶向EGFR和HER2外显子20插入。在ASCO大会上,Le等人提出了多中心II期ZENITH20试验的队列1的结果,该试验在共七个队列中对波齐替尼进行了评估,这些队列包括经先前治疗的和初治的NSCLC患者[4]。如果病灶稳定,则允许存在脑转移。
队列1包含88名带有EGFR外显子20插入的可评估患者,这些患者在预治疗后接受波齐替尼。在该组中,TKI的ORR为19.3%,DCR为80.7%。应答时间为7.4个月。根据先前疗法的应答评估显示,≥ 3线治疗后,患者获得的ORR(22.2%)略优于一线(18.9%)或两线(16.7%)。研究者的结论是,先前的多线治疗未损害应答。EGFR插入的位置对治疗效果有一定影响:外显子20近环插入是最常见的改变(> 50%),并且这些患者从波齐替尼中获益最多。
84%的可评估患者发生肿瘤缩小。保持无进展的中位时间为4.1个月。12名患者在基线时有稳定的CNS疾病。其中,83%的患者在治疗期间没有经历进展,并且仅3%的无基线脑损伤的患者出现新的CNS转移。常见的3级治疗相关AE事件包括腹泻(25%)、皮疹(28%)、口腔炎(9%)和甲沟炎(6%)。
EGFR-MET-双特异性抗体埃万妥单抗(amivantamab)
在EGFR突变NSCLC中广泛应用的一种新的治疗方法是EGFR-MET双特异性抗体埃万妥单抗,其同时靶向激活性和抗性EGFR突变和MET突变/扩增。该药物通过与这些受体的胞外域结合来抑制异常的EGFR和MET信号传导,而不是通过靶向激酶活性位点。
在正在进行的I期CHRYSALIS试验中,正在对患有转移性或不可切除的NSCLC并带有激活EGFR或MET突变或扩增的患者进行埃万妥单抗研究。Park等人报道了具有EGFR外显子20插入的患者的初步结果,这些患者静脉内接受推荐的II期剂量1,050 mg(体重≥ 80 kg的患者为1,400 mg),第一个周期每周一次,之后每两周一次[5]。安全性和应答可评估的群体分别有50名和39名患者。在应答可评估组中,29名(74%)在纳入研究前已在转移性条件下接受过铂化疗的治疗,6名为初治,并且4名接受了其他治疗,包括EGFR TKI和/或VEGF抑制。
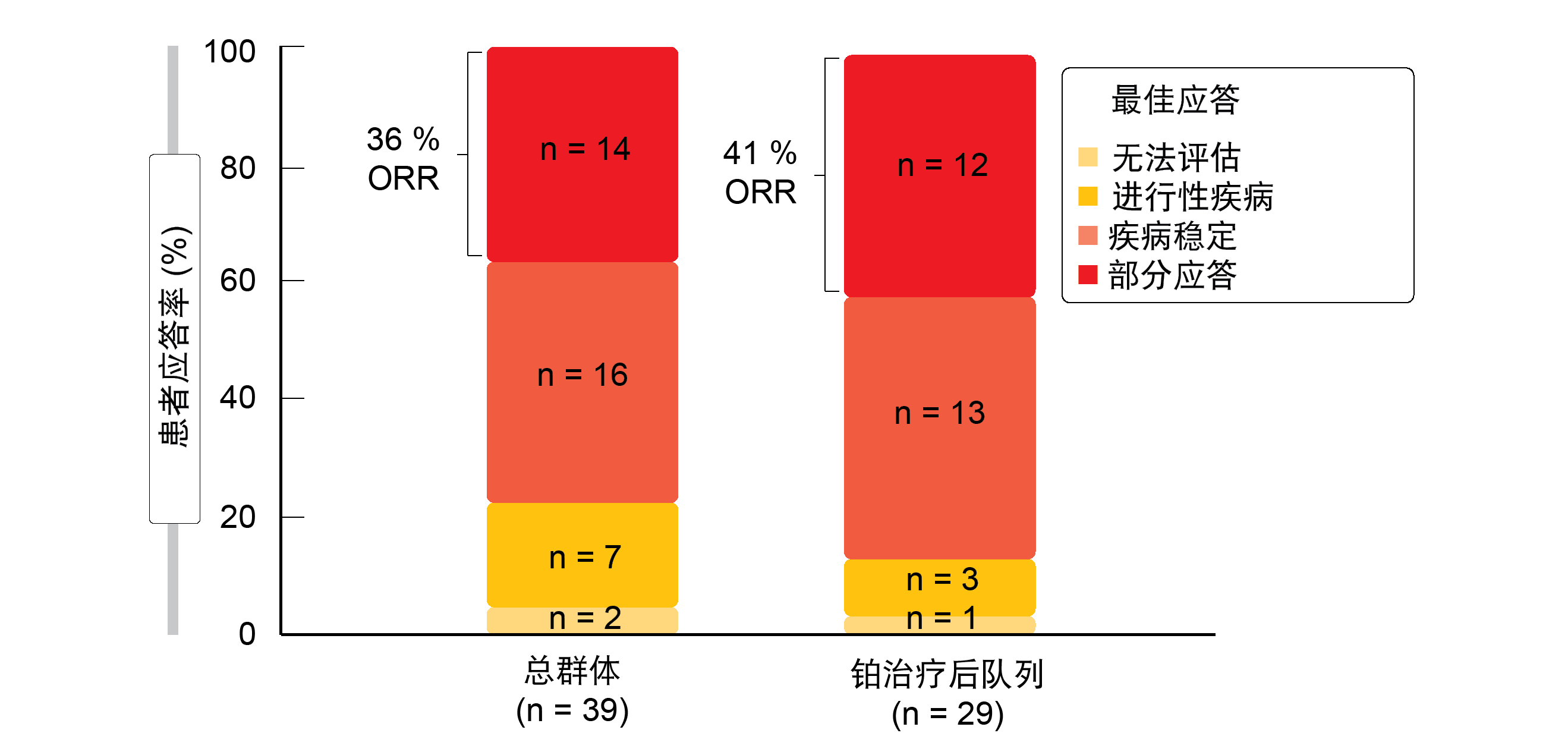
在初治和铂治疗后的患者中均观察到应答。在全组和铂治疗后队列中,ORR分别为36%和41%(图3)。在总群体中,67%的患者获得了临床益处;对于铂治疗后组,这一比例为72%。在识别的所有13种不同的EGFR外显子20插入改变中均观察到治疗活性。应答是持久的,所有可评估患者的中位持续时间为10个月,铂治疗后组为7个月。中位PFS分别为8.3和8.6个月。
埃万妥单抗已被证明具有可控的安全性特征,皮疹、输注相关反应和甲沟炎是最常见的全等级事件。毒性主要为1级和2级。由于AE引起的剂量减少和中断很少见,分别为10%和6%。
基于这些数据,埃万妥单抗已获得FDA突破性疗法认定,用于治疗在铂化疗之时或之后疾病进展的携带EGFR外显子20插入突变的NSCLC患者。
图3: CHRYSALIS试验:埃万妥单抗在总群体和铂治疗后队列中获得的应答
大剂量奥希替尼作为另一种选择
第三代EGFR TKI如奥希替尼在EGFR外显子20插入的NSCLC中的活性尚不清楚。临床前研究表明,这些药物的有利治疗窗口可允许在临床可达到的剂量下有抑制作用[6]。因此,单组II期EA5162试验在17名携带EGFR外显子20插入的晚期NSCLC患者中评估了奥希替尼160 mg,这些患者已经接受了至少一个先前的治疗线[7]。值得注意的是,该试验使用的剂量是批准的奥希替尼剂量的两倍。
每天160 mg的奥希替尼在带有外显子20插入突变的NSCLC中表现出临床活性,确认的ORR为24%。82%的患者实现了疾病控制。尚未达到中位应答持续时间,中位PFS为9.6个月。AE与以前的报告一致。腹泻、疲劳、血细胞减少和厌食症是最常见的毒性,≥ 3级事件的发生率较低。皮肤毒性仅限于1级AE。一名患者经历了4级呼吸衰竭,另一名患者由于3级贫血而终止了研究治疗。计划对带有EGFR外显子20插入的患者进行奥希替尼的进一步研究。
参考文献
- Wang XS et al., First-line tyrosine kinase inhibitor with or without aggressive upfront local radiation therapy in patients with EGFRm oligometastatic non-small-cell lung cancer: interim results of a randomized phase III, open-label clinical trial (SINDAS). J Clin Oncol 38: 2020 (suppl; abstr 9508)
- Rotow JK et al., Concurrent osimertinib plus gefitinib for first-line treatment of EGFR-mutated non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9507)
- Horn L et al., Indirect comparison of mobocertinib (TAK-788) vs real-world data outcomes in refractory NSCLC with EGFR exon 20 insertions. J Clin Oncol 38: 2020 (suppl; abstr 9580)
- Le X et al., Poziotinib shows activity and durability of responses in subgroups of previously treated EGFR exon 20 NSCLC patients. J Clin Oncol 38: 2020 (suppl; abstr 9514)
- Park K et al., Amivantamab (JNJ-61186372), an anti-EGFR-MET bispecific antibody, in patients with EGFR exon 20 insertion (Exon20ins)-mutated non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9512)
- Hirano T et al., In vitro modeling to determine mutation specificity of EGFR tyrosine kinase inhibitors against clinically relevant EGFR mutants in non-small-cell lung cancer. Oncotarget 2015; 6(36): 38789-803
- Piotrowska Z et al., ECOG-ACRIN EA5162: A phase II study of high-dose osimertinib in NSCLC with EGFR exon 20 insertions. J Clin Oncol 38: 2020 (suppl; abstr 9513)
© 2019 Springer-Verlag GmbH, Impressum