発がん性ドライバーによる肺がんに対するチェックポイント阻害の効果
さまざまな遺伝子変異の影響
後ろ向き解析では、作用可能な発がん性ドライバー変異を有する患者において、免疫チェックポイント阻害剤(CPI)の有効性は限定的であることが示されている[1, 2]。同様に、ランダム化比較試験であるIMpower150試験およびIMpower130試験では、EGFRおよびALKの異常を有する患者において、プラチナ製剤にCPIを追加しても生存率の向上は見られなかった[3, 4]。
Kellyらが報告した後ろ向き研究は、発がん性ドライバーによるNSCLCを対象に、化学療法とCPIを併用した場合と化学療法のみを併用した場合のPFSやその他のエンドポイントを明らかにするために行われた[5]。対象となる患者は、少なくとも1つのドライバー変異(EGFR、 ALK、ROS1、MET、RET、KRAS、 HER2、NTRK)を有していた。参加者は、2018年1月から2019年12月の間に、NCIが指定したカリフォルニア大学のがんセンターでチェックポイント阻害を伴う、または伴わないプラチナダブレットレジメンを受けた。
解析に含まれたのは全体で患者147人であった。EGFR変異が最も多く(49.7%)、次いでKRAS変異(36.7%)、ALK融合(6.8%)であった。2%の患者にMET変異が見られた。HER2変異、RET融合、ROS1融合はそれぞれ1.4%、BRAF変異は0.7%であった。PD-L1の発現が1~49%であったのは25.2%、50%以上であったのは19.7%であった。腫瘍の30%はPD-L1を発現しておらず、24.5%ではPD-L1の状態が不明であった。
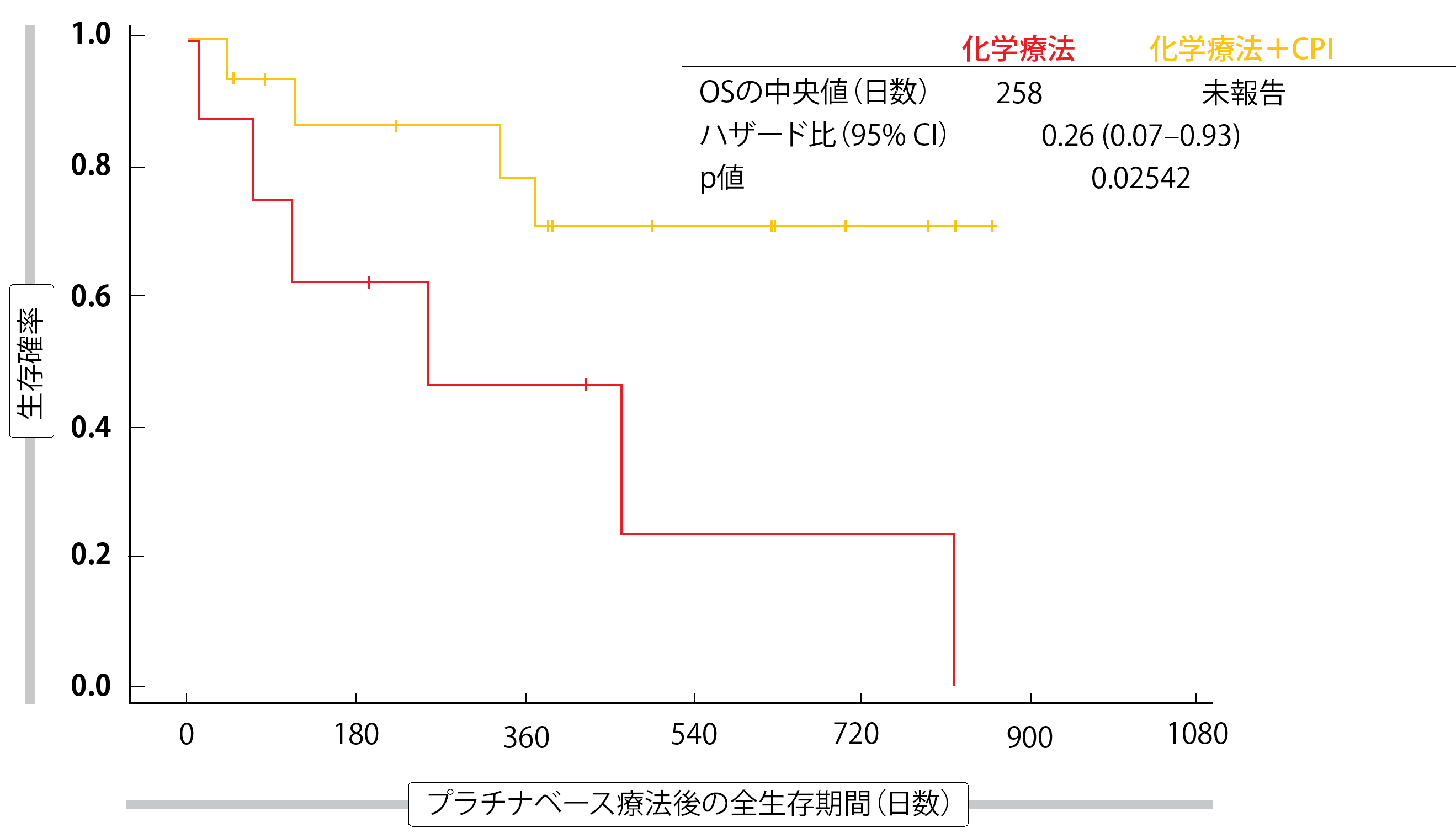
化学療法と免疫療法の併用は、化学療法のみの場合と比較して、KRASG12C変異腫瘍の少数のコホートを除き、いずれのグループにおいてもPFSおよびOSの有意な改善をもたらさなかった。この集団では、PFSの中央値は、化学療法+CPIで249日、化学療法単独で93日であった(ハザード比 0.31; p = 0.01415)。 OSの中央値は、免疫療法を受けた患者では未到達であったが、化学療法のみの患者では258日であった(ハザード比 0.26; p = 0.02542; 図)。今回の解析では、新たな安全性に関する懸念は認められなかった。
さらに、追加のコホートでPFSとOSを比較した。これらは、非喫煙者、現在/過去の喫煙者、ファーストライン治療を受けている患者、セカンドライン治療以降の治療を受けている患者で構成されている。これらのいずれにおいても、化学療法+免疫療法と化学療法単独の間に有意なPFSおよびOSの差は認められなかった。これは、全コホートにおいても同様で、71人と76人の患者が、それぞれ併用療法か化学療法単独治療を受けた。その結果、PFSとOSのリスク低下は、それぞれ7%(ハザード比 0.93; p = 0.69832)と26%(ハザード比 0.74; p = 0.18754)であった。
図:KRASG12C変異患者における化学療法+CPIと化学療法単独の場合の全生存期間の比較
抗PD-(L)1剤とKRASの状態
KRAS変異NSCLC患者を対象に、 KRAS を標的とした薬剤の第III相試験が進行中であるが、このサブグループにおける抗PD-(L)1療法の臨床効果については、依然として議論の余地がある。そこで、Landreらは、進行KRAS変異NSCLC患者を対象に、ファーストラインまたはセカンドラインの抗PD-(L)1抗体と化学療法の併用または非併用と、化学療法単独とを比較検討したランダム化試験のメタ分析を行った[6]。ペムブロリズマブ、アテゾリズマブ、ニボルマブを合計4,809人の患者で評価した6つの試験が解析対象となった。これらの試験に登録されたKRAS変異を有する疾患の患者の割合は、23%から38%であった。
抗PD-(L)1療法は、化学療法を併用するか否かにかかわらず、KRAS変異型およびKRAS野生型の患者において、化学療法単独よりもOSおよびPFSの延長を達成し、変異コホートではさらに大きな効果が得られたことが示された。この集団では、化学療法と比較して、実験的治療により死亡リスクが41%減少し(ハザード比 0.59; p < 0.00001)、進行と死亡のリスクが42%減少した(ハザード比 0.58; p = 0.0003)。ファーストラインとセカンドラインの両方の試験でOSの改善が認められた。KRAS野生型の集団では、免疫療法を受けた患者のOSが13%改善した(ハザード比 0.87)。2つの集団で比較すると、KRAS遺伝子変異のある患者のOSは、KRAS野生型の患者よりも有意に長いことが示された(p = 0.001)。
G12C変異と非G12C変異の比較
また、Memorial Sloan Kettering Cancer CenterとDana-Farber Cancer Instituteで治療を受けたKRAS変異を有する進行性/転移性肺がん患者のファーストライン化学免疫療法レジメンの有効性に関する解析結果もある[7]。このグループは、G12Cおよび非G12CのKRAS変異を有する69人と93人の患者で構成された。両コホートとも、PD-L1陽性の腫瘍は半数以下であった。PD-L1発現が1~49%であったG12C変異患者が31%および非G12C変異患者35%であったのに対し、PD-L1発現が50~100%であったG12C変異患者は12%、非G12C変異患者は11%であった。
G12C変異を有する患者は、非G12C変異を有する患者と比較して、 PFS(6.9カ月 対 6.0カ月; p = 0.04)およびOS(21.3カ月 対 14.3カ月;p = 0.07)の点で、化学免疫療法による恩恵を受けた。さらに、G12C変異群におけるSTK11とKEAP1の共存遺伝子変異の影響に対する評価も行われた。56%の患者はどちらの変異もなく、STK11変異を有する患者は15%、 KEAP1変異を有する患者は6%、両方の変異を有する患者は23%であった。STK11とKEAP1の野生型の患者は、STK11とKEAP1の両方またはどちらかに変異がある患者に比べて、化学免疫療法の効果がとても高いことが示された。この2つのグループのPFS中央値は、15.8か月と5.6か月であった(p = 0.03)。同様に、野生型の患者は、突然変異を持つ患者よりも、完全奏効または部分奏効を示す頻度が高かったが、この差は有意ではなかった(p = 0.11)。
また、G12C変異群では、共存遺伝子変異の有無に加えて、PD-L1の発現が化学免疫療法の効果に影響を及ぼしていた。客観的奏効は、PD-L1陽性の場合、PD-L1陰性の場合に比べて多く見られ、PFSの中央値はPD-L1陽性の場合で10.7か月、PD-L1陰性の場合で6.8か月と長かったが、いずれも有意差はなかった。結論として著者らは、共存遺伝子変異パターンとPD-L1の発現状況から、KRASG12C阻害剤などの代替的なファーストライン治療を最も必要とするKRAS変異肺がん患者を特定できる可能性があると示している。
CPIおよびSTK11共存遺伝子変異のリアルワールドデータ
これらの知見は、ASCO 2021で報告された、CPIを含むファーストライン治療を受けたKRASG12C変異肺腺がん患者の転帰に対するSTK11変異の共存の影響を評価したリアルワールドエビデンスによって得られた。Heistらは、米国で全国的に代表的な医療費請求臨床ゲノムデータセットであるGuardant INFORMに基づいて、リアルワールド後ろ向き観察研究を行った[8]。その結果、KRASG12C変異を有する患者が330人、保有しない患者が938人となった。KRASG12C変異コホートでは、STK11遺伝子に共起した変異が21%に認められた。KRASG12C変異のないコホートには、他のKRAS変異のある患者と、KRAS野生型の患者が含まれており、後者がグループの80%を占めた。STK11変異は、他のKRAS変異を有する患者の9%、KRAS野生型の患者の6%に認められた。
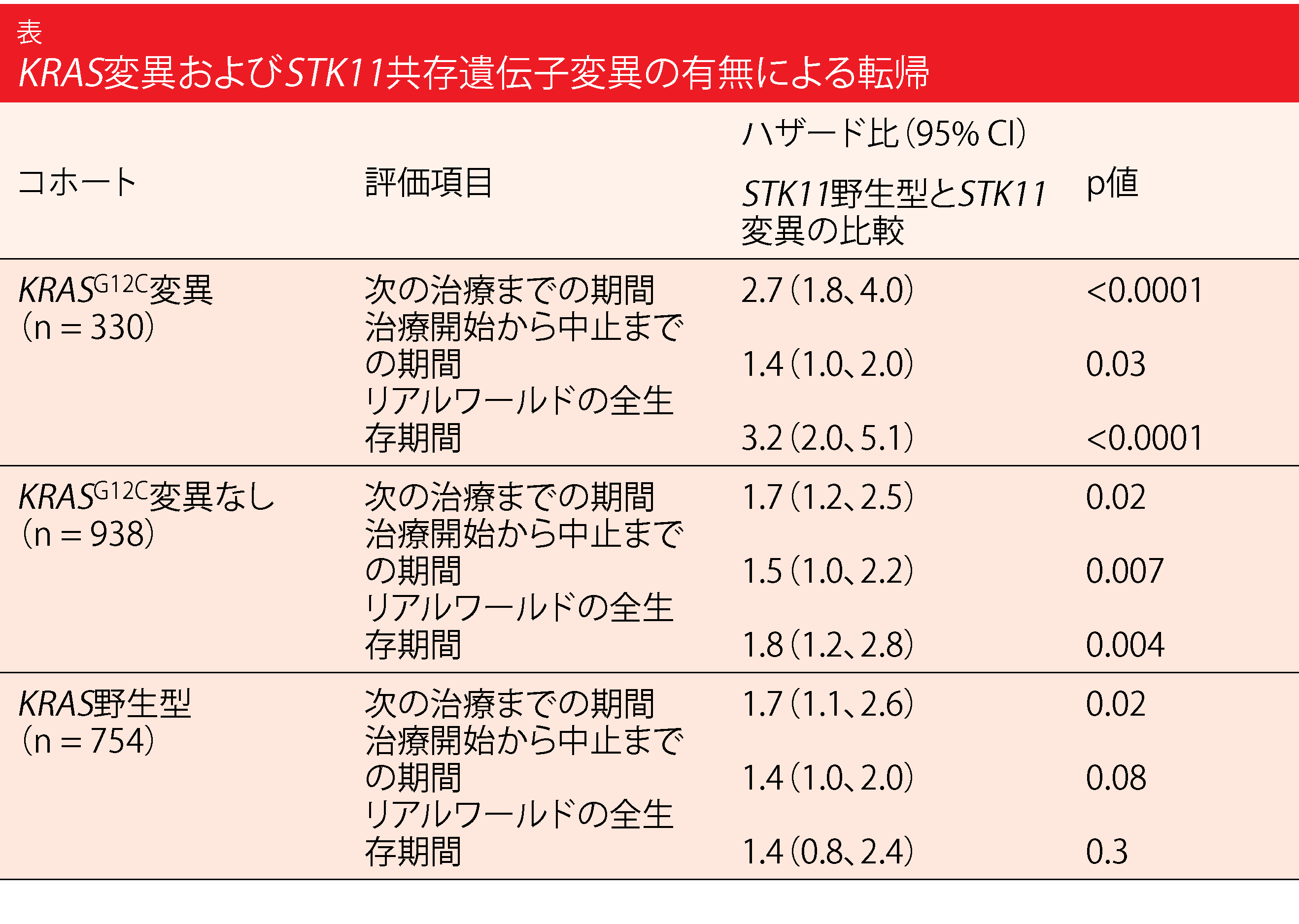
この解析結果によると、KRASG12CとSTK11の共存遺伝子変異は、ファーストラインの免疫療法を受けた患者の予後不良と関連している。次の治療までの期間(TTNT)は、STK11変異のないKRASG12C変異患者に比べ、共存遺伝子変異患者では4倍以上短かった(224日 対 975日; ハザード比 2.7; p < 0.0001; 表)。また、治療中止までの期間(TTD)が大幅に短縮され(172日 対 232日; ハザード比 1.4; p = 0.03)、リアルワールドOS(rwOS)は3.2倍に増加した(p <0.0001)。
非KRASG12CコホートとKRAS野生型コホートのマッチコホートでは、共存遺伝子変異のある患者とない患者の違いは小さかった(表)。STK11共存遺伝子変異を有する他のKRAS変異患者は、STK11変異のない患者に比べてTTNT、TTD、rwOSが有意に短かったが、TTNTとrwOSの調整後ハザード比はKRASG12Cコホートのハザード比よりも低かった。KRAS野生型マッチグループでは、TTDとrwOSの差は統計的に有意ではなかった。著者らは、これらの劣悪な結果は、KRASG12CとSTK11の変異を有するNSCLC患者において、効果的な標的療法や併用療法の必要性が高いことを示していると締めくくっている。
がん免疫療法とEGFR-TKIのシーケンシング
Jonesらは、Sarah Cannonネットワークで治療を受けたNSCLC患者で、発がん性ドライバー変異を有する患者の転帰に、CPIとドライバー標的TKIを用いたシーケンスが与える影響を調査した[9]。全体として、CPIを受けたドライバー陽性の患者は230人であり、そのうち176人がEGFR変異型に該当した。対照群には、CPI治療を受けていないドライバー陽性患者1,686人とEGFR変異患者1,352人に加えて、CPI治療を受けたドライバー陰性患者2,868人とチェックポイント阻害療法を受けていないドライバー変異のない患者4,308人が含まれた。
この解析では、発がん性ドライバーを有するNSCLC患者がTKIの後に免疫療法を受けた場合、逆の順序で受けた場合に比べて、より長くCPIの恩恵を受けられることが示された。EGFR変異腫瘍でEGFR-TKI治療を先に受けたグループでは、CPI失敗までの期間がEGFR TKI治療前にCPIを受けたグループに比べて有意に長かった(266日 対 210日; p < 0.005)。しかし、EGFR-TKIの失敗までの期間は、その順序に影響されなかった(p = 0.55)。これは、EGFR-TKIの前後にCPIを受けた患者の全生存期間の中央値にも該当した(p = 0.71)。同様の結果は、ドライバー陽性の複合コホートでも認められた。
さらに、EGFR陽性のNSCLC患者は、CPIを受けた場合、EGFR変異群のCPI治療を受けた患者は、CPI治療を受けていない患者に比べてTKI失敗までの期間が短かったものの、CPI治療の順序に関係なく、生存期間がわずかに改善した(2,156日 対 1,899日; p < 0.005)。一般的に、EGFR陰性のグループはEGFR陽性のグループよりもCPI失敗までの時間が長かった。ドライバー陽性の複合コホートの場合でも同様の結果が得られた。著者らが述べているように、ドライバー異常を有するNSCLC患者におけるCPI奏効の臨床的、治療的、ゲノムバイオマーカーをさらに特定するためには、継続的な研究が必要である。
参考文献
- Gainor JF et al., EGFR mutations and ALK rearrangements are associated with low response rates to PD-1 pathway blockade in non-small cell lung cancer: a retrospective analysis. Clin Cancer Res 2016; 22(18): 4585-4593
- Mazieres J et al., Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: results from the IMMUNOTARGET registry. Ann Oncol 2019; 30(8): 1321-1328
- Reck M et al., Atezolizumab plus bevacizumab and chemotherapy in non-small-cell lung cancer (IMpower150): key subgroup analyses of patients with EGFR mutations or baseline liver metastases in a randomised, open-label phase 3 trial. Lancet Respir Med 2019; 7(5): 387-401
- West H et al., Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2019; 20(7): 924-937
- Kelly K et al., Role of chemotherapy plus immune checkpoint inhibition in oncogenic driven lung cancer: a University of California Lung Cancer Consortium retrospective study. J Clin Oncol 39, 2021 (suppl 15; abstr 9059)
- Landre T et al., Anti-PD-(L)1 for KRAS-mutant advanced non-small-cell lung cancers: a meta-analysis of randomized, controlled trials. J Clin Oncol 39, 2021 (suppl 15; abstr 9025)
- Arbour KC et al., Chemo-immunotherapy outcomes of KRAS-G12C mutant lung cancer compared to other molecular subtypes of KRAS-mutant lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9088)
- Heist R et al., Impact of STK11 mutation on first-line immune checkpoint inhibitor outcomes in a real world KRAS G12C mutant lung adenocarcinoma cohort. J Clin Oncol 39, 2021 (suppl 15; abstr 9106)
- Jones C et al., Impact of immune checkpoint inhibitor and EGFR tyrosine kinase inhibitor sequence on time to treatment failure among EGFR+ NSCLC treated in a community-based cancer research network. J Clin Oncol 39, 2021 (suppl 15; abstr 9099)
© 2021 Springer-Verlag GmbH, Impressum