EGFR変異疾患:感受性変異と耐性変異に対する戦略
HER3を標的とする:パトリツマブ デルクステカン
EGFRチロシンキナーゼ阻害薬(TKI)は、EGFR変異NSCLC患者の第一選択薬として確立されているが、長期的には耐性が必然的に生じうる。EGFR-TKI耐性の背景には、さまざまなゲノム変化が確認されている[1,2] 。NSCLC腫瘍の83%に発現しているHER3[3]は、EGFR変異疾患におけるEGFR-TKI療法への耐性をもたらすことは知られていない。そのため、EGFR-TKI治療が奏功しなかった場合、HER3を標的とする抗体薬物複合体であるパトリツマブ デルクステカン(HER3-Dxd)が、次の選択肢として有効である可能性がある。
第I相U31402-A-U102試験では、EGFR-TKI耐性のNSCLC患者を対象に、HER3-Dxdを用いた用量漸増および用量拡大試験を実施した。ASCO 2021では、Jänneらが、この試験でHER3-Dxd 5.6mg/kgを投与した57人の患者のプールされた有効性の結果を報告した。合計81人の安全性に関する報告が行われた。このグループには、用量漸増および用量拡大コホート1(すなわち、腺がん組織型およびEGFR変異を有する前治療歴のある患者)の全患者が含まれている[4]。全患者集団が中央値で4種類の治療を受けた。プラチンベースの化学療法は、有効性と安全性集団のそれぞれについて、91%と80%に実施された。
耐性メカニズムを超えた有効性
重度の前治療を受けていたにもかかわらず、臨床的に意味のある持続的な抗腫瘍効果が得られた。HER3-Dxdでは、確定ORRが39%、病勢コントロール率(DCR)が72%であった。奏功期間の中央値は6.9か月で、PFSの中央値は8.2か月であった。オシメルチニブとプラチナベースの化学療法を併用した患者のサブグループでは、同様の有効性が示され、ORRは39%、DCRは68%、PFSの中央値は8.2か月であった。HER3-Dxdは、多様なEGFR耐性メカニズムに加えて、細胞膜のHスコアによるベースラインHER3発現のスペクトルにも有効であることが認められた。評価可能な全患者の腫瘍にHER3が発現しており、EGFR-TKIの最終投与からの時間的相関性は認められなかった。さらに、中枢神経系への転移の有無にかかわらず、この治療法は効果的であった。
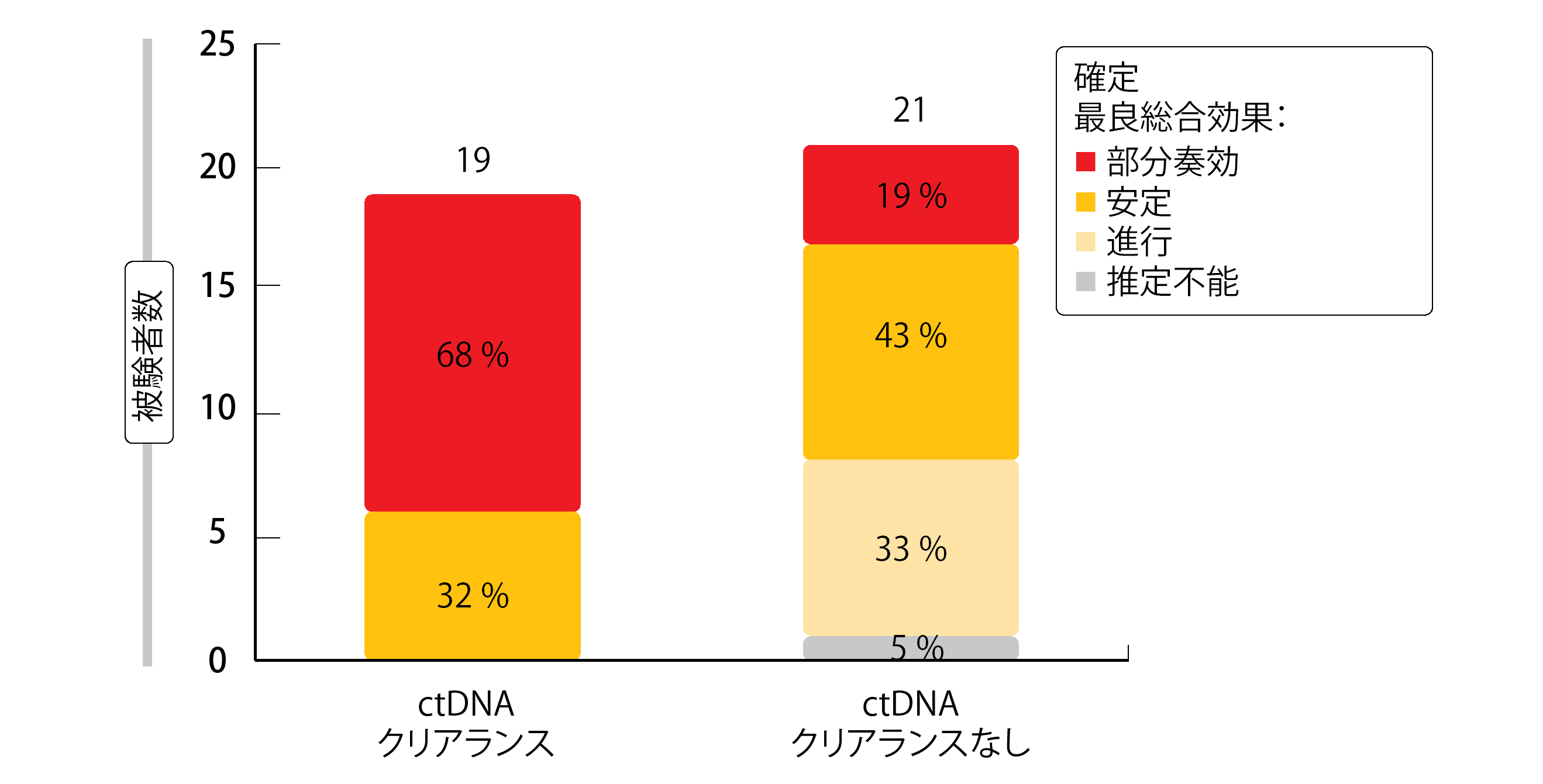
有効性が認められた57人の患者のうち40人は、ベースライン時の血漿中にEGFRエクソン19欠失またはL858R変異が検出された。これらの異常が3週目または6週目に早期に解消された場合、解消されなかった場合と比較して、最良奏効率が向上し(図1)、PFSの延長が見られた(8.3か月 対 4.4か月; ハザード比 0.33)。 HER3-Dxdは、管理可能な安全性プロファイルを示した。治験治療下で発現した有害事象(TEAE)による治療中止率は、5.6mg/kg投与群で11%、全用量群で9%と低かった。グレード3以上のTEAEでは、血小板数および好中球数の減少が最も多く発生した。治療に関連した間質性肺疾患の発生率は低く(全集団の5%)、グレード4/5のものは認められなかった。HER3-Dxdは、EGFR変異型NSCLCにおいて、さらに評価が進められている。
図1:パトリツマブ・デルクステカンによる治療において、ctDNAのエクソン19欠失およびL858R変異が早期に解消されたことにより、患者の奏効が改善された
オシメルチニブ投与後のアミバンタマブ+ラゼルチニブ投与
第3世代のTKIであるオシメルチニブによる治療で病勢が進行した患者では、耐性変異は、EGFR依存性(C797S変異など)またはMET依
存性(MET増幅など)のいずれかであることがほとんどである[5,6]。 PIK3CAやRAS/RAFなどの他の経路も関与している可能性があるが、
40~50%では耐性メカニズムが特定できない。複数のメカニズムが共存していることが多い。
オシメルチニブが奏功しなかった場合の治療法としては、EGFRとMETを標的とした二重特異的抗体であるアミバンタマブと、強力な第3世代EGFR-TKIであるラゼルチニブの併用が考えられる。両剤とも、さまざまなEGFR変異に対して臨床効果を示している[7-11]。これらの見解に基づき、オシメルチニブで進行したEGFRエクソン19欠失またはL858R変異 を有する化学療法未実施の患者45 人に、第I相CHRYSALIS試験の用量 拡大相においてアミバンタマブと ラゼルチニブを投与した。アミバンタムブは、体重80kg未満の場合 は1,050mg、80kg以上の場合は1,400mgの用量で、サイクル2から2週間ごとに静脈内投与され、加えてラゼルチニブ240mgの経口投与が毎日行われた。
ASCO 2021で発表された解析結果では、この併用療法による持続的な奏効が認められた[12]。中央値11.0カ月の追跡調査の結果、ORRは36%で、64%の患者に臨床的有用性が認められた(すなわち、完全奏効または部分奏効と11週間以上の安定)。奏効期間の中央値は9.6か月で、69%の患者が少なくとも6か月間奏効した。PFSの中央値は4.9か月であった。同時に、このレジメンの管理可能な安全性も明らかとなった。最も多かったのは、インフュージョンリアクション、発疹、寄生虫症で、大部分がグレード1または2と評価された。治療関連の投与量の減少と中止は、それぞれ18%と4%に発生した。
NGSとIHCによる患者選択
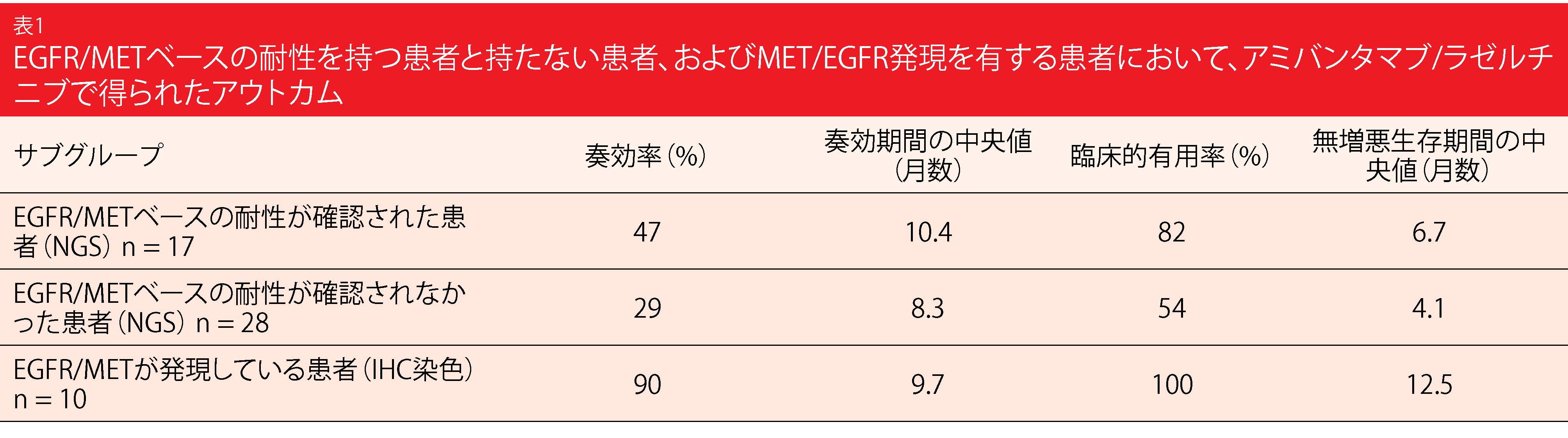
CHRYSALIS試験では、次世代シー ケンサー(NGS)と免疫組織化学(IHC)を用いたバイオマーカー解析が行われた。NGSによると、45人中17人がEGFRまたはMETベースの耐性を保有していた。残りの28人のうち、12人にはPIK3CAのE545K変異やCCND1増幅など、特定できる変化が認められた。EGFR/METベースの耐性を持つ患者は、そうでない患者に比べて、ORR、奏効期間、臨床的有用率、PFSについて良好な結果が得られた(表1)。しかし、NGSでは、確定効果が見られた患者の半数を特定できなかった。20例では、NGS後のIHC染色に腫瘍生検が十分であった。ここでは、10人の患者がEGFR/MET Hスコアの合計が400以上であり、このグループは優れた転帰を遂げた (表1)。IHCは、基礎となる遺伝子の耐性メカニズムにかかわらず、患者を特定できることが示された。そこで著者らは、IHCによるEGFR/METの発現は、潜在的な奏効者を特定するための代替アプローチとして使用できる可能性を示唆した。第I/Ib相のCHRYSALIS-2試験では、オシメルチニブによる前治療歴を有する新しいコホートにおいて、これらのバイオマーカーを前向きに検証する予定であるCT04077463)。
MET増幅:戦略の比較
MET増幅は、EGFR-TKI治療に対する獲得耐性の重要なメカニズムであるが、この異常に基づく進行性疾患の治療基準は存在しない。EGFR-TKIとMET-TKIの併用療法、MET-TKIの単剤療法、または化学療法の3つの戦略が一般的に行われている。リアルワールド試験では、EGFR変異NSCLCでMET増幅を獲得した70人の患者を対象に、これら3つのアプローチを比較した[13]。治療は、EGFR-TKIとクリゾチニブの併用療法(n = 38)、クリゾチニブ単独投与(n = 10)、化学療法(n = 22)のいずれかが行われた。
併用療法が、全コホートにおいて最も良好な結果が得られた。化学療法と比較して、ORR(p = 0.026)、 DCR(p = 0.016)、PFS(p = 0.036) において有意な優位性が認められた。OSは3つのグループで同等の結果となった。さらに、EGFR-TKIとクリゾチニブの併用療法は、3つのコホートで最も多い同時突然変異であるTP53 変異またはEGFR増幅を有する患者にも活性を示した。著者らが指摘したように、このようなサブセットの患者では、EGFRとMETの併用阻害が好ましい選択肢となるかもしれない。
アファチニブ-オシメルチニブの逐次投与に関する良好な所見
T790M変異は、第一世代および第二世代のEGFR-TKIが奏効しなかった後に、約50~70%の症例で優勢な耐性メカニズムとして現れる[14-17]。よく知られているように、T790Mはオシメルチニブを用いて効果的に標的とすることができる。アファチニブとオシメルチニブの逐次投与は、T790M耐性の患者でも化学療法を行わずに治療を長引かせることができることが示されている[18]。ASCO 2021で報告された韓国のリアルワールドデータでは、ファーストライン治療でアファチニブ治療を受けた患者の4つのグループ:T790Mの発現に基づいて後続のオシメルチニブが処方された患者(コホートA; n = 116)、T790Mが発現していなくても後続の他の治療を受けた患者(コホートB; n = 143)、他の治療を受けていてT790Mの発現状況が不明な患者(コホートC; n = 111)、アファチニブのみの治療を受けていてセカンドライン治療をまだ受けていない患者(コホートD; n = 367)において治療期間が評価された[19]。
治療期間(TOT)の中央値は治験被験者全体で23.42か月であった。コホートA~Cでは、ファーストライン治療でのTOTの中央値は、それぞれ17.43か月、14.19か月、7.13か月となり、アファチニブ-オシメルチニブの逐次投与が最も良好な結果となった。コホートDのTOTは42.61か月であり、 ファーストライン治療のアファチニブにより、 特定の患者が化学療法を必要としない長期的な病勢コントロールを維持できることを示唆している。セカンドライン治療では、コホートAがTOT11.04か月と再び最も良好な結果を示したが、コホートBとCではそれぞれ3.32か月と2.43か月であった。
同様に、コホートAではファーストライン治療とセカンドライン治療での奏効率が最も高かった。アファチニブ治療で進行した患者のうち、70.81%で再生検が行われた。ここでは、T790Mの検出率は44.27%であった。著者らの結論によると、T790M耐性変異を獲得した後にアファチニブからオシメルチニブを逐次投与することは、実行可能かつ効果的な戦略であることが示唆された。
エクソン20挿入の患者の転帰
EGFR変異の中でも、エクソン20挿入変異(Exon20ins)は3番目に多い変異で、最大で12%の症例で発生する[20, 21]。現在のところ、転移性の肺がん患者に対して承認された標的療法はない。EGFR-TKI、プラチナベースの化学療法、ドセタキセル、および免疫療法では、限られた活性が認められている[22-28]。
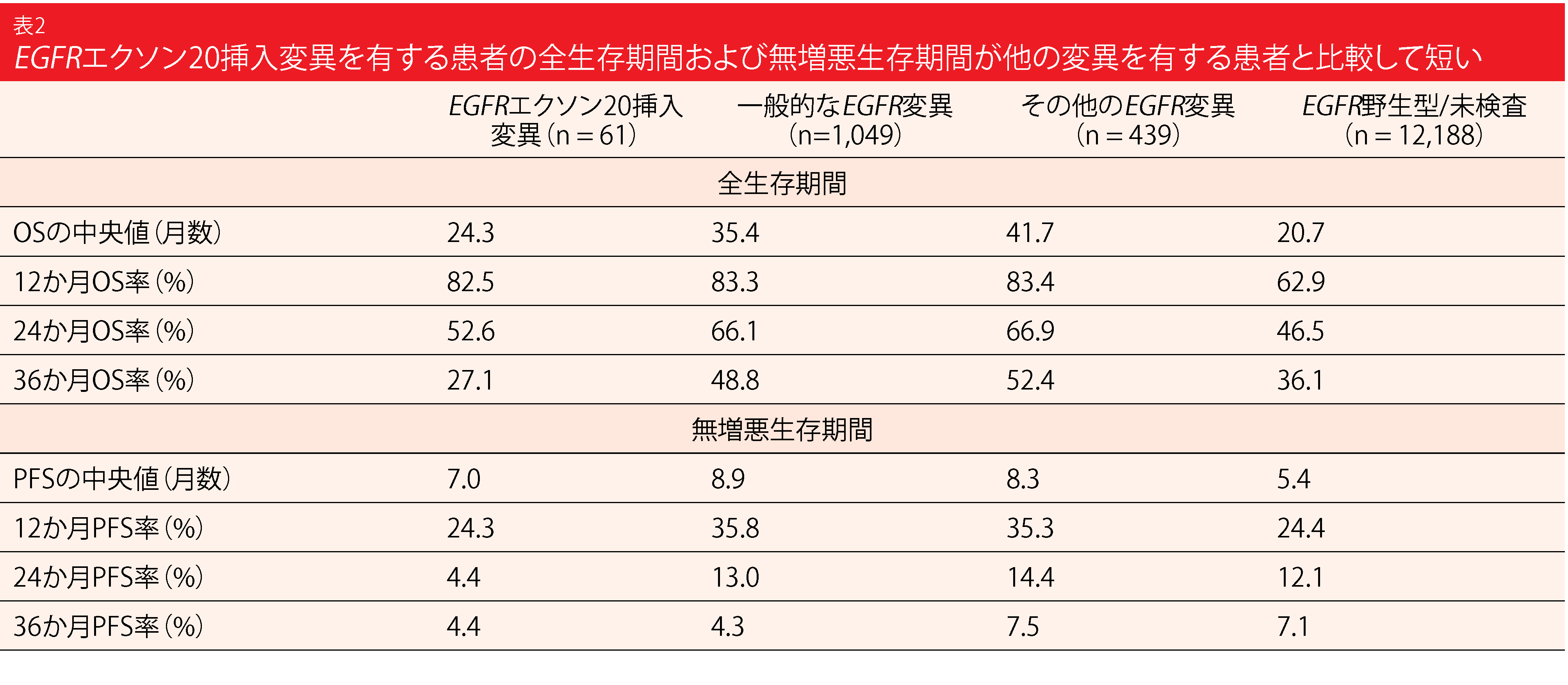
Chouaidらが行った後ろ向きリアルワールド試験では、EGFRエクソン20挿入変異を有する進行非扁平上皮NSCLC患者の治療パターンと臨床転帰が示されている[29]。データソースは、フランスのEpidemiological Strategy、Medical Economics Advanced and Metastatic Lung Cancer Data Platformである。合計13,737人の患者のうち、EGFR遺伝子変異の状態に基づいて4つのコホート:エクソン19欠失/L858R変異を伴わないエクソン20挿入変異(n = 61)、一般的なEGFR変異(すなわち、エクソン19欠失またはエクソン20挿入変異を伴わないL858R変異)(n = 1,049)、そ の他のEGFR変異(複数)(n = 439)、 野生型EGFR変異または未検査(n=12,188)が定義された。
エクソン20挿入変異を有するグループは全体の3.9%であり、NSCLC患者では稀な異常であることが確認された。このコホートでは、ファーストラインの化学療法が74.1%、EGFR-TKI治療が13.7%、免疫療法が8.6%に実施された。患者の転帰は、野生型のEGFR変異を持つ群や未検査の群と同様であり、一般的なEGFR変異群やその他のEGFR変異群の転帰よりも悪かった(表2)。一般的なEGFR変異を有する患者と比較して、OSの中央値は(24.3か月対35.4か月、p = 0.049)、 PFSの中央値は(7.0か月対8.9か月、p = 0.0167)と、有意に短かった。著者らは、これらの観察結果は、エクソン20挿入変異を持つ患者の治療法を進歩させる必要性を強調するものであると指摘している。
プラチナ製剤による前治療後のモボセルチニブ投与
画期的医薬品である経口の不可逆的EGFR-TKIであるモボセルチニブは、EGFRエクソン20挿入変異およびT790Mの有無にかかわらず、他のEGFR変異を阻害するために開発された。モボセルチニブは、第I/II相試験に含まれる計7つのコホートで臨床評価が行われている。ASCO 2021において、Ramalingamらは、プラチナ製剤で治療を受けた患者(PPPコホート。すなわち、プラチナ療法後にエクソン20挿入変異を有し、モボセルチニブ 160mg/日を用量漸増、用量拡大で受ける転移性NSCLC患者、またはEXCLAIMコホート)とEXCLAIMコホート(モボセルチニブ 160mg/日を投与された前治療歴のあるエクソン20挿入変異を有する患者)の主要有効性の最新の結果を報告した [30]。PPPコホートは114人、 EXCLAIMコホートは96人である。
モボセルチニブは、深い持続的な奏効を誘発した。独立評価委員会の評価では、PPPおよびEXCLAIMコホートのORRはそれぞれ28%と25%であった。両群ともほぼ80%が病勢コントロールを達成した(それぞれ78%、76%)。PPPコホートでは奏効期間の中央値は17.5か月、EXCLAIMコホートでは未到達であった。PPPコホートのPFSおよびOSの中央値は、それぞれ7.3か月と24.0か月であった。
奏効は、前治療歴の有無にかかわらず、また、エクソン20挿入変異のサブタイプにかかわらず、その頻度やCヘリックスからの位置に関係なく認められた。EGFR-TKIの既知の安全性プロファイルと同様に、モボセルチニブによって誘発された有害事象には、主に管理可能な胃腸および皮膚のイベントが含まれた。有害事象による投与量の減少は、PPPおよびEXCLAIMコホートで、それぞれ25%と22%に発生した。また、PPPコホートの17%、EXCLAIMコホートの10%で治療が中止された。
EXCLAIMコホートでは、EORTC QLQ-LC13およびEORTC QLQ-C30質問票を用いて、患者報告アウトカムを評価した。その結果、呼吸困難、咳、胸の痛みについて、ベースラインから臨床的に意味のある改善がサイクル2で明らかになり、治療期間中も維持された。同様に、治療中に胃腸関連の症状スコアが悪化したにもかかわらず、全体的な健康状態/生活の質の平均スコアは試験期間中、維持された。結論として、前治療歴のあるEGFRエクソン20挿入変異陽性の転移性NSCLC患者において、モボセルチニブは良好なリスクベネフィットプロファイルを有すると考えられ、アンメットニーズの高いこの集団に有意義な治療オプションを提供する可能性があることが示された。
エクソン20挿入変異陽性疾患におけるアミバンタマブの投与
CHRYSALIS試験では、EGFRエクソン20挿入変異を有する進行NSCLC患者において、アミバンタマブの単剤療法が持続的な奏効を示した[8,9]。
Minchomらは、プラチナベースの化学療法を受けたことのあるエクソン20挿入変異を有する肺がん患者を対象に、アミバンタマブと医師が選択した抗がん剤治療の有効性をリアルワールドで評価した[31]。この目的のために、CHRYSALIS試験に含まれるエクソン20挿入変異集団のプラチナ製剤投与後の患者81人の有効性を、米国で実際に使用されている3つのデータセットから得られた外部対照分析セット(n = 174)と比較した。対照群の患者は、CHRYSALIS試験の関連する適格基準を満たしていた。最も一般的な治療法は、非プラチナベース化学療法、免疫療法、プラチナ製剤を含むレジメン、EGFR-TKIであった。
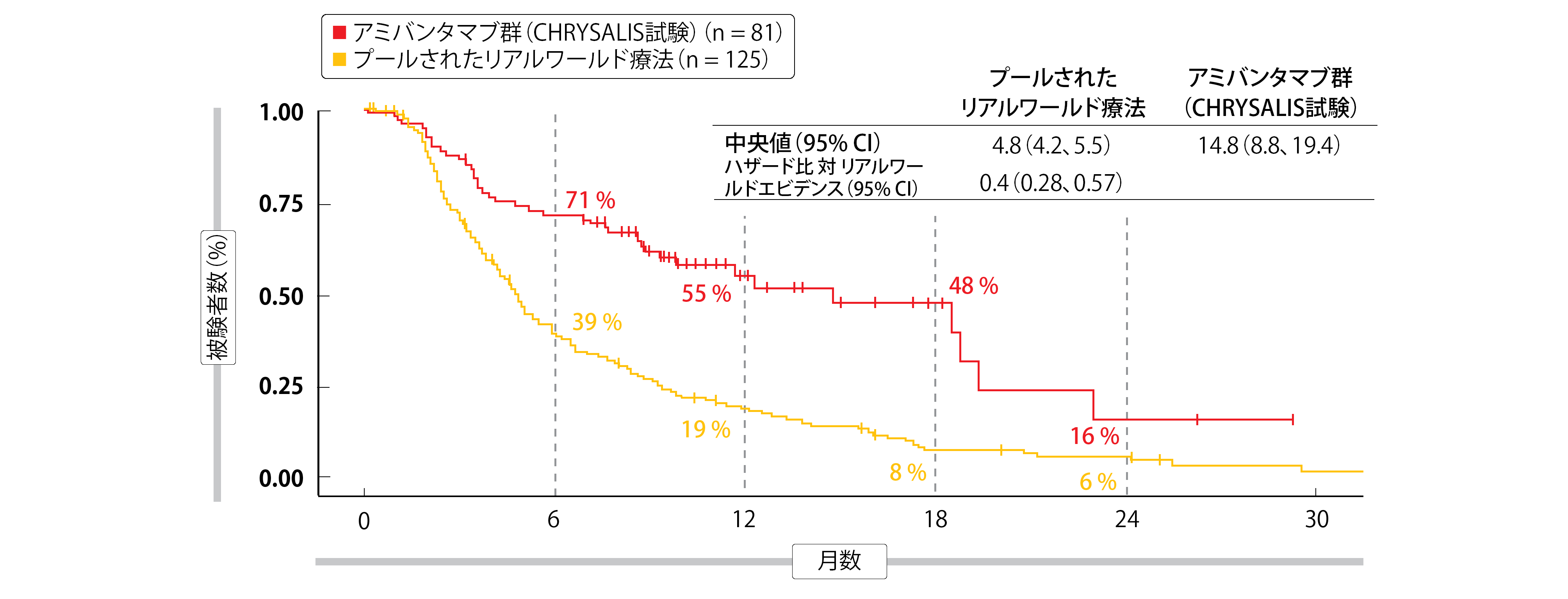
リアルワールドコホートと比較して、アミバンタマブを投与された患者は、進行リスクが53%減少し(PFSの中央値は8.3か月 対 2.9か月、ハザード比 0.47)、死亡率は51%減少した(OSの中央値は22.8か月 対 12.8か月; ハザード比 0.49)。次の治療までの期間は10か月延長された(14.8か月 対 4.8か月; ハザード比 0.40; 図2)。 著者らは、外部コントロールの成績が悪かったことは、現在入手可能なリアルワールドの治療法が効果的でないことを反映しており、EGFRエクソン20挿入変異を有する進行NSCLC患者に対して、よりターゲットを絞った治療法を特定することが緊急に必要であることを指摘している。
図2:EGFRエクソン20挿入変異患者におけるアミバンタマブ単剤投与の次回治療までの期間を、3つのデータベースから得られたリアルワールドアウトカムと比較した結果
リアルワールドにおける稀な遺伝子変異
一般的でないと分類されたEGFRの変異、すなわち、エクソン19欠失またはL858R変異ではないものは、EGFRの変異プールの7%~23%を占めると推定されている[32]。TKI療法に感受性が高い「主な」一般的でない変異にはG719X、S768I、L861Qがある。エクソン20挿入変異はEGFR-TKIに耐性があるとされているが、これは非常に異質なグループである。T790Mは、第一世代および第二世代のTKIに対する耐性をもたらすことが知られている。その他の稀な遺伝子変異については、TKI感受性に関するデータはほとんど得られていない。さらに、EGFR変異腫瘍の3分の1は複合変異を有している。高感度なシーケンシングベースの検出法やリキッドバイオプシーの利用が増えることで、実際の臨床現場では珍しい変異が検出される頻度が高まることが予想される[33]。
ヨーロッパとアジアの9か国で実施されたリアルワールドコホート研究UpSwinGでは、稀なEGFR変異が1つ以上あり、ファーストラインまたはセカンドラインでEGFR-TKI(アファチニブ、ゲフィチニブ、エルロチニブ、オシメルチニブ)の投与を受けた患者の治療と転帰が調査された[34]。解析に含まれたのは全体で患者246人であった。ほとんどがアジア人で、脳への転移があったのは10%以下であった。脳への転移がある場合は除外基準となった。
分析の結果、EGFR-TKIは一般的にファーストラインの治療法として選ばれていた(EGFR-TKIが91.9%に対し、化学療法が8.1%)。指標となる治療法としては、アファチニブが最も多く使用され(54.1%)、次いでゲフィチニブ(28.7%)、エルロチニブ(14.3%)、オシメルチニブ(2.9%) が使用された。TKI治療は、主要評価項目である治療成功期間(TTF)、OS、ORRにおいて良好な結果をもたらした。TTFはアファチニブと第一世代のTKIでそれぞれ11.3か月と8.8か月、OSはそれぞれ24.5か月と24.2か月であった。一般的なファーストライン治療では、43.9%が部分奏効、41.7%が安定を示した。セカンドライン治療の奏効率は、22.2%が部分奏効、49.1%が安定を示した。
患者の体力は時間の経過とともにほぼ維持され、ファーストライン治療開始時には半数の患者のECOGパフォーマンスステータスが1であったが、セカンドライン治療開始時にはこの割合はわずかに減少しただけであった(45.7%)。臨床的な結果は、突然変異のカテゴリーによって異なっていた。TTFとORRは、一般的に、主な稀である変異と複合変異を持つサブグループで最も良好であった。著者らは、稀なEGFR変異を有する腫瘍を持つほとんどの患者に対して、EGFR-TKIによる治療を検討すべきであると結論づけた。
オーモレルチニブのファーストラインでの有効性
オーモレルチニブは、感受性および耐性のEGFR変異を選択的に阻害する、新しい不可逆的な第3世代EGFR-TKIである。T790M変異の発現後、第一世代または第二世代のEGFR-TKIで進行したEGFR変異NSCLC患者において、強固な有効性を示したAPOLLO試験に基づき、2020年に中国で承認された[35]。ファーストラインでは、ランダム化二重盲検第III相試験(AENEAS)において、エクソン19欠失またはL858R変異を有する局所進行性または転移性NSCLC患者を対象に、オーモレルチニブ 110mg/日(n = 214)とゲフィチニブ 250mg/日(n = 215)の投与比較試験が行われた[36]。
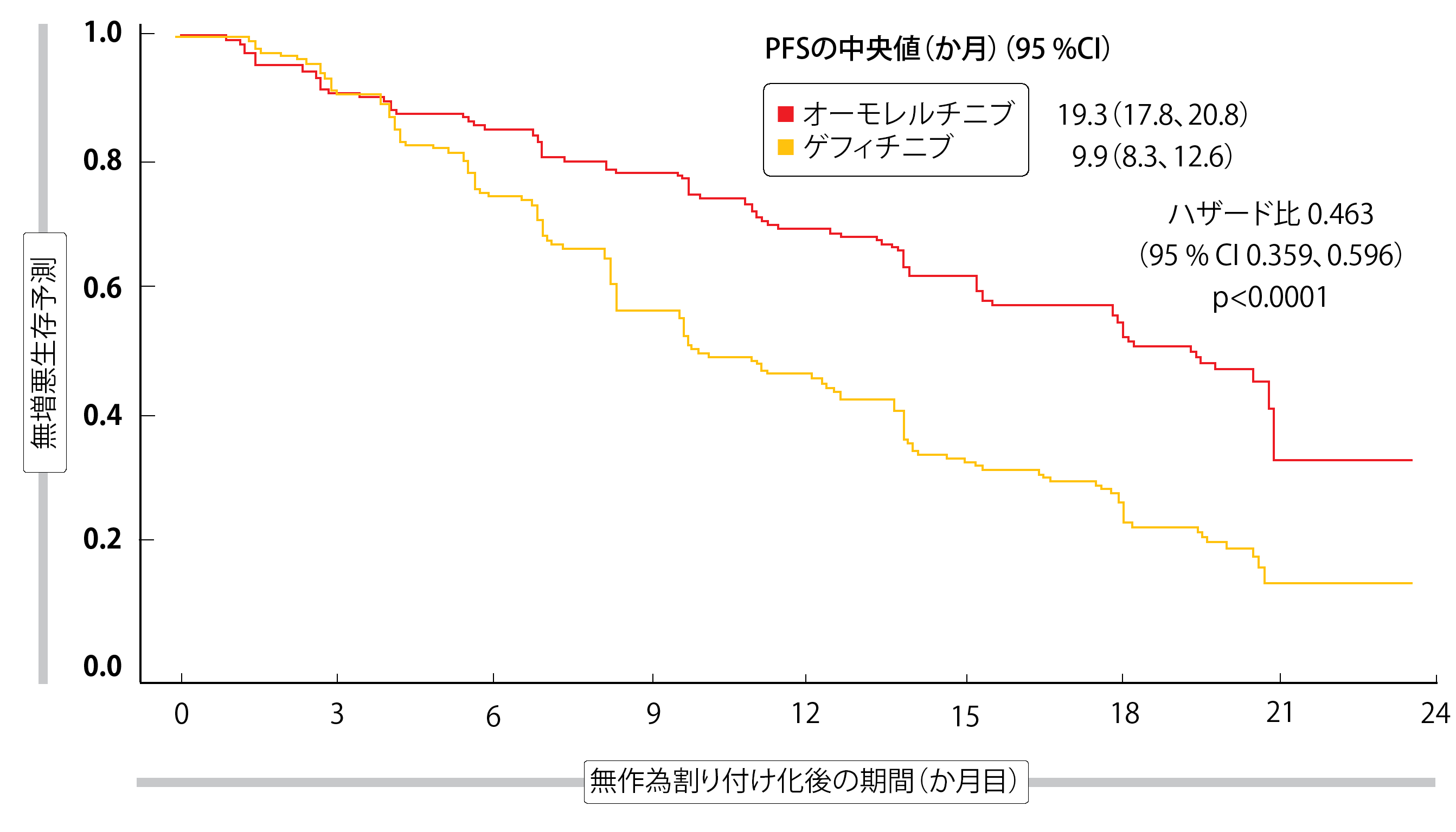
オーモレルチニブはゲフィチニブと比較して、PFSを有意に改善した(PFS中央値:19.3か月 対 9.9か月; ハザード比 0.463; p < 0.0001; 図3)。 12か月PFS率は69.5%対46.3%、24か月PFS率は32.5%対12.9%であった。PFSは、EGFR変異の種類、脳病変の有無、性別、年齢、喫煙歴、ECOGパフォーマンスステータスなどを考慮したサブグループでも維持された。この投与群では、OS中央値は未到達であった(ハザード比 0.82)。ORRについては前者が73.8%に対し、後者が72.1%と差が見られなかったが、奏効期間はオーモレルチニブ投与群で有意に延長した(18.1か月 対 8.3か月; ハザード比 0.38; p < 0.0001)。
オーモレルチニブは概ね良好な忍容性を示した。最も多かったのは、クレアチンフォスフォキナーゼの上昇、トランスアミナーゼの上昇、および血球減少であった。発疹は、オーモレルチニブ投与群の方がゲフィチニブ投与群よりも頻度が低く(23.4% 対 41.4%)、下痢も同様であった(16.4% 対 35.8%)。QTc延長は、オーモレルチニブ投与群では10.7%(グレード3以上が0.9%)、ゲフィチニブ投与群では8.8%(グレード3以上が1.9%)に認められた。間質性肺疾患はオーモレルチニブ投与群で0.9%、ゲフィチニブ投与群で0.5%に発生した(両群ともグレード3以上のイベントは認められなかった)。
今回の結果を受けて、著者らは、大幅にコストを削減したグローバルアクセスプライシングストラクチャーの実現に向けて、世界の規制当局との協議を進めていくと締めくくっている。また、オーモレルチニブと化学療法および選択的標的薬との併用に関するグローバル試験や、アジュバントでの評価が行われているか、計画されている。
図3:AENEAS試験:無増悪生存期間に関するオーモレルチニブのゲフィチニブに対するファーストライン治療の優位性について
参考文献:
- Engelman A et al., MET amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling. Science 2007; 316(5827): 1039-1043
- Schoenfeld AJ, Yu HA. The evolving landscape of resistance to osimertinib. J Thorac Oncol 2020; 15(1): 18-21
- Scharpenseel H et al., EGFR and HER3 expression in circulating tumor cells and tumor tissue from non-small cell lung cancer patients. Sci Rep 2019; 9(1): 7406
- Jänne P et al., Efficacy and safety of patritumab deruxtecan in EGFR inhibitor-resistant, EGFR-mutated non-small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9007)
- Papadimitrakopoulou VA et al., Analysis of resistance mechanisms to osimertinib in patients with EGFR T790M advanced NSCLC from the AURA3 study. ESMO 2018, abstract 5121
- Ramalingam SS et al., Mechanisms of acquired resistance to first-line osimertinib: preliminary data from the phase III FLAURA study. ESMO 2018, abstract LBA50
- Haura EB et al., JNJ-61186372 (JNJ-372), an EGFR-cMet bispecific antibody, in EGFR-driven advanced non-small cell lung cancer (NSCLC). J Clin Oncol 37, 2019 (suppl; abstr 9009)
- Park K et al., Amivantamab (JNJ-61186372), an anti-EGFR-MET bispecific antibody, in patients with EGFR exon 20 insertion (exon20ins)-mutated non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9512)
- Sabari JK et al., Amivantamab in post-platinum EGFR exon 20 insertion mutation non-small cell lung cancer. J Thorac Oncol 2021; 16(3): S108-S109
- Ahn MJ et al., Lazertinib in patients with EGFR mutation-positive advanced non-small-cell lung cancer: results from the dose escalation and dose expansion parts of a first-in-human, open-label, multicentre, phase 1-2 study. 2019; 20(12): 1681-1690
- Kim SW et al., Intracranial anti-tumor activity of lazertinib in patients with advanced NSCLC who progressed after prior EGFR TKI therapy: Data from a phase I/II study. J Clin Oncol 38: 2020 (suppl; abstr 9571)
- Bauml JM et al., Amivantamab in combination with lazertinib for the treatment of osimertinib-relapsed, chemotherapy-naïve EGFR mutant non-small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9006)
- Liu L et al., A large real-world study on the effectiveness of the combined inhibition of EGFR and MET in EGFR-mutant advanced non-small-cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9043)
- Arcila ME et al., Rebiopsy of lung cancer patients with acquired resistance to EGFR inhibitors and enhanced detection of the T790M mutation using a locked nucleic acid-based assay. Clin Cancer Res 2011; 17(5): 1169-1180
- Sequist LV et al., Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors. Sci Transl Med 2011; 3(75), 75ra26
- Yang JC et al., Osimertinib in pretreated T790M-positive advanced non-small-cell lung cancer: AURA study phase II extension component. J Clin Oncol 2017; 35(12): 1288-1296
- Hochmair MJ et al., Prevalence of EGFR T790M mutation in NSCLC patients after afatinib failure, and subsequent response to osimertinib. J Thorac Oncol 2017; 12(11): Supplement 2, S2137
- Hochmair MJ et al., Sequential treatment with afatinib and osimertinib in patients with EGFR mutation-positive non-small-cell lung cancer: an observational study. Future Oncol 2018; 14(27): 2861-2874
- Jung HA et al., TOAST: totality outcome of afatinib sequential treatment in patients with EGFR mutation-positive NSCLC in South Korea: KCSG LU-19-22. J Clin Oncol 39, 2021 (suppl 15; abstr 9053)
- Riess JW et al., Diverse EGFR exon 20 insertions and co-occurring molecular alterations identified by comprehensive genomic profiling of NSCLC. J Thorac Oncol 2018; 13(10): 1560-1568
- Fang W et al., EGFR exon 20 insertion mutations and response to osimertinib in non-small-cell lung cancer. BMC Cancer 2019; 19(1): 595
- Byeon S et al., Clinical outcomes of EGFR exon 20 insertion mutations in advanced non-small cell lung cancer in Korea. Cancer Res Treat 2019; 51(2): 623-631
- Wang Y et al., Real-world treatment outcome of advanced Chinese NSCLC EGFR exon 20 insertion patients. J Clin Oncol 37, 2019 (suppl; abstr 9043)
- Udagawa H et al., Clinical outcome of non-small cell lung cancer with EGFR/HER2 exon 20 insertions identified in the LC-SCRUM-Japan. J Thorac Oncol 2019; 14(10 suppl): S224
- O’Kane GM et al., Uncommon EGFR mutations in advanced non-small cell lung cancer. Lung Cancer 2017; 109: 137-144
- Negrao MV et al., Association of EGFR and HER-2 exon 20 mutations with distinct patterns of response to immune checkpoint blockade in non-small cell lung cancer. J Clin Oncol 36, 2018 (suppl; abstr 9052)
- Yang G et al., EGFR exon 20 insertion mutations in Chinese advanced non-small cell lung cancer patients: molecular heterogeneity and treatment outcome from nationwide real-world study. Lung Cancer 2020; 145: 186-19428 Garon EB et al., Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cancer after disease progression on platinum-based therapy (REVEL): a multicentre, double-blind, randomised phase 3 trial. Lancet 2014; 384(9944): 665-673
- Garon EB et al., Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cancer after disease progression on platinum-based therapy (REVEL): a multicentre, double-blind, randomised phase 3 trial. Lancet 2014; 384(9944): 665-673
- Chouaid C et al., EGFR exon 20 insertion – prognostic and predictive values in advanced non-small cell lung cancer, a real world study. J Clin Oncol 39, 2021 (suppl 15; abstr 9062)
- Ramalingam SS et al., Mobocertinib (TAK-788) in EGFR exon 20 insertion+ metastatic NSCLC: additional results from platinum-pretreated patients and EXCLAIM cohort of phase 1/2 study. J Clin Oncol 39, 2021 (suppl 15; abstr 9014)
- Minchom A et al., Amivantamab compared with real-world therapies in patients with NSCLC with EGFR exon 20 insertion mutations who have progressed after platinum doublet chemotherapy. J Clin Oncol 39, 2021 (suppl 15; abstr 9052)
- Yang JC et al., Afatinib for the treatment of NSCLC harboring uncommon EGFR mutations: a database of 693 cases. J Thorac Oncol 2020; 15(5): 803-815
- Kobayashi Y, Mitsudomi T. Not all epidermal growth factor receptor mutations in lung cancer are created equal: perspectives for individualized treatment strategy. Cancer Sci 2016; 107(9): 1179-1186
- Miura S et al., Activity of epidermal growth factor receptor tyrosine kinase inhibitors in patients with NSCLC with uncommon EGFR mutations: a real-world cohort study (UpSwinG). J Clin Oncol 39, 2021 (suppl 15; abstr 9072)
- Lu S et al., A multicenter, open-label, single-arm, phase II study: the third generation EGFR tyrosine kinase inhibitor almonertinib for pretreated EGFR T790M-positive locally advanced or metastatic non-small cell lung cancer (APOLLO). Proceedings of AACR 2020, abstract CT190
- Lu S et al., AENEAS: randomized phase III trial of aumolertinib (almonertinib) versus gefitinib as first-line treatment of patients with locally advanced or metastatic non-small cell lung cancer and EGFR exon 19 del or L858R mutations. J Clin Oncol 39, 2021 (suppl 15; abstr 9013)
© 2021 Springer-Verlag GmbH, Impressum