检查点抑制在致癌基因驱动的肺癌中表现如何?
各种畸变的影响
回顾性分析显示,免疫检查点抑制剂(CPI)在带有可操作致癌驱动突变的患者中的活性有限[1, 2]。在类似情况下,随机对照的IMpower150和IMpower130研究表明,在携带EGFR和ALK畸变的患者中,将CPI添加到铂双药中没有生存期益处[3, 4]。
Kelly等人报告的回顾性研究描述了在致癌基因驱动的NSCLC的情况下,化疗外加CPI与单独化疗的PFS和其他终点[5]。纳入的患者至少有一个驱动突变(EGFR、ALK、ROS1、MET、RET、KRAS、HER2、NTRK)。在2018年1月至2019年12月期间,他们在NCI指定的加州大学癌症中心 (University of California Cancer Centers) 接受了含或不含检查点抑制的铂类双药方案。
总共有147名患者被纳入分析。EGFR突变构成最常见的驱动改变(49.7%),其次是KRAS突变(36.7%)和ALK融合(6.8%)。2%的患者有MET突变。HER2突变、RET融合和ROS1融合各占1.4%,BRAF突变占0.7%。PD-L1表达为1-49%和≥50%的患者分别占25.2%和19.7%。30%的肿瘤不表达PD-L1,24.5%的PD-L1状态未知。
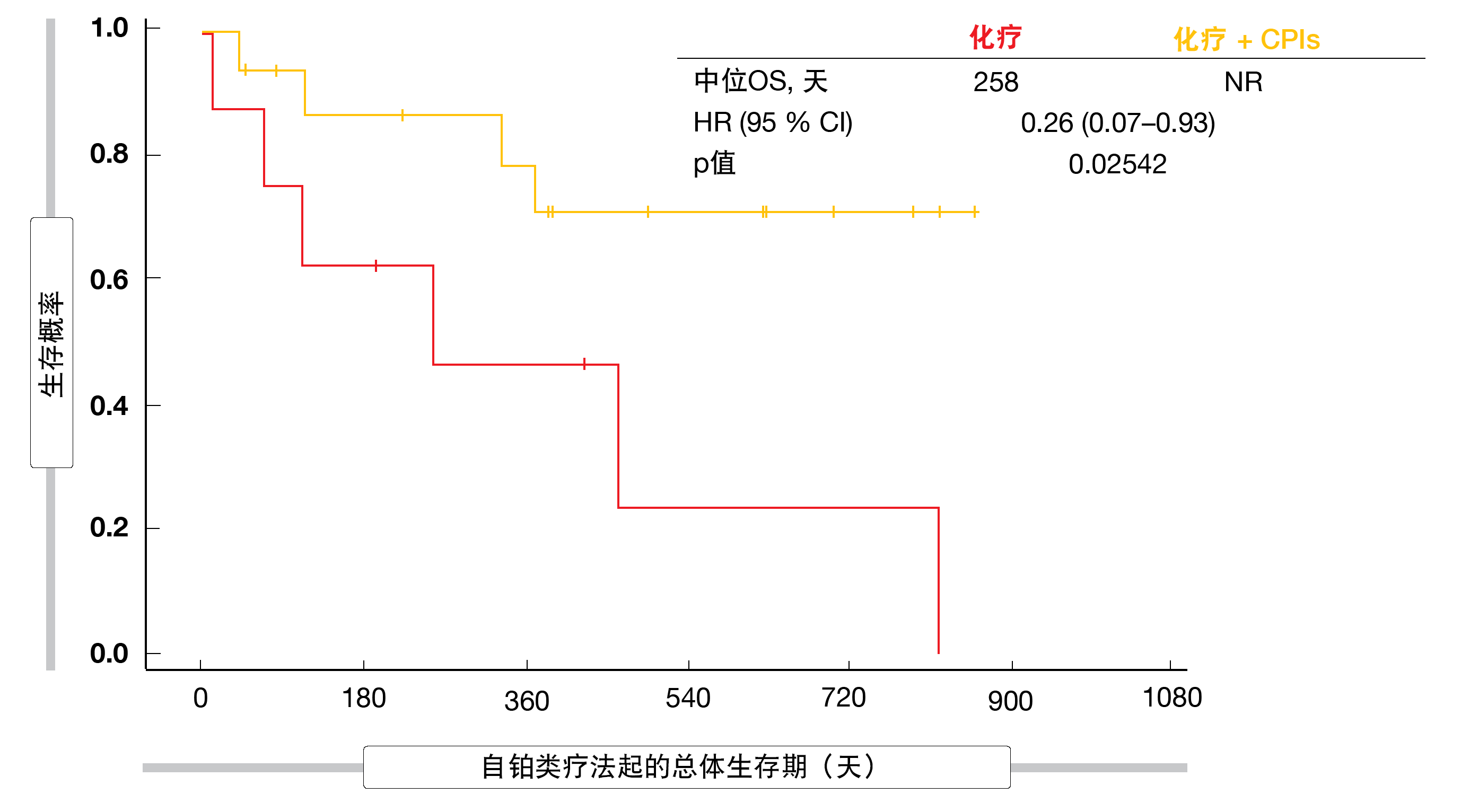
除了患有KRASG12C突变型肿瘤的小队列外,化疗外加免疫疗法与仅化疗相比在任何一组中都没有带来任何显著的PFS或OS益处。在该群体中,化疗外加CPI与化疗的中位PFS分别为249天和93天(HR,0.31;p=0.01415)。免疫疗法治疗的患者尚未达到中位OS,而仅化疗的患者的OS为258天(HR,0.26;p=0.02542;图)。分析没有发现新的安全性问题。
此外,在其他队列中比较了PFS和OS。这些队列包括从不吸烟者、现在/以前吸烟者、接受一线疗法的患者和接受二线或后线疗法的患者。在所有这些队列中,化疗外加免疫疗法与化疗相比均未观察到显著的PFS或OS差异。对于整个队列也是如此,其中分别有71和76名患者接受了联合策略和单独化疗。在此,PFS和OS的风险降低分别为7%(HR,0.93;p=0.69832)和26%(HR,0.74;p=0.18754)。
图: 在带有KRASG12C突变的患者中化疗外加CPI相比于化疗的总体生存期
抗PD-(L)1药剂与KRAS状态
虽然针对在KRAS突变型NSCLC患者中靶向KRAS的药物的III期试验正在进行中,但抗PD-(L)1疗法在该亚组中的临床疗效仍然是一个有争议的话题。因此,Landre等人进行了一项随机化研究的荟萃分析,在晚期KRAS突变型NSCLC患者中研究了联合或不联合化疗的一线或二线抗PD-(L)1抗体与单独化疗[6]。分析中包括六项试验,在总计4,809名患者中评估派姆单抗、阿特珠单抗或纳武单抗。入组这些研究的KRAS突变型疾病患者的比例介于23%和38%之间。
在KRAS突变型和KRAS野生型患者中,联合或不联合化疗的抗PD-(L)1疗法均显示出获得比单独化疗更长的OS和PFS,对突变队列的益处甚至更大。在该群体中,与化疗相比,实验治疗导致死亡风险降低41%(HR,0.59;p<0.00001),进展和死亡风险降低42%(HR,0.58;p=0.0003)。在一线和二线试验中均观察到OS获益。在KRAS野生型群体中,经免疫疗法治疗的患者获得了13%的OS益处(HR,0.87)。两个群体间的比较表明,KRAS突变患者的OS明显长于KRAS野生型患者(p=0.001)。
G12C突变与非G12C突变
另一项分析涉及在纪念斯隆-凯特琳癌症中心(Memorial Sloan Kettering Cancer Center)和丹娜法伯癌症研究院(Dana-Farber Cancer Institute)治疗的患有KRAS突变型晚期/转移性肺癌的患者中一线化学免疫治疗方案的疗效[7]。该组包括69名带有G12C KRAS突变的患者和93名带有非G12C KRAS突变的患者。两个队列中不到一半的肿瘤为PD-L1阳性。在带有G12C突变的患者和带有非G12C突变的患者中,PD-L1表达为1-49%的患者分别占31%和35%;PD-L1表达为50-100%的患者分别占12%和11%。
与带有非G12C突变的患者相比,带有G12C突变的患者在PFS(6.9与6.0个月;p=0.04)和OS(21.3与14.3个月;p=0.07)方面更多获益于化学免疫疗法。此外,研究人员评估了G12C突变组中STK11和KEAP1共突变的影响。56%的患者没有这两种突变,而有STK11突变者占15%,有KEAP1突变者占6%,两者均有者占23%。与有STK11和/或KEAP1突变的患者相比,STK11和KEAP1野生型患者接受化学免疫疗法的效果更好。这两组的中位PFS分别为15.8与5.6个月(p=0.03)。类似地,野生型患者比携带突变的患者更频繁地出现完全或部分缓解,但这种差异并不显著(p=0.11)。
除了共突变状态外,PD-L1表达也影响G12C突变组中化学免疫疗法的结果。与PD-L1阴性相比,在PD-L1阳性的情况下出现客观缓解的可能性更大,中位PFS更长(10.7与6.8个月),但这些差异都不显著。作者在其结论中指出,共突变模式和PD-L1表达状态可以鉴别出最需要替代一线疗法(如KRASG12C 抑制剂)的KRAS突变型肺癌患者。
CPI的真实世界数据与STK11共突变
这些发现得到在ASCO 2021上报告的真实世界证据的验证,这些证据评估了共同发生的STK11突变对接受包含CPI的一线方案治疗的KRASG12C突变型肺腺癌患者的结果的影响。Heist等人进行了一项基于Guardant INFORM的回顾性观察性真实世界研究,Guardant INFORM是有全国代表性的美国医疗保健索赔临床基因组数据集[8]。研究人员确定了330名有KRASG12C突变的患者和938名没有KRASG12C突变的患者。在KRASG12C突变队列中,21%的患者存在STK11基因的同时突变。没有KRASG12C突变的匹配队列包含带有其他KRAS突变的患者,以及KRAS野生型患者;后者占该组的80%。在9%的带有其他KRAS突变的患者和6%的KRAS野生型患者中发现了STK11突变。
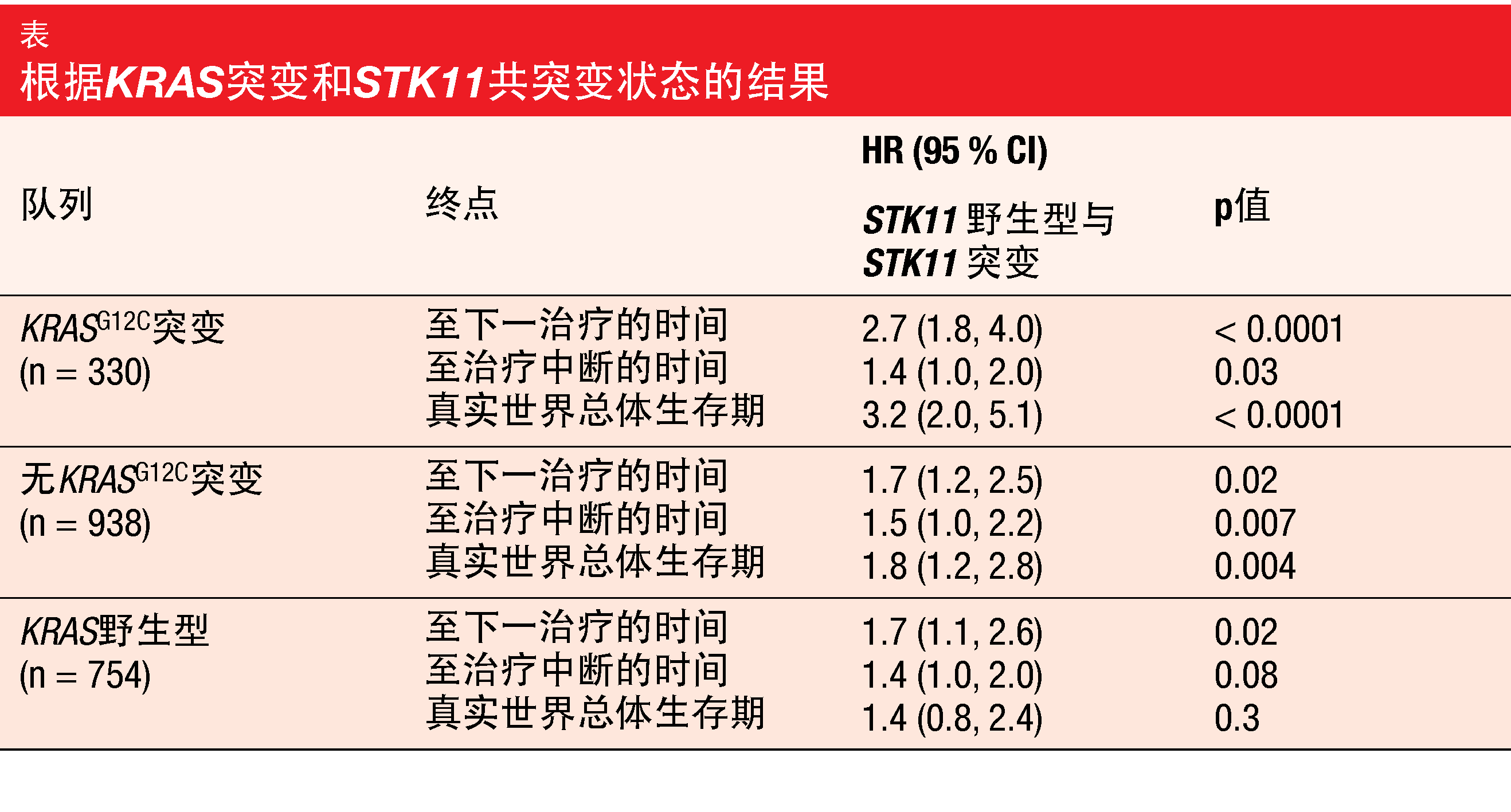
根据该分析,KRASG12C和STK11共突变与接受一线免疫疗法治疗的患者的不良结果相关。共突变组的至下一治疗的时间(TTNT)比没有STK11突变的KRASG12C突变患者短四倍以上(224与975天;HR,2.7;p<0.0001;表)。此外,至治疗中断的时间(TTD)大大缩短(172与232天;HR,1.4;p=0.03),并且真实世界的OS(rwOS)增加了3.2倍(p<0.0001)。
对于匹配的无KRASG12C队列和KRAS野生型队列,有和没有共突变的患者之间的差异较小(表)。带有其他KRAS突变且携带STK11共突变的患者的TTNT、TTD和rwOS明显短于没有STK11突变的那些患者,尽管TTNT和rwOS的经调整的HR低于KRASG12C队列的HR。在匹配的KRAS野生型组中,TTD和rwOS的差异没有统计学显著性。作者总结认为,这些较差的结果表明,对于同时发生KRASG12C和STK11突变的NSCLC患者,非常需要有效的靶向和/或联合疗法。
IO的测序与EGFR-TKI
Jones等人研究了使用CPI和驱动因子靶向TKI的顺序对在Sarah Cannon网络中治疗的患有NSCLC且带有致癌驱动突变的患者的结果的影响[9]。总体而言,确定了230名接受过CPI的驱动因子阳性患者,其中176名属于EGFR突变型类别。对照包括1,686名未接受CPI治疗的驱动因子阳性患者和1,352名EGFR突变型患者,以及2,868名驱动因子阴性、经CPI治疗的患者和4,308名未接受检查点抑制的无驱动因子突变的患者。
分析表明,与反向的顺序相比,当在TKI后接受免疫疗法时,患有致癌基因驱动的NSCLC的患者从CPI中获益的时间更长。在先接受EGFR TKI治疗的EGFR突变型肿瘤组中,至CPI失败的时间明显长于在EGFR TKI治疗前使用CPI的患者(266与210天;p<0.005)。然而,至EGFR TKI失败的时间不受顺序影响(p=0.55);在EGFR TKI之前或之后接受CPI的患者的中位总体生存期也未受影响(p=0.71)。在组合的驱动因子阳性队列中观察到类似的结果。
此外,无论顺序如何,EGFR阳性NSCLC患者在接受CPI时的存活期都略长(2,156与1,899天;p<0.005)。尽管观察到了这一点,但EGFR突变组中接受CPI治疗的患者比未接受CPI疗法的患者显示出更短的至TKI失败的时间。一般来说,EGFR阴性组比EGFR阳性组具有更长的至CPI失败的时间。同样,在组合的驱动因子阳性队列中也获得了类似的结果。正如作者所指出的,需要继续研究以鉴别携带驱动因子畸变的NSCLC患者中CPI响应的其他临床、治疗和/或基因组生物标志物。
参考文献
- Gainor JF et al., EGFR mutations and ALK rearrangements are associated with low response rates to PD-1 pathway blockade in non-small cell lung cancer: a retrospective analysis. Clin Cancer Res 2016; 22(18): 4585-4593
- Mazieres J et al., Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: results from the IMMUNOTARGET registry. Ann Oncol 2019; 30(8): 1321-1328
- Reck M et al., Atezolizumab plus bevacizumab and chemotherapy in non-small-cell lung cancer (IMpower150): key subgroup analyses of patients with EGFR mutations or baseline liver metastases in a randomised, open-label phase 3 trial. Lancet Respir Med 2019; 7(5): 387-401
- West H et al., Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2019; 20(7): 924-937
- Kelly K et al., Role of chemotherapy plus immune checkpoint inhibition in oncogenic driven lung cancer: a University of California Lung Cancer Consortium retrospective study. J Clin Oncol 39, 2021 (suppl 15; abstr 9059)
- Landre T et al., Anti-PD-(L)1 for KRAS-mutant advanced non-small-cell lung cancers: a meta-analysis of randomized, controlled trials. J Clin Oncol 39, 2021 (suppl 15; abstr 9025)
- Arbour KC et al., Chemo-immunotherapy outcomes of KRAS-G12C mutant lung cancer compared to other molecular subtypes of KRAS-mutant lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9088)
- Heist R et al., Impact of STK11 mutation on first-line immune checkpoint inhibitor outcomes in a real world KRAS G12C mutant lung adenocarcinoma cohort. J Clin Oncol 39, 2021 (suppl 15; abstr 9106)
- Jones C et al., Impact of immune checkpoint inhibitor and EGFR tyrosine kinase inhibitor sequence on time to treatment failure among EGFR+ NSCLC treated in a community-based cancer research network. J Clin Oncol 39, 2021 (suppl 15; abstr 9099)
© 2021 Springer-Verlag GmbH, Impressum