为SCLC患者开辟新路径
LS-SCLC中的顺铂与卡铂
采用铂-依托泊苷骨架的同步放化疗构成了局限期小细胞肺癌(LS-SCLC)的标准护理。在这里,顺铂传统上是首选的铂剂。然而,在这种条件下,缺乏与毒性较低的卡铂的疗效比较数据。为了填补这一空白,Azar等人基于国家VA癌症立方体数据库(National VA Cancer Cube database)进行了一项回顾性研究[1]。纳入了用含铂类多药化疗的同步放化疗治疗的经病理证实为LS-SCLC的患者。总体而言,分析包括1,756人。其中801人和1,018人分别接受了卡铂和顺铂, 63人接受了这两者。值得注意的是,年龄≥70岁的患者更倾向于用卡铂治疗,而在其他年龄组中,顺铂占优势。
对于总体生存期,两种药物的Kaplan-Meier曲线显示为可叠加的。顺铂和卡铂的I-III期中位OS分别为2.24和2.13年(HR,1.040;p=0.462)。研究人员还根据几个变量评估了OS。对于所有ECOG表现状态组(0、1、2),顺铂和卡铂之间都没有显著差异,HR分别为1.066、0.977和1.216。当然,随着表现状态的降低,OS通常会更短。这同样也适用于年龄;在这里,较年轻的患者(50-59岁和60-69岁)的OS比70岁或以上的患者长。然而,顺铂和卡铂再次在所有组中的表现同样出色(HR分别为1.021、0.944和1.020)。类似地,TNM分期(I、II、III)也未能确定任何患者从其中一种治疗中获益更大(HR分别为1.221、1.034和1.020)。
考虑到所有变量,多变量分析显示顺铂和卡铂之间没有显著差异。作者得出的结论,在LS-SCLC患者中,无论其表现状态和年龄如何,采用卡铂-依托泊苷的同步放化疗与顺铂-依托泊苷相比具有相似的OS。卡铂的有利毒性特性和相当的OS益处使其成为这种情况下可接受的选择。
晚期疾病:BiTE®疗法
δ样配体3(DLL3)是SCLC中很有前景的靶标,因为其在肿瘤组织中高表达,而在正常细胞中表达极少[2]。DLL3已在之前的研究中被证实为治疗靶点[3, 4]。DLL3靶向的半衰期延长的双特异性T细胞衔接器(BiTE®)tarlatamab(AMG 757)使患者自身的T细胞参与攻击和根除表达DLL3的癌细胞[5, 6]。在ASCO 2021上,Owonikoko等人介绍了开放标签、多中心I期研究中包括的66名患者的最新安全性、有效性和药代动力学数据,该研究在复发性或难治性SCLC中研究tarlatamab [7]。研究参与者已接受≥1线全身治疗,并且在≥1次铂类化疗后出现进展或复发。
结果支持tarlatamab作为用于SCLC的首个半衰期延长的BiTE®免疫肿瘤疗法,其具有可接受的安全特性和在整个剂量范围内(即0.003-100 mg,静脉内,每两周一次)可喜的疗效。在20%的患者中观察到确认的部分缓解,疾病控制率为47%。对于确认PR的患者,中位缓解持续时间为8.7个月。Tarlatamab表现出可管控的安全特性。细胞因子释放综合征(CRS)是最常见的治疗相关AE(全级别,44%),其次是发热(26%)和疲劳(17%)。27%的患者发生了≥3级的治疗相关AE,其中仅包括一例CRS事件(2%)。治疗期间出现的AE导致5%的患者停药。Tarlatamab血清水平随评估剂量成比例增加。8名患者(14%)发展出治疗期间出现的抗tarlatamab结合抗体,但其对血清水平或AE没有明显影响。该研究正在进行中。
多组学表征
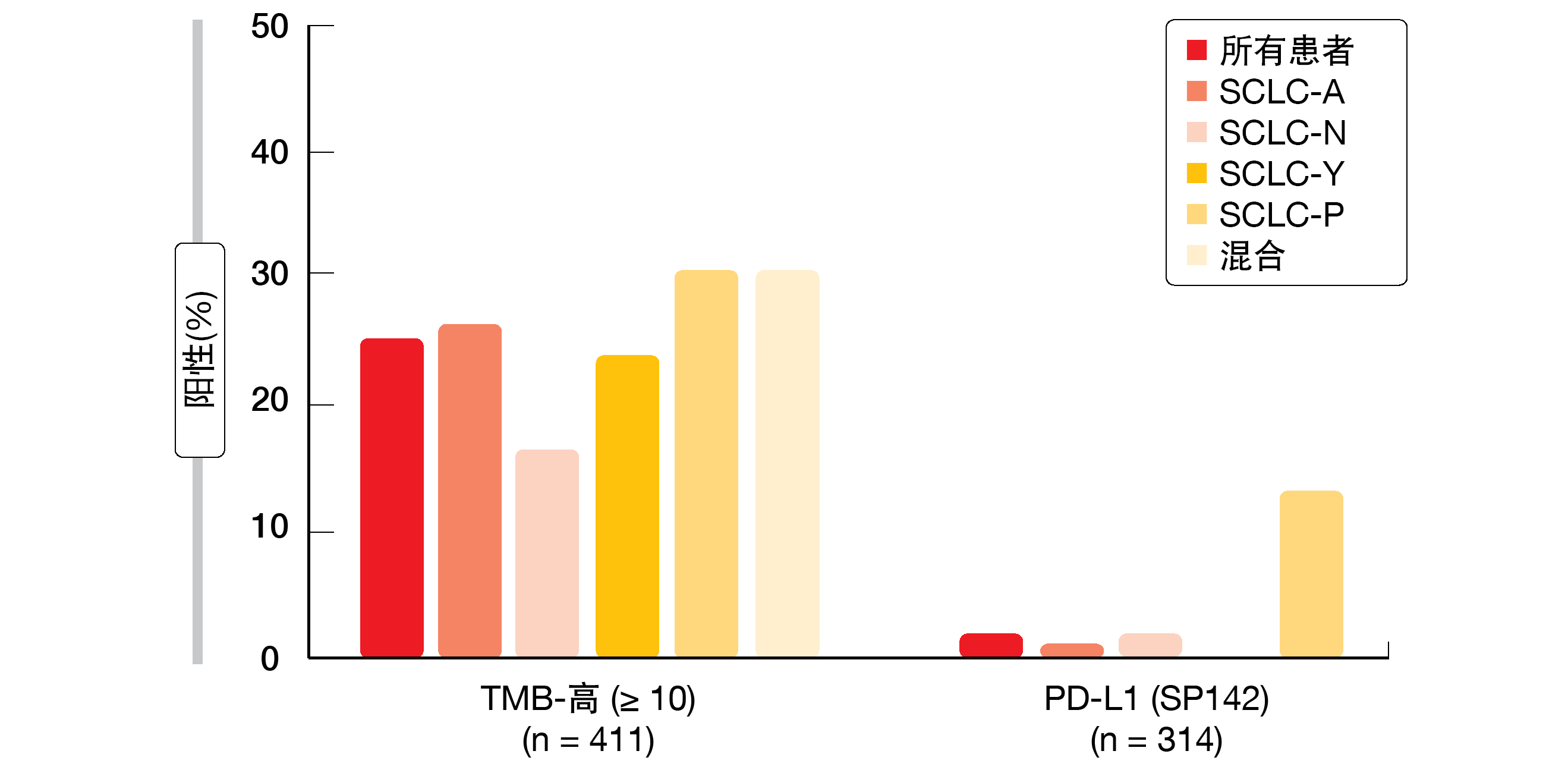
基于四种谱系限定转录因子(ASCL1、NEUROD1、YAP1、POU2F3)的显性表达,SCLC分为四种亚型(SCLC-A/N/Y/P)[8]。Puri等人使用新一代DNA测序(592基因小组)、RNA测序(全转录组)和免疫组织化学,对437个小细胞肺神经内分泌肿瘤(包括7.3%的高级别神经内分泌肺癌)进行了全面的分子谱分析[9]。根据四种转录因子的相对表达,将肿瘤分层为五个亚组(SCLC-A/N/Y/P和混合)。
该分析代表了通过新一代DNA测序和全转录组测序分析的人类SCLC肿瘤的最大真实世界数据集。分析揭示了免疫基因与预测性生物标志物跨亚型的差异表达。例如,SCLC-Y亚型显示出免疫相关特征和免疫相关细胞类型的最高中位表达。在SCLC-N亚型中观察到SLFN11和SSTR2基因的最高表达,而在SCLC-P中MYC基因表达最高。该亚型与混合组一起也最常表现出高肿瘤突变负荷,并且根据SP142测定显示出显著增加的PD-L1表达(13%;p=0.0046;图)。CNS转移主要源
自神经内分泌-高亚型(SCLC-A和SCLC-N)。RB1突变频率在ASCL1组中最高(79.2%),在YAP1组中最低(49.4%)。据研究人员称,基因和生物标志物的差异表达可以提供关于SCLC的合理和个性化治疗方法的治疗脆弱性的信息。
图: 跨转录定义的SCLC亚型的免疫疗法应答的临床相关生物标志物
参考文献
- Azar I et al., Cisplatin vs carboplatin for the treatment of limited-stage small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 8565)
- Leonetti A et al., Notch pathway in small-cell lung cancer: from preclinical evidence to therapeutic challenges. Cell Oncol (Dordr) 2019; 42(3): 261-273
- Rudin CM et al., Rovalpituzumab tesirine, a DLL3-targeted antibody-drug conjugate, in recurrent small-cell lung cancer: a first-in-human, first-in-class, open-label, phase 1 study. Lancet Oncol 2017; 18(1): 42-51
- Morgensztern D et al., Efficacy and safety of rovalpituzumab tesirine in third-line and beyond patients with DLL3-expressing, relapsed/refractory small-cell lung cancer: results from the phase II TRINITY study. Clin Cancer Res 2019; 25(23): 6958-6966
- Stieglmaier J et al., Utilizing the BiTE (bispecific T-cell engager) platform for immunotherapy of cancer. Expert Opin Biol Ther 2015; 15(8): 1093-1099
- Einsele H et al., The BiTE (bispecific T-cell engager) platform: Development and future potential of a targeted immuno-oncology therapy across tumor types. Cancer 2020; 126(14): 3192-3201
- Owonikoko TK et al., Updated results from a phase 1 study of AMG 757 (tarlatamab), a half-life extended bispecific T-cell engager (HLE BiTE®) immune-oncology therapy targeting delta-like ligand 3 (DLL3), in small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 8510)
- Rudin CM et al., Molecular subtypes of small cell lung cancer: a synthesis of human and mouse model data. Nat Rev Cancer 2019; 19(5): 289-297
- Puri S et al., Real-world multiomic characterization of small cell lung cancer subtypes reveal differential expression of clinically relevant biomarkers. J Clin Oncol 39, 2021 (suppl 15; abstr 8508)
© 2021 Springer-Verlag GmbH, Impressum