EGFR突变型疾病:针对敏感突变和耐药性介导突变的策略
靶向HER3:帕曲妥单抗-德卢替康(patritumab deruxtecan)
EGFR酪氨酸激酶抑制剂(TKI)是EGFR突变型NSCLC患者的既定一线选择,但从长远来看不可避免地会产生耐药性。在EGFR TKI耐药性的背景下,已经鉴别了多种基因组改变[1, 2]。HER3在83%的NSCLC肿瘤中表达[3],不会在EGFR突变型疾病中赋予对EGFR TKI疗法耐药性。因此,靶向HER3的抗体-药物偶联物帕曲妥单抗-德卢替康(HER3-Dxd)是EGFR TKI治疗失败后潜在有效的后续选择。
I期U31402-A-U102剂量递增和剂量扩展研究在EGFR-TKI耐药性NSCLC患者中测试了HER3-Dxd。在ASCO 2021上, Jänne等人报告了该试验中用5.6 mg/kg剂量治疗的57名患者的汇总疗效结果。介绍了总计81人的安全性;该组包含剂量递增和剂量扩展队列1中的全部患者(即,具有腺癌组织学和EGFR突变的经预先治疗的患者)[4]。整个群体接受的中位先前治疗线为4。疗效群体和安全性群体中分别有91%和80%接受铂类化疗。
对不同耐药性机制的疗效
尽管经大量的预先治疗,患者仍经历了具有临床意义的持久抗肿瘤效果。HER3-Dxd 产生了39%的确认ORR和72%的疾病控制率(DCR)。中位缓解持续时间为6.9个月,中位PFS为8.2个月。先前用奥希替尼(osimertinib)和铂类化疗治疗的患者亚组显示相似的疗效;这里的ORR、DCR和中位PFS分别为39 %、68 %和8.2个月。证明HER3-Dxd对多种EGFR耐药性机制有活性,并且对根据膜H评分的基线HER3表达谱具有活性。HER3在所有可评估患者的肿瘤中均有表达,并且与上次EGFR TKI给药后的时间无关。此外,无论是否存在CNS转移,治疗都是有效的。
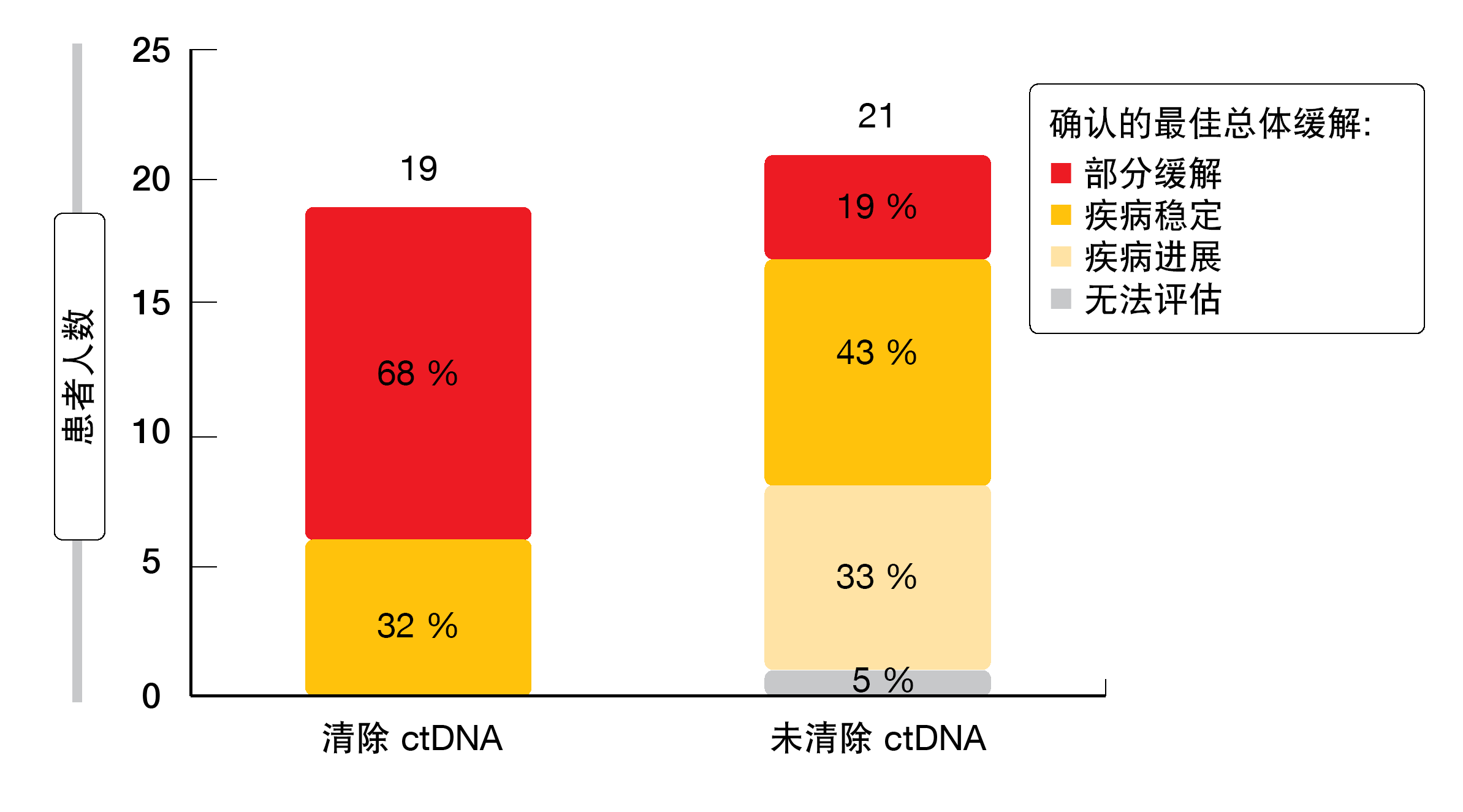
在疗效群体中,57名患者中有40名在基线时在血浆中具有可检测的EGFR外显子19缺失或L858R突变。这些畸变在第3或6周时的早期清除,与未清除相比,与改善的最佳缓解(图1)和延长的PFS(8.3与4.4个月;HR, 0.33)有关。HER3-Dxd显示出可管控的安全特性。在5.6 mg/kg和全剂量群体中,由于治疗期间出现的AE(TEAE)导致的治疗中断率分别低至11%和9%。在≥3级的TEAE中,血小板和中性粒细胞计数减少最常见。治疗相关的间质性肺病事件的发生率较低(占总群体的5%),且不是4/5级。正在EGFR突变型NSCLC条件下进一步评估HER3-Dxd。
图1:在采用帕曲妥单抗-德卢替康的治疗中早期清除ctDNA中的外显子19缺失和L858R突变时观察到的患者缓解改善
奥希替尼后的阿米万单抗(amivantamab)/拉泽替尼(lazertinib)
在使用第三代TKI奥希替尼治疗时出现疾病进展的患者中,耐药突变最常是EGFR依赖性的(例如,C797S突变)或MET依赖性的(例如,MET扩增)[5, 6]。其他途径如PIK3CA或RAS/RAF也可能参与其中,但在40-50%的患者中无法确定耐药机制。多种机制同时发生很常见。
奥希替尼失败后的潜在治疗方法是阿米万单抗(一种靶向EGFR和MET的双特异性抗体)与强力第三代EGFR TKI拉泽替尼的组合。两种药机都显示出针对多种EGFR突变的临床活性[7-11]。基于这些观察结果,在I期CHRYSALIS试验的剂量扩展阶段中采用阿米万单抗外加拉泽替尼治疗了45名具有EGFR外显子19缺失或L858R突变的未化疗患者,这些患者经奥希替尼治疗后疾病进展。阿米万单抗从第2周期起以每两周1050 mg(体重< 80 kg)或1400 mg(≥80 kg)的剂量静脉内给予,而拉泽替尼每天口服240 mg。
在ASCO 2021上介绍的分析表明该组合带来持久缓解[12]。在中位随访时间11.0个月后,ORR为36%,并且64%的患者显示出临床获益(即,完全或部分缓解,外加疾病稳定≥11周)。中位缓解持续时间为9.6个月;69%的患者缓解至少6个月。中位PFS为4.9个月。该分析同时揭示该方案具有可管控的安全性。最常见的AE是输注相关反应、皮疹和甲沟炎,其中大部分评级为1或2级。分别有18%和4%的患者发生治疗相关的剂量降低和中断。
根据NGS和IHC的患者选择
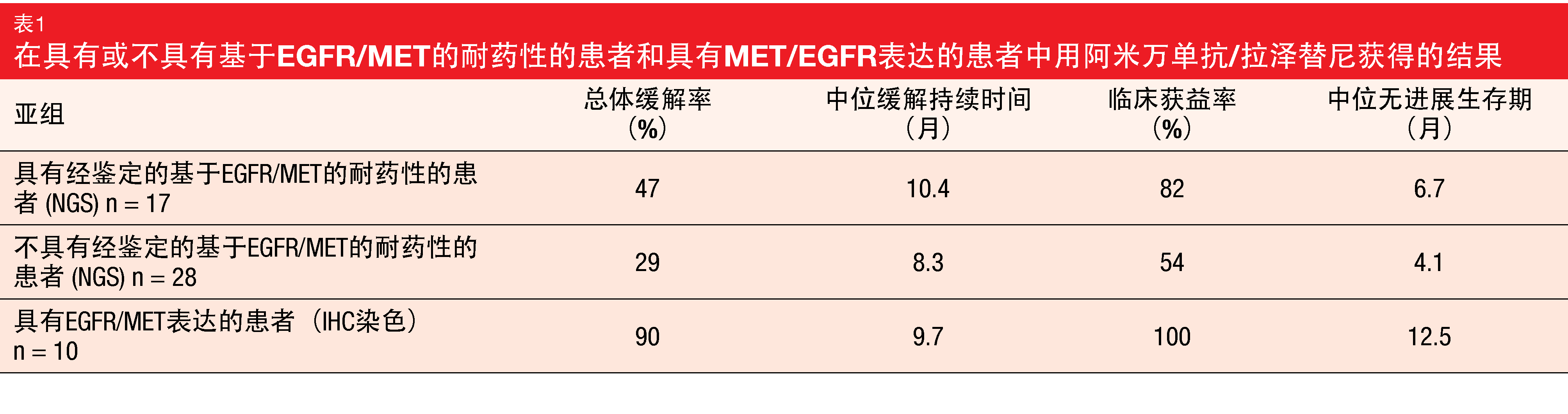
CHRYSALIS试验的设计包括使用新一代测序(NGS)和免疫组织化学(IHC)的生物标志物分析。根据NGS,45名患者中的17人具有基于EGFR或MET的耐药性。在其余的28名患者中,12人具有可鉴定的改变,如PIK3CA E545K突变或CCND1扩增。在ORR、缓解持续时间、临床获益率和PFS方面,具有基于EGFR/MET的耐药性的患者比不具该耐药性的患者表现更好(表1)。然而,经确认的缓解者中有一半并未被NGS鉴别。
在20个病例中,肿瘤活检物足以在NGS后用于IHC染色。其中,10名患者的组合EGFR/MET H评分≥400,并且该组的结果优秀(表1)。无论潜在的遗传耐药机制如何,IHC都能鉴别出患者。因此,作者提议,根据IHC的EGFR/MET表达可用作鉴别潜在缓解者的替代途径。I/Ib期CHRYSALIS-2研究将寻求在新的经奥希替尼预先治疗的队列中前瞻性地验证这些生物标志物(NCT04077463)。
MET扩增:策略的比较
尽管MET扩增是针对EGFR TKI疗法的获得性耐药性的重要机制,但尚无基于这种畸变的进行性疾病的治疗标准。通常使用三种策略:EGFR-TKI和MET-TKI联合疗法、MET-TKI单一疗法或化疗。一项真实世界研究在70名患有EGFR突变型NSCLC且带有获得性MET扩增的患者中比较了这三种方法[13]。治疗包括EGFR TKI疗法外加克唑替尼(crizotinib)(n=38)、单独克唑替尼(n=10)或化疗(n=22)。
该组合在整个队列中显示出最有利的结果。与化疗相比,在ORR(p=0.026)、DCR(p=0.016)和 PFS(p=0.036)方面具有显著优势。三组的OS相当。此外,EGFR TKI外加克唑替尼方法在具有并发TP53突变或EGFR扩增(它们是三个队列中最常见的并发突变)的患者中显示出活性。正如作者所指出的,联合EGFR和MET抑制可能是该患者亚组的首要选择。
序贯阿法替尼(afatinib)-奥希替尼的有利发现
在大约50-70%的病例中,在第一代和第二代EGFR TKI失败后,T790M突变成为主要的耐药机制[14-17]。众所周知,使用奥希替尼可以有效靶向T790M。阿法替尼和奥希替尼的序贯给予已被证明有助于延长T790M耐药患者的无化疗治疗[18]。在ASCO 2021上报告的来自韩国的真实世界数据评估了以下四组接受一线阿法替尼疗法的患者的治疗时间:在存在T790M的情况下,被开具后续奥希替尼处方的患者(队列A;n=116);在没有T790M的情况下,接受其他后续治疗的患者(队列B;n=143);接受其他治疗且T790M状态未知的患者(队列C;n=111);和仅接受阿法替尼治疗且尚未接受任何二线疗法的患者(队列D;n=367)[19]。
总研究群体的中位治疗时间(TOT)为23.42个月。对于队列A-C,一线条件下的中位TOT分别为17.43、14.19和7.13个月,因此证明了阿法替尼-奥希替尼顺序的最有利结果。队列D中的TOT为42.61个月,这表明一线阿法替尼可使某些患者保持长期、无化疗的疾病控制。在二线中,队列A再次显示出最佳结果,TOT为11.04个月;对于队列B和C,TOT分别为3.32和2.43个月。
类似地,队列A中第一线和第二线的缓解率最高。在阿法替尼治疗后出现进展的患者中,70.81%进行了再活检。其中,T790M的检出率为44.27%。
根据作者的结论,在获得T790M耐药突变后,阿法替尼继以奥希替尼是一种可行且有效的策略。
带有外显子20插入的患者的结果
在EGFR突变中,外显子20插入突变(Exon20ins)是第三常见的改变,发生率高达12% [20, 21]。目前,尚无靶向治疗获批用于转移性条件下的带有Exon20ins的肺癌患者。已观察到EGFR TKI、铂类化疗、多西他赛(docetaxel)和免疫疗法的活性有限[22-28]。
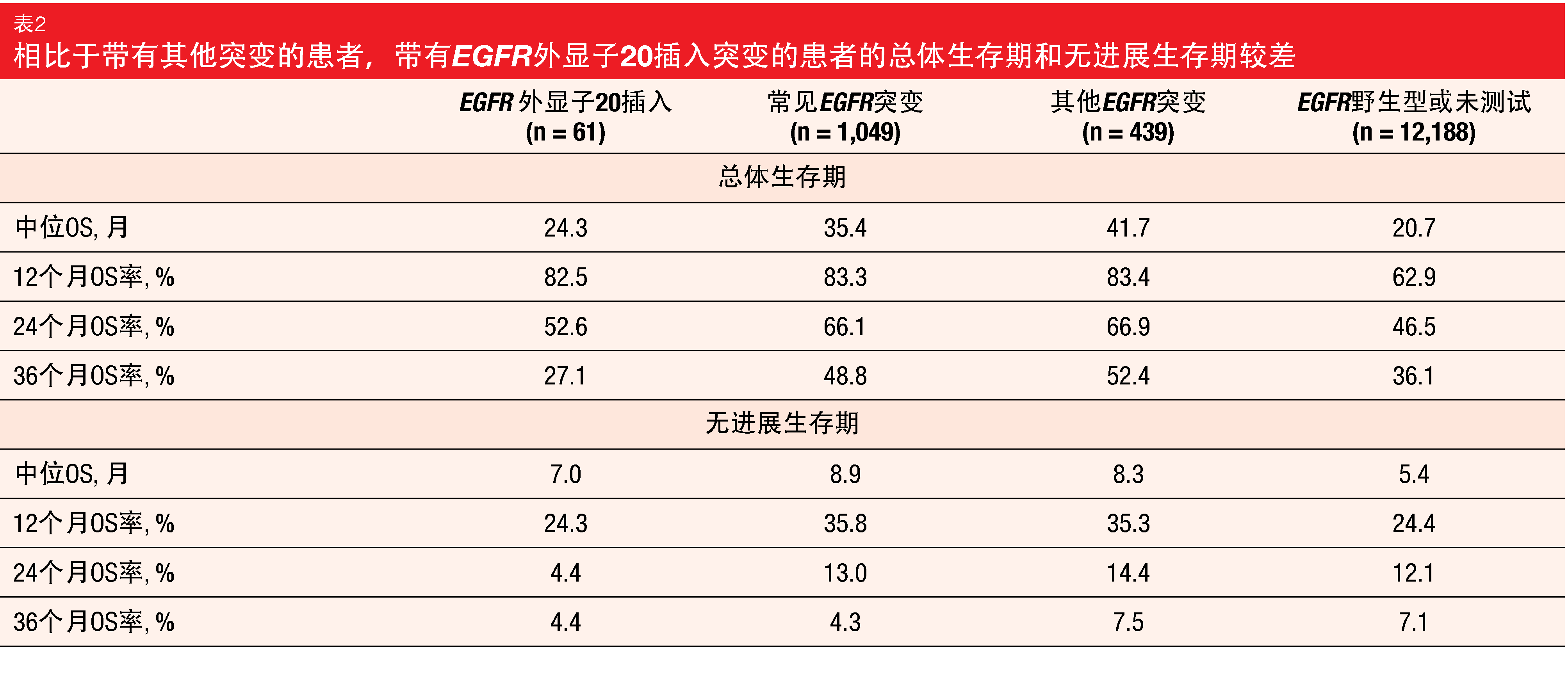
Chouaid等人进行的回顾性真实世界研究描述了携带EGFR Exon20ins的晚期非鳞状NSCLC患者的治疗模式和临床结果[29]。数据来源是法国流行病学战略与医学经济学晚期转移性肺癌数据平台(French Epidemiological Strategy and Medical Economics Advanced and Metastatic Lung Cancer Data Platform)。在总共13,737名患者中,根据EGFR突变状态定义了四个队列:有Exon20ins,无外显子19缺失/L858R突变(n=61);常见的EGFR突变(即,有外显子19缺失或L858R,无Exon20ins;n=1,049);其他EGFR突变(n=439);野生型EGFR突变或未检测(n=12,188)。
Exon20ins组占总数的3.9%,证实这是NSCLC患者中罕见的畸变。在该队列中,74.1%患者被施用一线化疗,13.7%被施用EGFR TKI治疗,8.6%被施用免疫疗法。患者的预后与野生型EGFR突变或未检测组相似,比常见或其他EGFR突变组差(表2)。与带有常见EGFR突变的患者相比,中位OS明显缩短(24.3与35.4个月;p=0.049),中位PFS(7.0与8.9个月;p=0.0167)也是如此。作者指出,这些观察结果突出了推进对带有外显子20插入突变的患者的治疗的必要性。
铂预先治疗后的mobocertinib
同类首个口服不可逆EGFR TKI mobocertinib已开发用于抑制EGFR Exon20ins和其他有或没有T790M的EGFR突变。Mobocertinib正在I/II期研究中包括的总共七个队列中进行临床评估。在ASCO 2021上,Ramalingam等人报告了经铂预先治疗的患者(PPP;即在剂量递增、扩展或EXCLAIM队列中接受160 mg/d mobocertinib的铂类治疗后患有Exon20ins阳性转移性NSCLC的患者)和EXCLAIM队列(即,接受mobocertinib 160 mg/d的经先前治疗的患有Exon20ins阳性转移性NSCLC的患者)的结果[30]。PPP和EXCLAIM队列分别包括114和96人。
Mobocertinib诱导了深度持久的缓解。根据独立审查委员会,PPP和EXCLAIM队列的ORR分别为28%和25%。两组中近80%的患者达到了疾病控制(分别为78%和76%)。在PPP队列中,中位缓解持续时间为17.5个月,而在EXCLAIM队列中尚未达到。PPP队列中的中位PFS和OS分别为7.3和24.0个月。
缓解的发生独立于预先治疗,并且在多个Exon20ins亚型上出现,无论其频率或距C螺旋的位置如何。与已知的EGFR TKI安全特性一致,mobocertinib引发的AE主要包括可管控的胃肠道和皮肤事件。在PPP和EXCLAIM队列中,AE导致的剂量减少的发生率分别25%和22%。分别有17%和10%的患者必须中断治疗。
使用EORTC QLQ-LC13和EORTC QLQ-C30问卷在EXCLAIM队列中评估了患者报告的结果。据表明,呼吸困难、咳嗽和胸痛相对于基线的临床意义改善在第2周期中很明显,并在整个治疗过程中得以保持。同样,尽管在治疗期间胃肠相关症状评分恶化,但在研究期间保持了平均水平的总体健康状况/生活质量评分。作者总结到,mobocertinib在经先前治疗的患有EGFR Exon20ins阳性转移性NSCLC的患者中显示具有有利的风险-收益特性,并且可能为这一需求远未得到满足的群体提供有意义的治疗选择。
Exon20ins阳性疾病中的阿米万单抗
在CHRYSALIS试验中,阿米万单抗单一疗法在患有晚期NSCLC且带有EGFR Exon20ins的患者中显示出持久的缓解[8, 9]。Minchom等人在真实世界条件下在接受过先前铂类化疗的带有Exon20ins的肺癌患者中评估了阿米万单抗与医生所选择的抗癌治疗的疗效[31]。为此,研究人员将来自包括在CHRYSALIS中的Exon20ins群体的81名铂治疗后的患者的疗效分析集与源自三个真实世界的美国数据集的外部对照分析集(n=174)进行了比较。对照患者符合CHRYSALIS研究的相关合格标准。他们最常见的疗法是非铂类化疗、免疫疗法、含铂方案和EGFR TKI。
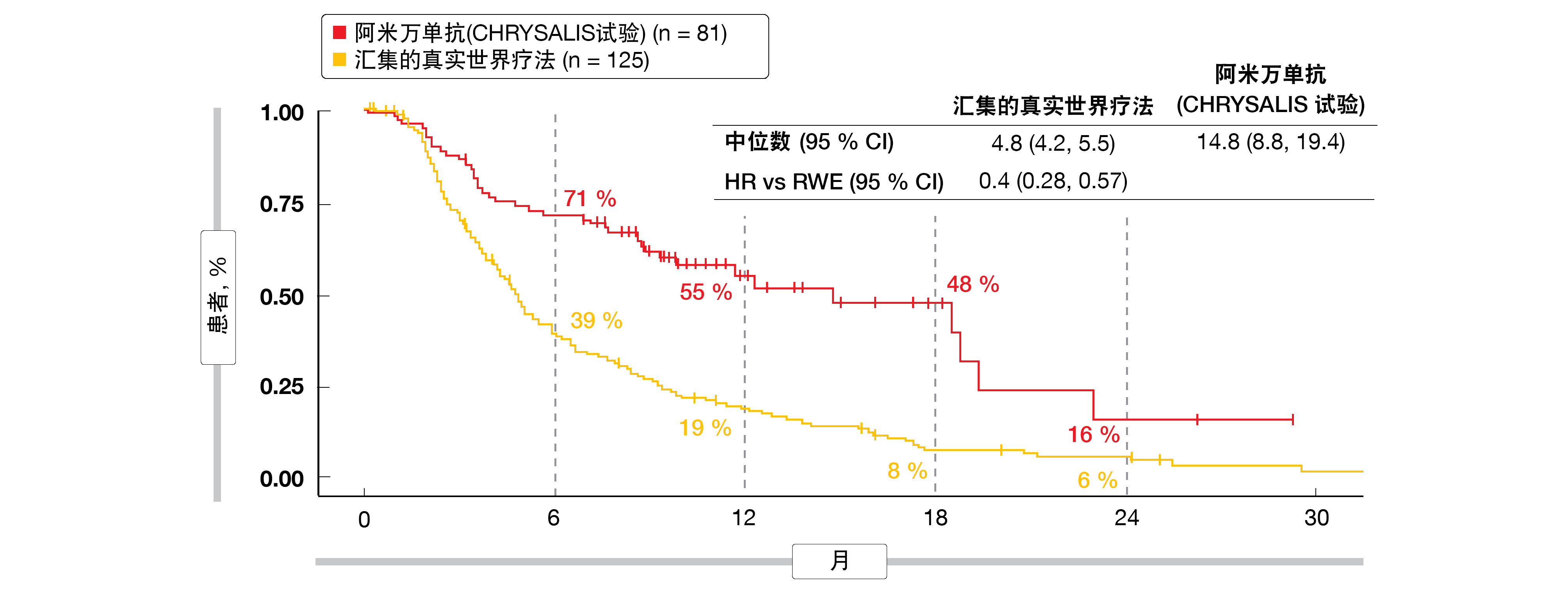
与真实世界队列相比,阿米万单抗治疗的患者的进展风险降低了 53%(中位PFS,8.3与2.9个月;HR,0.47)且死亡率降低51%(中位OS,22.8与12.8月;HR,0.49)。至下一治疗的时间延长了10个月(14.8与4.8个月;HR,0.40;图2)。正如作者所指出的,外部对照的较差表现反映了当前可用的真实世界治疗的无效性,并突显了为患有晚期NSCLC且带有EGFR Exon20ins的患者确定更多靶向治疗的迫切需要。
图2: 与来自三个数据库的真实世界结果相比,带有EGFR外显子20插入突变的患者使用单药阿米万单抗时至下一治疗的时间
真实世界中的罕见突变
据估计,被归类为罕见的EGFR突变,即不属于缺失19或L858R突变的突变,占EGFR突变库的7%-23% [32]。对TKI疗法敏感的“主要”罕见突变包括G719X、S768I和L861Q。尽管这是一个高度异质性的群组,Exon20ins突变被认为对EGFR TKI具有耐药性。已知T790M会赋予对第一代和第二代TKI的耐药性。对于其他罕见突变,关于TKI敏感性的数据很少。此外,多达三分之一的EGFR突变型肿瘤携带复合突变。可以预期,更多地使用基于测序的灵敏检测方法和液体活检将增加在真实世界临床实践中检测到的罕见突变的频率[33]。
在欧洲和亚洲9个国家进行的真实世界队列研究UpSwinG调查了带有≥1个罕见EGFR突变并接受过EGFR TKI(阿法替尼、吉非替尼、厄洛替尼(erlotinib)、奥希替尼)的患者在第一线或第二线中的治疗和结果[34]。分析中总共包括246人。大多数是亚洲人,其中不到10%有脑转移,因为活动性脑转移构成了排除标准。
分析表明,EGFR TKI通常是首选的一线治疗(91.9%与化疗的8.1%)。阿法替尼是最常用的指标疗法(54.1%),其次是吉非替尼(28.7%)、厄洛替尼(14.3%)和奥希替尼(2.9%)。TKI疗法在至治疗失败的时间(TTF)、OS和ORR等主要终点方面取得了可喜的结果。阿法替尼和第一代TKI的TTF分别为11.3和8.8个月,OS分别为24.5和24.2个月。总体而言,一线治疗中43.9%的患者获得部分缓解,41.7%可见疾病稳定。对二线治疗的响应包括分别为22.2%和49.1%的部分缓解和疾病稳定。
随着时间的推移,患者的健康状况在很大程度上得以保持;在一线疗法开始时,半数患者的ECOG表现状态为1,而在二线疗法开始时,这一比例仅略有下降(45.7%)。临床结果因突变类别而异;TTF和ORR通常在带有主要罕见突变和复合突变的亚组中最有利。作者得出结论,对于大多数肿瘤携带罕见EGFR突变的患者,应考虑使用EGFR TKI进行治疗。
阿美替尼(aumolertinib)的一线益处
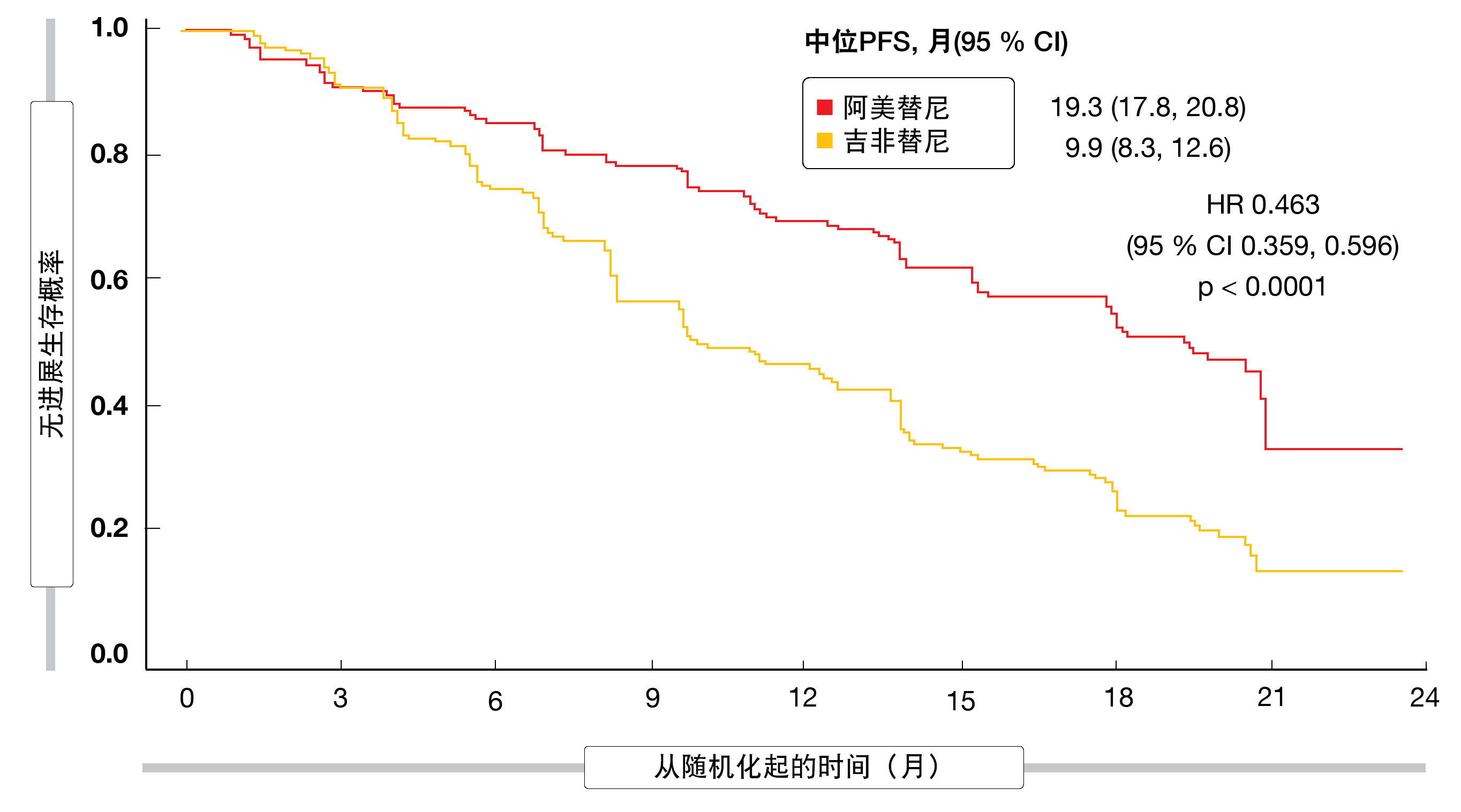
阿美替尼是一种新型的第三代不可逆EGFR TKI,其选择性抑制敏感突变和耐药EGFR突变。基于APOLLO试验,该药物于2020年在中国获得批准,该药物在发生T790M突变后接受第一代或第二代EGFR TKI治疗后进展的EGFR突变型NSCLC患者中展现出强大的疗效[35]。在一线条件下,随机化、双盲、III期AENEAS试验在携带外显子19缺失或L858R突变的局部晚期或转移性NSCLC患者中测试了110 mg/d阿美替尼(n=214) 与250 mg/d吉非替尼(n=215)[36]。
与吉非替尼相比,阿美替尼显著改善了PFS(中位PFS,19.3与9.9个月;HR,0.463;p<0.0001;图3)。12个月时,PFS率为69.5%与46.3%,而24个月时为32.5%与12.9%。PFS获益在与EGFR突变类型、存在脑部病变、性别、年龄、吸烟史和ECOG表现评分相关的亚组中都得以保持。两组均未达到中位OS(HR,0.82)。ORR没有差异(73.8%与72.1%),但实验组的缓解持续时间明显更长(18.1与8.3个月;HR,0.38;p<0.0001)。
阿美替尼总体耐受性良好。患者最常经历肌酸磷酸激酶升高、转氨酶升高和血细胞减少症。与吉非替尼相比,采用阿美替尼出现皮疹的频率更低(23.4%与41.4%),腹泻也是如此(16.4%与35.8%)。采用阿美替尼的QTc延长的发生率为10.7%(等级≥3,0.9%),而采用吉非替尼则为8.8%(等级≥3,1.9%)。间质性肺病的发生率为0.9%与0.5%(两组均未发生≥3级事件)。
作者在其总结中指出,基于这些结果,他们将继续与全球监管机构进行讨论,以便促进成本显著降低的全球获取定价结构。阿美替尼与化疗和选定靶向药物的全球试验以及在辅助条件下对该药物的评估正在进行或计划中。
图3: AENEAS试验:阿美替尼与吉非替尼在无进展生存方面的一线优效性
参考文献
- Engelman A et al., MET amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling. Science 2007; 316(5827): 1039-1043
- Schoenfeld AJ, Yu HA. The evolving landscape of resistance to osimertinib. J Thorac Oncol 2020; 15(1): 18-21
- Scharpenseel H et al., EGFR and HER3 expression in circulating tumor cells and tumor tissue from non-small cell lung cancer patients. Sci Rep 2019; 9(1): 7406
- Jänne P et al., Efficacy and safety of patritumab deruxtecan in EGFR inhibitor-resistant, EGFR-mutated non-small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9007)
- Papadimitrakopoulou VA et al., Analysis of resistance mechanisms to osimertinib in patients with EGFR T790M advanced NSCLC from the AURA3 study. ESMO 2018, abstract 5121
- Ramalingam SS et al., Mechanisms of acquired resistance to first-line osimertinib: preliminary data from the phase III FLAURA study. ESMO 2018, abstract LBA50
- Haura EB et al., JNJ-61186372 (JNJ-372), an EGFR-cMet bispecific antibody, in EGFR-driven advanced non-small cell lung cancer (NSCLC). J Clin Oncol 37, 2019 (suppl; abstr 9009)
- Park K et al., Amivantamab (JNJ-61186372), an anti-EGFR-MET bispecific antibody, in patients with EGFR exon 20 insertion (exon20ins)-mutated non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9512)
- Sabari JK et al., Amivantamab in post-platinum EGFR exon 20 insertion mutation non-small cell lung cancer. J Thorac Oncol 2021; 16(3): S108-S109
- Ahn MJ et al., Lazertinib in patients with EGFR mutation-positive advanced non-small-cell lung cancer: results from the dose escalation and dose expansion parts of a first-in-human, open-label, multicentre, phase 1-2 study. 2019; 20(12): 1681-1690
- Kim SW et al., Intracranial anti-tumor activity of lazertinib in patients with advanced NSCLC who progressed after prior EGFR TKI therapy: Data from a phase I/II study. J Clin Oncol 38: 2020 (suppl; abstr 9571)
- Bauml JM et al., Amivantamab in combination with lazertinib for the treatment of osimertinib-relapsed, chemotherapy-naïve EGFR mutant non-small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9006)
- Liu L et al., A large real-world study on the effectiveness of the combined inhibition of EGFR and MET in EGFR-mutant advanced non-small-cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9043)
- Arcila ME et al., Rebiopsy of lung cancer patients with acquired resistance to EGFR inhibitors and enhanced detection of the T790M mutation using a locked nucleic acid-based assay. Clin Cancer Res 2011; 17(5): 1169-1180
- Sequist LV et al., Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors. Sci Transl Med 2011; 3(75), 75ra26
- Yang JC et al., Osimertinib in pretreated T790M-positive advanced non-small-cell lung cancer: AURA study phase II extension component. J Clin Oncol 2017; 35(12): 1288-1296
- Hochmair MJ et al., Prevalence of EGFR T790M mutation in NSCLC patients after afatinib failure, and subsequent response to osimertinib. J Thorac Oncol 2017; 12(11): Supplement 2, S2137
- Hochmair MJ et al., Sequential treatment with afatinib and osimertinib in patients with EGFR mutation-positive non-small-cell lung cancer: an observational study. Future Oncol 2018; 14(27): 2861-2874
- Jung HA et al., TOAST: totality outcome of afatinib sequential treatment in patients with EGFR mutation-positive NSCLC in South Korea: KCSG LU-19-22. J Clin Oncol 39, 2021 (suppl 15; abstr 9053)
- Riess JW et al., Diverse EGFR exon 20 insertions and co-occurring molecular alterations identified by comprehensive genomic profiling of NSCLC. J Thorac Oncol 2018; 13(10): 1560-1568
- Fang W et al., EGFR exon 20 insertion mutations and response to osimertinib in non-small-cell lung cancer. BMC Cancer 2019; 19(1): 595
- Byeon S et al., Clinical outcomes of EGFR exon 20 insertion mutations in advanced non-small cell lung cancer in Korea. Cancer Res Treat 2019; 51(2): 623-631
- Wang Y et al., Real-world treatment outcome of advanced Chinese NSCLC EGFR exon 20 insertion patients. J Clin Oncol 37, 2019 (suppl; abstr 9043)
- Udagawa H et al., Clinical outcome of non-small cell lung cancer with EGFR/HER2 exon 20 insertions identified in the LC-SCRUM-Japan. J Thorac Oncol 2019; 14(10 suppl): S224
- O’Kane GM et al., Uncommon EGFR mutations in advanced non-small cell lung cancer. Lung Cancer 2017; 109: 137-144
- Negrao MV et al., Association of EGFR and HER-2 exon 20 mutations with distinct patterns of response to immune checkpoint blockade in non-small cell lung cancer. J Clin Oncol 36, 2018 (suppl; abstr 9052)
- Yang G et al., EGFR exon 20 insertion mutations in Chinese advanced non-small cell lung cancer patients: molecular heterogeneity and treatment outcome from nationwide real-world study. Lung Cancer 2020; 145: 186-194
- Garon EB et al., Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cancer after disease progression on platinum-based therapy (REVEL): a multicentre, double-blind, randomised phase 3 trial. Lancet 2014; 384(9944): 665-673
- Chouaid C et al., EGFR exon 20 insertion – prognostic and predictive values in advanced non-small cell lung cancer, a real world study. J Clin Oncol 39, 2021 (suppl 15; abstr 9062)
- Ramalingam SS et al., Mobocertinib (TAK-788) in EGFR exon 20 insertion+ metastatic NSCLC: additional results from platinum-pretreated patients and EXCLAIM cohort of phase 1/2 study. J Clin Oncol 39, 2021 (suppl 15; abstr 9014)
- Minchom A et al., Amivantamab compared with real-world therapies in patients with NSCLC with EGFR exon 20 insertion mutations who have progressed after platinum doublet chemotherapy. J Clin Oncol 39, 2021 (suppl 15; abstr 9052)
- Yang JC et al., Afatinib for the treatment of NSCLC harboring uncommon EGFR mutations: a database of 693 cases. J Thorac Oncol 2020; 15(5): 803-815
- Kobayashi Y, Mitsudomi T. Not all epidermal growth factor receptor mutations in lung cancer are created equal: perspectives for individualized treatment strategy. Cancer Sci 2016; 107(9): 1179-1186
- Miura S et al., Activity of epidermal growth factor receptor tyrosine kinase inhibitors in patients with NSCLC with uncommon EGFR mutations: a real-world cohort study (UpSwinG). J Clin Oncol 39, 2021 (suppl 15; abstr 9072)
- Lu S et al., A multicenter, open-label, single-arm, phase II study: the third generation EGFR tyrosine kinase inhibitor almonertinib for pretreated EGFR T790M-positive locally advanced or metastatic non-small cell lung cancer (APOLLO). Proceedings of AACR 2020, abstract CT190
- Lu S et al., AENEAS: randomized phase III trial of aumolertinib (almonertinib) versus gefitinib as first-line treatment of patients with locally advanced or metastatic non-small cell lung cancer and EGFR exon 19 del or L858R mutations. J Clin Oncol 39, 2021 (suppl 15; abstr 9013)
© 2021 Springer-Verlag GmbH, Impressum