KRAS、MET、ROS1、HER2:当前观点
CodeBreaK100:索托拉西(sotorasib)
大约13%的肺腺癌患者携带KRASG12C突变[1]。尽管存在需求在经包括免疫检查点抑制剂在内的一线治疗而进展的该群体中改善结果,迄今为止,还没有靶向这种致癌驱动因子的药物获得许可。在单组II期CodeBreaK100试验中,同类首个、不可逆、选择性的KRASG12C抑制剂索托拉西已证明对经预先治疗的KRASG12C突变型局部晚期或转移性NSCLC患者具有持久的临床益处[2]。在这项研究中,126名患者每日口服960 mg索托拉西。81%的参与者之前接受过铂类化疗和免疫疗法二者。在ASCO 2021上,Skoulidis等人介绍了最新的疗效和安全性数据,包括在中位随访15.3个月后的成熟的总体生存期,并报告了各个患者亚组的结果[3]。
索托拉西继续提供持久的临床益处,中位OS为12.5个月,中位PFS为6.8个月。总体而言,37.1%的患者缓解,4名患者(3.2%)达到完全缓解。疾病控制率为80.6%,中位缓解持续时间为11.1个月。治疗相关的AE(TRAE)大多为1/2级,并被证明是可管控的。19.8%的患者发生了3级TRAE。腹泻、恶心和转氨酶升高最为常见。剂量调整和中断的发生率分别为22.2%和7.1%。
索托拉西治疗在一系列患者亚组中表现出广泛且一致的临床活性。无论包括年龄、先前治疗线数和预先治疗的类型在内的基线特征如何,ORR和中位OS都是有利的。值得注意的是,在免疫检查点抑制后的未接受过铂类化疗的13名患者中,索托拉西的ORR为69.2%,中位OS为17.7个月。
在STK11突变型疾病中的活性提高
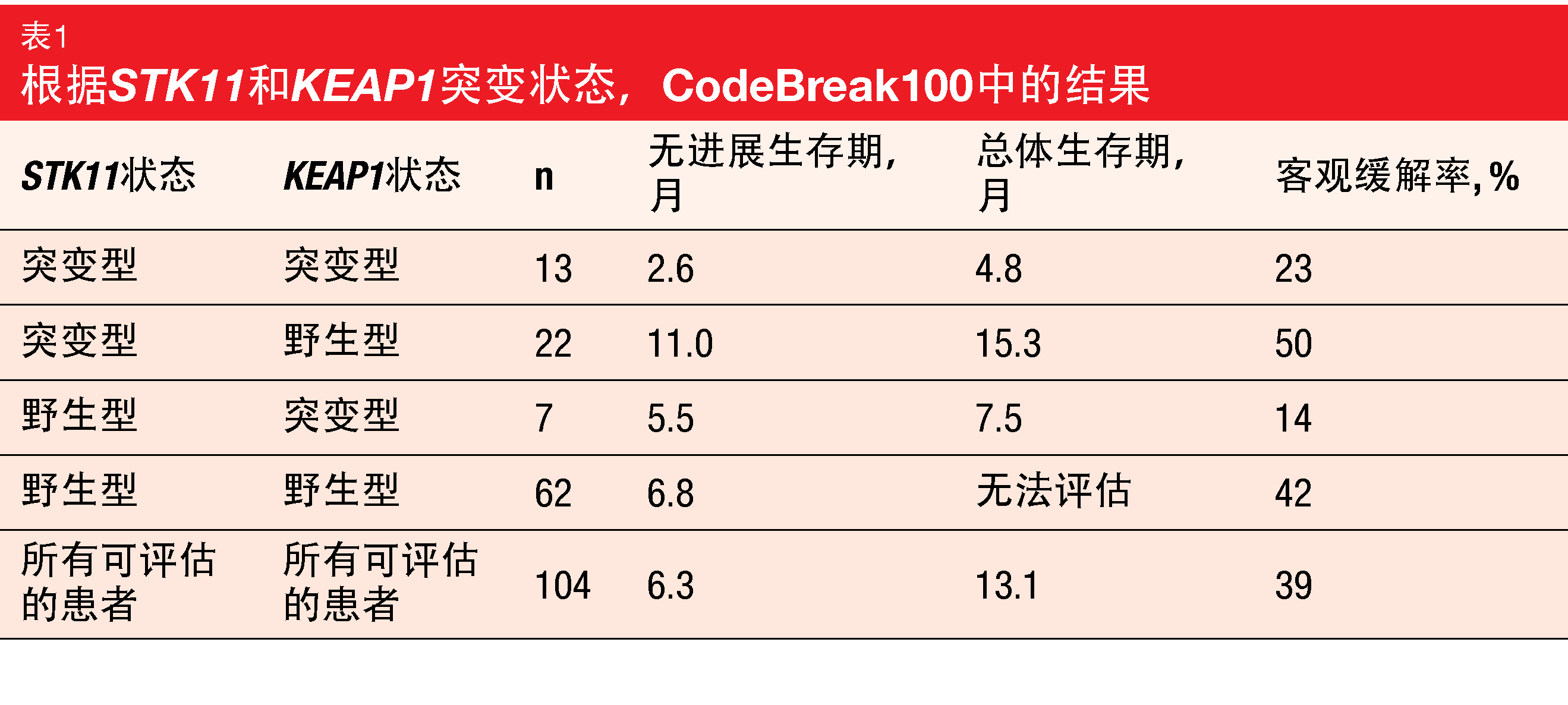
预先指定的探索性分析包括在分子水平下定义的亚组中评估索托拉西。这些分析表明实现ORR的可能性与KRASG12C突变等位基因频率无关。此外,84名具有高或低肿瘤突变负荷(定义为≥10与<10 mut/mb)的患者的ORR没有变化。还按照STK11和KEAP1中同时发生突变来评估终点(n=104)。这具有临床相关性,因为这些基因中的失活性体细胞突变之前与采用标准护理疗法(包括化疗和免疫疗法)时患者的结果较差有关。
这里,在同时带有野生型KEAP1的STK11突变组中观察到索托拉西治疗的疗效提高,ORR为50%,在数值上超过了在所有可评估患者中39%的ORR。该组的中位PFS为11.0个月,而STK11和KEAP1野生型的患者的中位PFS为6.8个月,整个队列的中位PFS为6.3个月(表1)。类似地,在携带STK11突变和野生型KEAP1的群体中,中位OS最长。另一方面,KEAP1突变组似乎从索托拉西治疗中获益较少。然而,这些分析由于其探索性和小样本量而受到限制。目前,在经预先治疗的KRASG12C突变型NSCLC中评估索托拉西与多西他赛的验证性III期CodeBreaK200试验正在进行中(NCT04303780)。
卡马替尼(capmatinib):GEOMETRY mono-1的更新结果
在开放标签、多队列、II期GEOMETRY mono-1研究中,口服的高效选择性MET抑制剂卡马替尼在患有IIIB/IV期NSCLC且带有MET外显子14跳跃突变(METex14)的患者中显示出具有临床意义的疗效[4]。卡马替尼已在多个国家获批用于治疗晚期METex14阳性NSCLC患者。GEOMETRY mono-1还招募了带有MET扩增的患者,包含四个METex14队列:队列5b和扩展队列7包括初治患者,而在队列4和扩展队列6中评估经预先治疗的患者。总共有160名患者被分配到这四组。在ASCO 2021上,Wolf等人报告了队列7(n=32)的初步数据以及其他最新的结果[5]。
据分析,该组的ORR为65.6%,与先前针对队列5b报告的67.9%的ORR相符[4]。队列7的中位PFS为10.8个月,而中位OS尚未达到。队列5b的初治患者和队列4的经预先治疗患者都获得了具有临床意义的OS结果,他们的中位OS分别为20.8和13.6个月。作者强调了卡马替尼给这些群体带来的长期生存益处。包含经二线和三线治疗的患者的队列4显示ORR为40.6%。在仅限于二线治疗条件的队列6中,ORR为51.6%。较早出现缓解。
在长期随访后,卡马替尼的可控安全性保持不变。在治疗相关的AE中,外周水肿和恶心最为常见(全级别,分别为46.1%和34.3%)。治疗相关的致命性严重AE有四起(即心脏骤停、肝炎、机化性肺炎、肺炎)。作者在其结论中指出,这些最新的结果进一步证实了METex14是NSCLC的可靶向致癌驱动因子,并强化了卡马替尼在这种情况下作为有价值的选择的证据。
特泊替尼(Tepotinib)用于带有MET扩增的患者
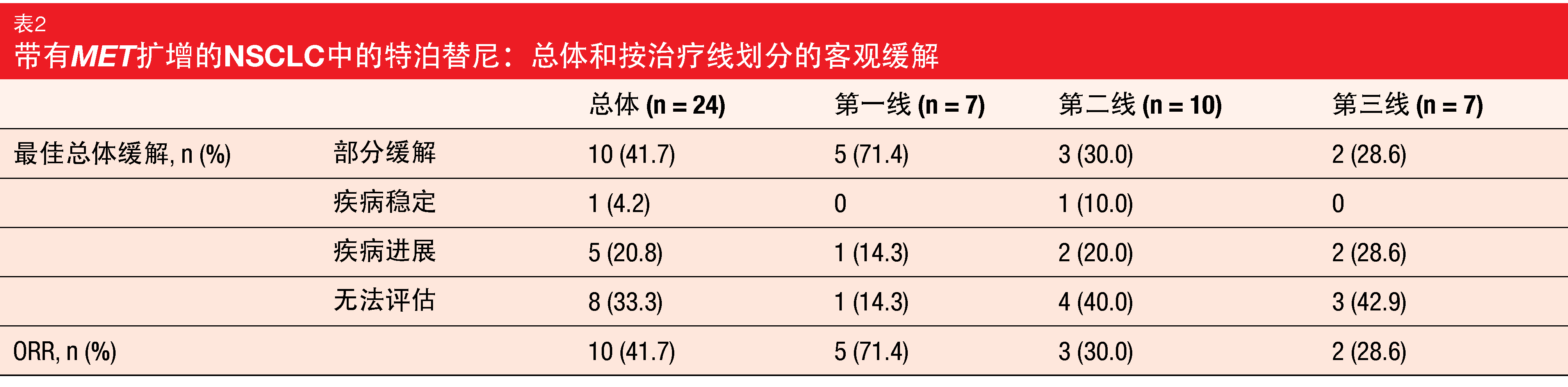
MET扩增在1-5%的NSCLC病例中作为致癌驱动因子存在[6],携带MET扩增的肺癌患者的预后较差[7]。该群体迫切需要新的治疗方法。根据开放标签、多中心、II期VISION试验的队列A,高选择性、口服、每日一次的MET抑制剂特泊替尼已在日本和美国被批准用于治疗带有METex14的转移性NSCLC [8, 9]。在ASCO 2021上,Le等人报告了队列B的首次数据,该队列在没有METex14的情况下评估了患有晚期NSCLC且带有MET扩增(通过液体活检检测)的患者中的特泊替尼[10]。入组队列B的患者带有野生型EGFR和ALK,并接受一线、二线或三线治疗。允许先前使用免疫疗法。总体而言,24人接受了500 mg/d特泊替尼,主要在二线治疗中施用。独立审查委员会将ORR定义为主要终点。
在通过液体活检前瞻性地检测到MET扩增的晚期NSCLC中对MET抑制剂的首次研究中,特泊替尼显示出具有临床意义的高活性。总体而言,41.7%的患者对治疗有反应。在一线接受特泊替尼的患者似乎对疗法更敏感。经亚组分析,一线、二线和三线的缓解率分别为71.4%、30.0%和28.6%(表2)。在总群体中,中位PFS为4.2个月,9个月PFS率为40%。一线、二线和三线的9个月PFS率分别为51%、58%和无法评估。中位缓解持续时间仍不成熟;在9个月时,67%的患者有持续的缓解。
特泊替尼的耐受性良好,主要发生轻度或中度的治疗相关AE。外周水肿是最常见的AE(全级别,37.5%),其次是全身水肿和便秘。3/4级的治疗相关AE的发生率为29.2%,但并未导致治疗中断。据作者称,需要在带有MET扩增的晚期NSCLC患者中进一步评估特泊替尼。
ROS1阳性NSCLC:布加替尼(brigatinib)的活性
克唑替尼是首个被批准用于治疗ROS1融合阳性NSCLC患者的药物。然而迄今为止,针对克唑替尼耐药的ROS1阳性疾病尚无标准选择。单组、多中心、II期篮式试验Barossa在ROS1融合阳性的晚期实体瘤中评估了第二代ALK/ROS1抑制剂布加替尼。Daga等人报告了该研究的队列2的结果,该队列包括来自9个机构的19名经克唑替尼预先治疗的NSCLC患者。ORR被定义为主要终点[11]。
在该组中,布加替尼显示出中等活性,ORR为26.3%,疾病控制率为57.9%。通过独立审查评估的中位PFS和OS分别为7.3和12.2个月。1年时,57.4%的患者存活,其中26.9%无进展。布加替尼的安全特性包括腹泻、转氨酶升高和淀粉酶升高,与之前的研究一致。没有发生4/5级AE。Barossa研究的队列1的招募正在进行中,该队列包含未使用ROS1抑制剂的患者。
HER2靶向方法外加多西他赛
AHER2畸变是1-2%的病例中的致癌驱动因子,尚无批准用于带有HER2畸变的NSCLC患者的疗法[12]。Mazieres等人介绍的多中心、单组、II期IFCT-1703 R2D2试验的目标是在这种情况下前瞻性地评估两种HER2定向抗体与多西他赛的组合[13]。46名患有III/IV期NSCLC且带有HER2外显子20插入或突变的经预先治疗患者从第2周期起每3周接受420 mg帕妥珠单抗(pertuzumab)外加6 mg/kg曲妥珠单抗(trastuzumab)和75 mg/m2多西他赛。
该方案的确认的ORR(定义为主要终点)为28.9%。疾病稳定者占57.8%。中位PFS和OS分别为6.8和17.6个月,12个月的PFS和OS率分别为29.0%和68.3%。治疗相关AE主要包括腹泻、疲劳、贫血、恶心、口腔炎和中性粒细胞计数减少。在3/4级AE中,中性粒细胞计数减少最常见,其次是腹泻。未观察到肺或心脏毒性。
如作者所总结的,曲妥珠单抗、帕妥珠单抗和多西他赛的三联疗法在经预先治疗的晚期HER2阳性NSCLC中是可行且有效的。这些结果证实了应在这些患者中予以考虑的基于HER2抗体的策略的活性。
参考文献
- Biernacka A et al., The potential utility of re-mining results of somatic mutation testing: KRAS status in lung adenocarcinoma. Cancer Genet 2016; 209(5): 195-198
- Li BT et al., CodeBreaK 100: registrational phase 2 trial of sotorasib in KRAS p.G12C mutated non-small cell lung cancer. WCLC 2020, PS01.07
- Skoulidis F et al., Overall survival and exploratory subgroup analyses from the phase 2 CodeBreaK100 trial evaluating sotorasib in pretreated KRAS P.G12C mutated non-small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9003)
- Wolf J et al., Capmatinib in MET exon 14-mutated or MET-amplified non-small-cell lung cancer. N Engl J Med 2020; 383(10): 944-957
- Wolf J et al., Capmatinib in MET exon 14-mutated, advanced NSCLC: updated results from the GEOMETRY mono-1 study. J Clin Oncol 39, 2021 (suppl 15; abstr 9020)
- Drilon A et al., Targeting MET in lung cancer: will expectations finally be MET? J Thorac Oncol 2017; 12(1):15-26
- Dimou A et al., MET gene copy number predicts worse overall survival in patients with non-small cell lung cancer (NSCLC); a systematic review and meta-analysis. PLos One 2014; 9(9): e107677
- Paik PK et al., Tepotinib in non-small-cell lung cancer with MET exon 14 skipping mutations. N Engl J Med 2020; 383(10): 931-943
- Paik PK et al., Tepotinib in patients with MET exon 14 (METex14) skipping advanced NSCLC: updated efficacy from VISION Cohort A. J Thorac Oncol 2021; 16(3S): S174 (MA11.05)
- Le X et al., Tepotinib in patients with advanced non-small cell lung cancer with MET amplification. J Clin Oncol 39, 2021 (suppl 15; abstr 9021)
- Daga H et al., Phase II study of brigatinib in ROS1-positive non-small cell lung cancer patients previously treated with crizotinib: Barossa cohort 2. J Clin Oncol 39, 2021 (suppl 15; abstr 9040)
- Mazières J et al., Lung cancer patients with HER2 mutations treated with chemotherapy and HER2-targeted drugs: results from the European EUHER2 cohort. Ann Oncol 2016; 27(2): P281-286
- Mazières J et al., Combination of trastuzumab, pertuzumab and docetaxel in patients with advanced non-small cell lung cancer harboring HER2 mutation. Results from the IFCT-1703 R2D2 trial. J Clin Oncol 39, 2021 (suppl 15; abstr 9015)
© 2021 Springer-Verlag GmbH, Impressum