来自B细胞恶性肿瘤靶向治疗早期临床试验的见解
DTRM-555: 固定剂量的组合
Richter转化(RT)描述了CLL/SLL向弥漫性大B细胞淋巴瘤(DLBCL)或霍奇金淋巴瘤的转化,是一种发生在大约5-7 %的CLL病例中的罕见事件[1]。但是,缺乏明确的护理标准,一旦用利妥昔单抗加化疗难以治疗,患者的结果通常很差。一种新的策略是合成致死方法,该方法描述了同时抑制导致细胞死亡的多种途径。主要异常途径和补偿途径均被抑制。
使用独立的迭代筛选和优化过程进行的分析被用于评估基于DTRM-12的靶向药物的组合,DTRM-12是一种新型共价的选择性BTK抑制剂,被专门设计用作联合疗法的骨架[2]。在体外和体内筛选后,选择最佳候选三联体用于临床试验。临床前研究表明,同时进行BTK抑制、mTOR抑制和低剂量免疫调节剂的使用可以协同杀死恶性B细胞。DTRM-555方案设计为每日一次口服三联体组合,该三联体组合由DTRM-12、mTOR抑制剂依维莫司(everolimus)和免疫调节剂泊马度胺(pomalidomide)组成。
进行了一项I期临床试验,以针对尚无标准疗法的B细胞非霍奇金淋巴瘤(NHL)或CLL患者测试该构思。在试验的第1阶段,DTRM-12剂量在50至300 mg/d之间逐步提高。第2阶段专门用于测试递增剂量的DTRM-12加 5 mg/d依维莫司。最后,在第3阶段中,在28天中的21天中,检查了递增剂量的DTRM-12加5 mg/d依维莫司和2 mg/d泊马度胺的组合。II期的最终目标是产出单一的固定剂量组合片剂。
RT和DLBCL中的可行方案
在ASH 2020上,Mato等人介绍了在I期中招募的确诊为RT(n=13)或原发DLBCL(n=11)的患者的数据[2]。所有患者均采用抗CD20抗体进行预先治疗,并且所有DLBCL患者均接受RCHOP,RT患者中有69 %接受RCHOP治疗。在进入研究之前,BTK抑制剂和Bcl-2抑制剂维奈托克也在大量患者中使用。
200 mg/d DTRM-12、5 mg/d依维莫司和2 mg/d泊马度胺确定为DTRM-555方案的II期推荐剂量。这种组合具有可接受的安全特性,意味着达到了研究的主要终点。主要的安全性结果是可预期且可控的。大多数情况下,发生血液学不良事件,其中3/4级嗜中性粒细胞减少和3/4级血小板减少症的发生率分别为54%和37%。没有患者因AE而终止联合疗法。药代动力学分析表明,DTRM-12的血浆浓度呈线性并且依维莫司和泊马度胺的联用不会对其造成影响。药代动力学数据支持每日一次DTRM-12给药,估计的半衰期为5–9小时。
RT和DLBCL患者的最佳总体缓解率分别为46 %和45 %。在RT群体中,分别有1名和4名患者获得CR和PR。对于DLBCL组,该数据分别为2个和3个个体。总体而言,最大淋巴结直径乘积之和减少了43 %(图)。即使进行了10次先前治疗线的患者,也能经历持久的缓解。总体而言,三联固定剂量组合片剂DTRM-555在高风险、经大量先前治疗的RT/DLBCL群体中显示出令人鼓舞的临床活性。该片剂目前处于开发的最后阶段。每日口服一次便于患者安排治疗,因此可能会提高对治疗的依从性。
图: 在患有Richter转化或原发DLBCL的患者中,用DTRM-555治疗观察到的淋巴结缓解的深度
在依鲁替尼/阿卡替尼后使用泽布替尼的安全性
一项多中心、单组、开放标签的II期研究在60名先前治疗过B细胞恶性肿瘤但由于AE而停用依鲁替尼和/或阿卡替尼的患者中评估了新一代BTK抑制剂泽布替尼[3]。对于这两种药物,耐受性问题是治疗中断的常见原因[4, 5]。主要目的是与依鲁替尼和/或阿卡替尼不耐受性AE特性进行比较,评估泽布替尼的安全性。由于选择性提高,因此泽布替尼被认为具有更高的耐受性,会降低BTK抑制剂引发的AE的复发率和严重性。该群体包括25名CLL/SLL患者,2名套细胞淋巴瘤(MCL)患者和5名华氏巨球蛋白血症(WM)患者。
据分析,泽布替尼是可耐受且有效的。对于依鲁替尼和/或阿卡替尼而经历的不可忍受AE不太可能在使用泽布替尼时复发;88 %的依鲁替尼不耐受事件和50 %的阿卡替尼不耐受事件未发现复发。在确实复发的事件中,88 %的依鲁替尼事件和50 %的阿卡替尼事件显示出更低的严重性。泽布替尼没有发生4级不耐受事件。在25个3级事件中,只有2个重复发生。没有观察到严重AE,也没有患者因不良事件而中断治疗。
与先前的BTK抑制剂治疗相比,泽布替尼维持缓解(44.4 %)或改善缓解(50 %)。在3.5个月的中位随访中,仍有96.9 %的患者仍在研究中。正如作者指出的,这些数据表明泽布替尼可能为不耐受其他BTK抑制剂的患者提供治疗选择。
LOXO-305: MCL中的持久缓解
在参与I/II期BRUIN研究的323名CLL/SLL、MCL、WM和其他NHL患者中评估了高效且选择性的非共价BTK抑制剂LOXO-305。在ASH 2020中,Wang等人介绍了61名MCL患者,26名WM患者和66名其他NHL患者的疗效结果,以及所有323名患者的安全性结果[6]。
在疗效群体中,所有患者均接受了先前治疗。对于患有MCL、WM和其他NHL的患者,先前全身疗法的中位数为3、3和4。先前的治疗包括所有可用的疗法类别,包括BTK抑制、化学疗法、抗CD20抗体、CAR-T细胞疗法和干细胞移植。在67-79 %的病例中,疾病进展是终止BTK抑制剂先前治疗的原因。
在25至300 mg/d的剂量范围内进行药代动力学分析。在此,LOXO-305的血浆暴露显示为是剂量依赖性且线性的。在剂量≥100 mg/d的整个给药间隔中,它们超过了BTK IC90。LOXO-305表现出良好的安全特性,与其作为高选择性非共价BTK抑制剂的设计相一致。没有报告剂量限制性毒性,也没有确定最大耐受剂量。选择LOXO-305 200 mg/d作为推荐的II期剂量。特别令人关注的AE,例如淤血、皮疹、关节痛和出血的发生率低。在323名患者中,只有5名(1.5 %)由于治疗相关AE停用了LOXO-305。
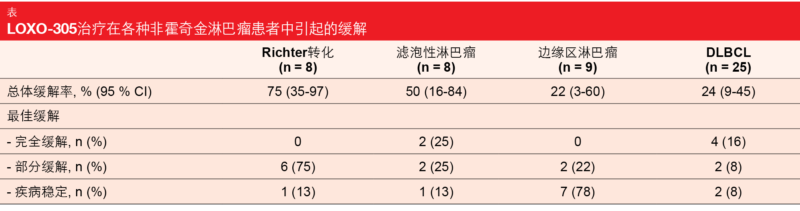
LOXO-305表现出与先前疗法无关的有希望的疗效。MCL和WM患者的ORR分别为52 %和68 %。在具有其他NHL的组中,ORR的范围为边缘区淋巴瘤的22 %到Richter转化的75 % (表)。值得注意的是,LOXO-305在接受过BTK先前治疗的MCL患者中产生了持久的缓解,这些患者在接受共价BTK抑制剂(如依鲁替尼)而 进展后通常结果较差[7, 8]。经BTK先前治疗的MCL患者中有25 %完全缓解,并且有83 %的缓解者在6个月时仍有应答并接受治疗。总体而言,分析表明,LOXO-305具有良好的耐受性,并且在接受大量先前治疗的各种NHL患者中显示出有希望的疗效。需要更长的随访时间才能更好地了解与长期给药相关的安全特性。
TG-1701作为单一药物以及与U2联合
另一个研究中的新一代BTK抑制剂是TG-1701,它是每日一次的共价结合剂。与依鲁替尼相比,它具有更好的选择性[9]。TG-1701与PI3Kδ/CK-1ε双重抑制剂umbralisib和糖工程化抗CD20抗体ublituximab的三联组合在对BTK耐药的异种移植模型中显示出对肿瘤生长的抑制[10]。Cheah等人报告了TG-1701单药治疗以及与umbralisib和ublituximab(U2)联合用于需要进行全身性治疗的B细胞淋巴瘤或CLL患者的I期研究结果[11]。在单药治疗队列(n=25;100–400 mg/d)和联合治疗队列(n=16;100–300 mg/d)中进行了平行剂量递增。针对CLL(n=20), MCL(n=21)和WM(n=20)的患者,疾病特定队列在200 mg和300 mg的单药TG-1701下扩展。剂量递增阶段中的所有患者均已复发并患有难治性疾病,而每个疾病特定队列中均有几位患者未接受治疗。
安全特性总体上良好,并且没有患者因AE而中断治疗。对于TG-1701单药治疗和三联疗法,少见≥3级AE。关于疗效,100-400 mg剂量的单药治疗可使ORR达到52 %。在用TG-1701 200 mg治疗的疾病特定队列中,CLL、MCL和WM患者的ORR分别为95 %、50 %和95 %。对于由TG-1701和U2组成的剂量递增三联组合,ORR为79 %,包括22 %的完全缓解。在分析时,大多数患者仍在研究中。
总体而言,TG-1701表现出令人鼓舞的安全特性,在支持每日一次给药的所有评估剂量水平上均具有临床和药效学活性。单药治疗组未达到最大耐受剂量。而且,与U2的组合耐受良好,并且剂量递增正在继续。联合治疗显示令人鼓舞的临床活性,包括早期完全缓解。这项研究正继续招募,并且正在计划将来的注册试验。
参考文献
- Tsimberidou AM, Keating MJ, Richter syndrome: biology, incidence, and therapeutic strategies. Cancer 2005; 103(2): 216-228
- Mato AR et al., A once daily, oral, triple combination of BTK inhibitor, mTOR inhibitor and IMID for treatment of relapsed/refractory Richter’s transformation and de novo diffuse large B-cell lymphoma. ASH 2020, abstract 126
- Shadman M et al., Phase 2 study of zanubrutinib in patients with previously treated B-cell malignancies intolerance to ibrutinib/acalabrutinib. ASH 2020, abstract 2947
- Mato AR et al., Toxicities and outcomes of 616 ibrutinib-treated patients in the United States: a real-world analysis. Haematologica 2018; 103(5): 874-879
- Yazdy MS et al., Toxicities and outcomes of acalabrutinib-treated patients with chronic lymphocytic leukemia: a retrospective analysis of real world patients. Blood 2019; 134(Supplement_1): 4311
- Wang ML et al., LOXO-305, a next generation, highly selective, non-covalent BTK inhibitor in previously treated mantle cell lymphoma, Waldenström’s macroglobulinemia, and other Non-Hodgkin lymphomas: results from the phase 1/2 BRUIN study. ASH 2020, abstract 117
- Cheah CY et al., Patients with mantle cell lymphoma failing ibrutinib are unlikely to respond to salvage chemotherapy and have poor outcomes. Ann Oncol 2015; 26: 1175-1179
- Martin P et al., Post ibrutinib outcomes in patients with mantle cell lymphoma. Blood 2016; 127: 1559-1563
- Normant E et al., TG-1701, a novel, orally available, and covalently bound BTK inhibitor. EHA 2018, abstract PF638
- Ribeiro ML et al., TG-1701, a novel irreversible Bruton’s kinase inhibitor, cooperates with ublituximab-driven ADCC and ADCP in in vitro and in vivo models of ibrutinib-resistant mantle cell lymphoma. AACR 2020, abstract 2205
- Cheah CY et al., Clinical activity of TG-1701, as monotherapy and in combination with ublituximab and umbralisib, in patients with B-cell malignancies. ASH 2020, abstract 1130
© 2020 Springer-Verlag GmbH, Impressum