CLL患者管理:BTK抑制及其他
BTK抑制剂、Bcl-2抑制剂维奈托克(venetoclax)和诸如阿托珠单抗(obinutuzumab)等抗CD20抗体已大大改变了慢性淋巴细胞性白血病(CLL)/小淋巴细胞性淋巴瘤(SLL)的治疗前景。依鲁替尼,作为BTK抑制剂类的第一代代表,是主要治疗手段,但其明显的缺点导致引入了第二代药物。阿卡替尼(acalabrutinib)已在美国和欧洲获得批准用于治疗CLL患者,而泽布替尼则在2020年在中国被批准用于该适应症。基于BTK抑制剂的双联体和三联体正在临床试验中进行评估,尤其是为了达到无法检测到的最小残留疾病,从而可以进行固定时长的治疗和治疗中止。同时,正在临床中测试新药,例如奥布替尼(orelabrutinib)和LOXO-305。关于PI3Kδ抑制选择的扩展和新型抗CD20抗体的开发也正在取得进展。
基于依鲁替尼的疗法
CAPTIVATE:依鲁替尼加维奈托克
迄今为止,依鲁替尼作为随机化III期研究中纳入的CLL患者的一线治疗是唯一证明具有显著OS获益的靶向疗法[1, 2]。国际II期CAPTIVATE试验评估了一线条件下12个周期的依鲁替尼加维奈托克,以探索在1年固定治疗时长期间是否可以实现深度缓解从而达到治疗中止的问题。在ASH 2020中,Wierda等人介绍了最小残留疾病(MRD)队列的初步分析[3]。在该队列(n=149)中,在仅用依鲁替尼先导治疗3个月后,用依鲁替尼加维奈托克治疗12个周期,然后根据MRD状态进行随机分组。确认为未检出MRD(uMRD)的患者以双盲方式接受安慰剂或依鲁替尼,而未确认uMRD的患者进行开放标签随机分组至接受依鲁替尼或依鲁替尼加维奈托克。主要终点为被随机分配为接受安慰剂与依鲁替尼的确认uMRD的患者的1年无病生存 (DFS)。
在12个周期的依鲁替尼和维奈托克治疗后,MRD队列中有58 %的患者在外周血和骨髓中达到了确 uMRD。在该组中,在随机分组后16.6个月的中位随访后,安慰剂和依鲁替尼的1年DFS率无显著差异(依鲁替尼和安慰剂分别为100 %与95.3 %;p=0.1475)。据作者称,安慰剂组中95 %的比率支持固定时长的治疗方法以及在获得确认uMRD的患者中停药。该研究的总体中位随访时间为31.3个月。在30个月时,所有四个随机组的PFS率均>95 %。这优于其他一线固定时长的方案,包括利妥昔单抗、氟达拉滨和环磷酰胺(3年PFS 73 %)[2]和维奈托克加阿托珠单抗(3年PFS,82 %)[4]。
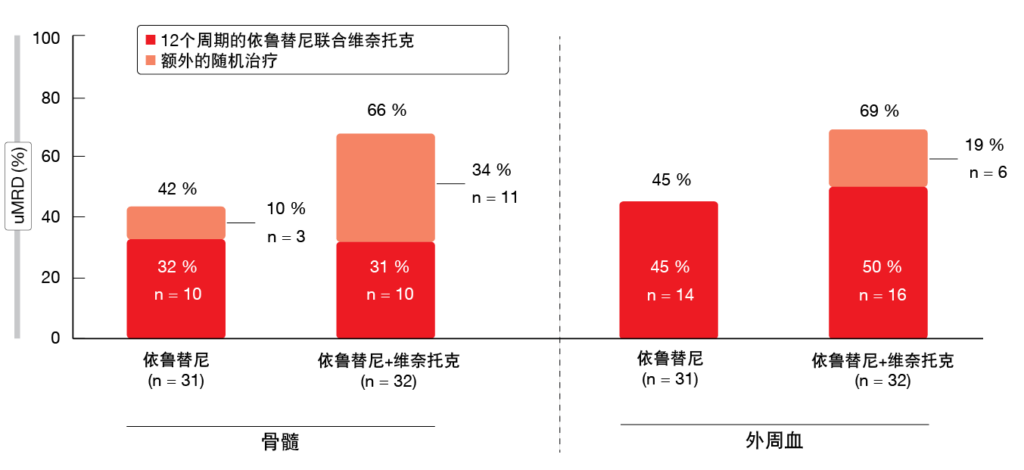
对于在12个周期的依鲁替尼加维奈托克结束时仍未达到确认uMRD的患者,与单药依鲁替尼相比,继续采用该组合时观察到MRD状态有所改善。在骨髓中,额外的随机治疗导致接受依鲁替尼加维奈托克斯的患者的uMRD升高34 %,而这在仅依鲁替尼治疗组中仅为10 %(图1)。外周血中的uMRD率在联合治疗组中增加了19 %,而单一治疗组则为增加0 %。在依鲁替尼加维奈托克治疗的前6个月后,无论随后的随机治疗方案如何,AE通常均会减轻。很少有患者需要调整剂量或停药。≥3级不良事件较为罕见。基于这些发现,作者得出结论,依鲁替尼加维奈托克斯是一种全口服、每日一次、无化疗的固定时长方案,可用于一线CLL在骨髓和血液中提供高度一致的深度MRD缓解。
图1: CAPTIVATE研究的未确认uMRD的群体中采用额外随机治疗对最佳总体uMRD率的提升
MRD指导的治疗强化
一项单组、II期研究纳入未曾使用BTK和Bcl-2抑制剂的复发/难治性(r/r)CLL患者,研究了将依鲁替尼添加到维奈托克中在MRD方面的疗效[5]。38名患者接受了维奈托克治疗12个月,并在当时评估了缓解和MRD状态。达到完全缓解(CR)/部分缓解(PR)和uMRD的患者停止治疗,而具有CR/PR和可检测到MRD的患者继续接受维奈托克治疗并加入依鲁替尼。定期评估MRD,并且一旦患者于外周血和骨髓中都达到uMRD,便停止治疗。在12个月的联合治疗期末具有可检测到MRD的患者继续接受单药依鲁替尼治疗。
这种顺序的MRD指导的方法被证明是可行的。在维奈托克单药治疗12个月后,有45 %的患者达到 uMRD。在其余患者中,有84 %的患者通过维奈托克加依鲁替尼达到uMRD。总体而言,无论是单药治疗还是联合治疗,在87 %患者中达到MRD。总体而言,95 %的患者缓解。在27个月的随访中,在uMRD后仅发生2次临床复发。作者指出,对维奈托克再治疗的应答仍有待确定;此外,还将对停药后持续MRD和早期MRD复发的患者的生物学特征进行研究。
阿托珠单抗、依鲁替尼和维奈托克
招募了初治(n=25)和r/r CLL(n=25) 患者的一项II期研究测试了固定时长的依鲁替尼、维奈托克和阿托珠单抗的三联疗法。阿托珠单抗在第1-8周期内给药,依鲁替尼在第2-14周期内给药,维奈托克在第3-14周期内给药。Rogers等人在2020年ASH大会上介绍了3年时的更新结果[6]。初治和r/r患者中具有uMRD的CR率(即主要终点)均为 28 %。在血液和骨髓中的uMRD分别占56 %和44 %。总体而言,84 %和88 %的患者获得PR、CR或具有不完全骨髓恢复的CR(CRi)。在36个月时,两组的PFS率均为95 %,初治和r/r患者的OS率分别为95 %和100 %。这些发现表明了使用三联疗法所达到缓解的持久性。r/r组发生了2例疾病进展,分别在24和36个月。
这意味着,用三药组合进行14个周期的限时治疗会带来连续的持久缓解。需要进行额外的随访以确定中位PFS和患者获益时长。目前正在两项III期合作组试验(NCT03701282和NCT03737981)中将依鲁替尼加维奈托克和阿托珠单抗与依鲁替尼加阿托珠单抗进行比较。
包含第二代BTK抑制剂的方案
阿卡替尼:ASCEND的最终结果
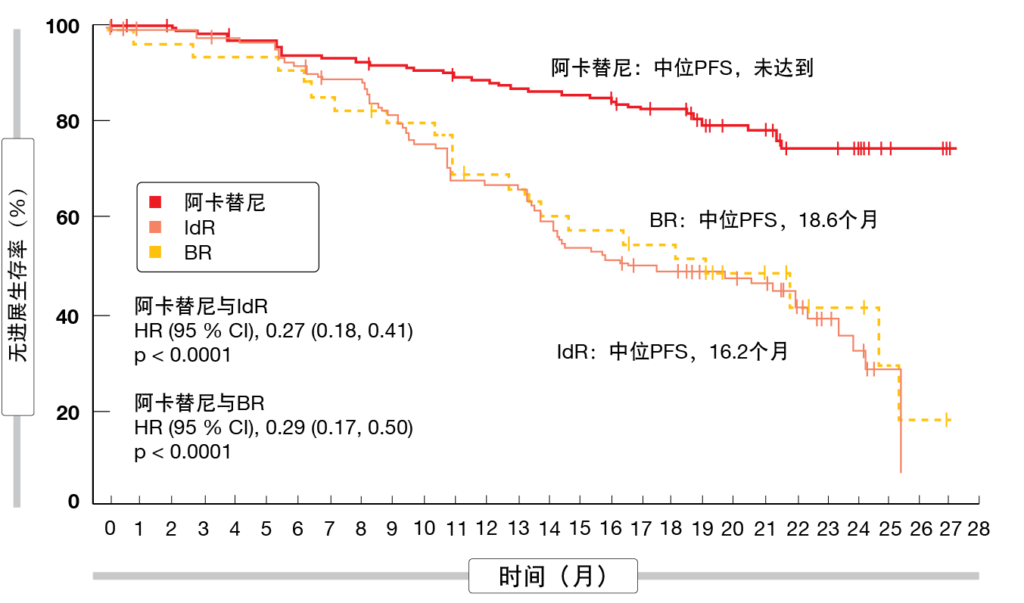
在ASH 2020上,Ghia等人报告了ASCEND试验的最终结果,该试验在r/r CLL患者中根据研究者的选择比较了第二代高选择性共价BTK抑制剂阿卡替尼(n=155)与艾代拉里斯(idelalisib)加利妥昔单抗(IdR;n=119)或苯达莫司汀(bendamustine)加利妥昔单抗(BR;n=36)[7]。在中位随访22个月后,结果强调了BTK抑制剂与标准照护方案相比具有良好的疗效和安全性。阿卡替尼尚未达到中位PFS,而IdR为16.2个月,BR为18.6个月(两个比较组均p <0.0001;图2)。在18个月时,阿卡替尼和IdR/BR的PFS率分别为82 %和48 %。在具有高风险遗传特征(包括缺失17p、TP53突变和未突变IGHV状态)的患者中也观察到PFS益处。所有治疗组均尚未达到中位OS。总体缓解率(ORR)没有差异(80 %与84 %),但使用阿卡替尼的中位缓解持续时间长于使用IdR/BR(未达到与18个月;HR,0.19)。在18个月时,缓解的患者为85.4 %与49.4 %。
阿卡替尼和BR均显示出比IdR更高的耐受性。与IdR相比,阿卡替尼和BR发生≥3级AE、治疗相关AE和导致停药或剂量延迟的AE的频率降低。正如作者总结的,这些数据支持阿卡替尼在r/r CLL患者(包括那些具有高风险特征的患者)中的使用。
图2: 阿卡替尼相比于苯达莫司汀/利妥昔单抗(BR)和艾代拉里斯/利妥昔单抗(IdR)更优的无进展生存率
三种阿卡替尼组合:Ib期
在Ib期ACE-CL-003研究中以各种组合测试了阿卡替尼。Woyach等人介绍了关于该试验的两个队列的数据,这两个队列为在r/r CLL患者中评估阿卡替尼加维奈托克和依鲁替尼(AVR)的队列3,和在初治条件下评估阿卡替尼加维奈托克和阿托珠单抗(AVO)的队列4 [8] 。每个队列包含12位患者。在安全性(即主要终点)方面,基于每个药物的安全特性,AE均符合预期。任一队列中均有一名患者因AE终止治疗。头痛、腹泻和恶心是所有等级中最常见的不良事件。大多数关注的不良事件包括感染、出血、嗜中性粒细胞减少和高血压。没有发生肿瘤溶解综合征(TLS)。
16个周期后,AVR和AVO的ORR分别为92 %和100 %。在数据截止时,每个队列中有一半的患者已达到CR或CRi。所有具有CR/CRi的患者在CR/CRi时或更早的时间在血液中达到了uMRD。在第10周期中,每个队列的12名患者中只有1名(8 %)在血液中保持MRD阳性。6个周期后,AVR队列中的所有患者均未出 MRD阳性,而AVO队列中的一名患者为MRD阳性。总体uMRD率为71 %(接受AVR和AVO治疗的患者分别为67 %和75 %)。两组均未达到中位缓解持续时间、PFS和OS。
作者得出结论认为,基于耐受性,使用阿卡替尼加抗CD20抗体和Bcl-2抑制剂的三联疗法是可行的,并且在r/r和初治的CLL患者中都产生较高的CR和uMRD率。
AVO在初治患者中的II期数据
目前正在II期试验中评估AVO作为一线CLL疗法。阿卡替尼给药15个周期,从第2至8周期给药阿托珠单抗,并且从第4至15周期给药维奈托克。如果在第15个周期后获得了具有uMRD的CR,则停用阿卡替尼和维奈托克,但可在MRD阳性后恢复。每3个月检查一次MRD状态。在15个周期后仍继续显示MRD阳性的CR和/或PR患者将接受二联方案另外8个周期。接下来是对缓解的重新评估和相同的分配,阿卡替尼和维奈托克持续给药直至在MRD阳性的情况下发生进展。疾病稳定或进展会促使患者退出研究。研究群体大多有高危疾病,其中很大比例的患者表现出未突变的IGHV状态,TP53突变和其他畸变。最新的研究方案修订限制了在新队列中额外招募患有TP53畸变疾病的患者。
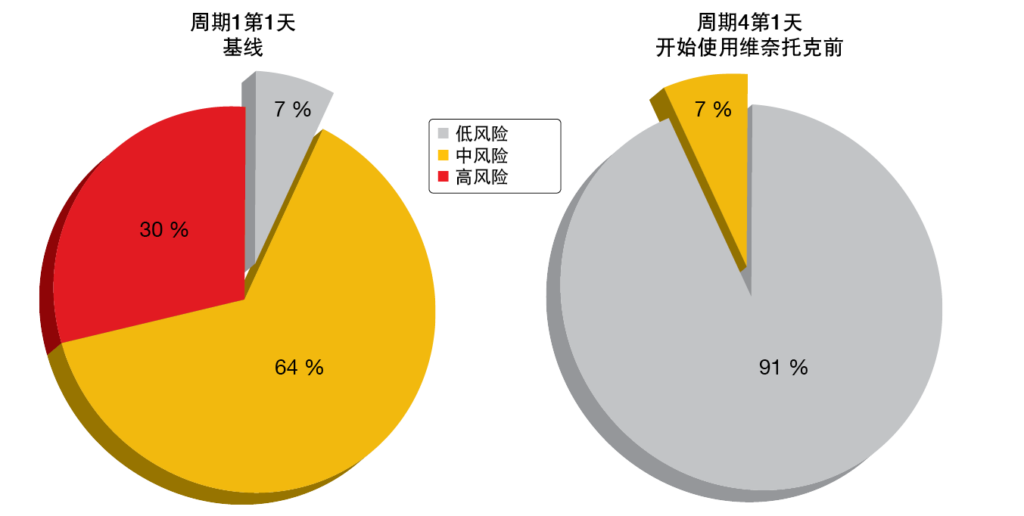
在ASH 2020上报告的更新分析显示,在整个队列中(n=44),经过15个周期的治疗,在骨髓和血液中产生的uMRD率分别为76.5 %和83.9 % [9]。在具有TP53畸变的患者(n=17)中分别为70 %和90 %。中位随访19个周期后,没有患者进展,或发展为复发性MRD。缓解的深度随着时间的推移而增加。在第16个周期时,总队列和TP53畸变患者的CR/CRi率分别为44 %和40 %。AVO显示出良好的安全特性,≥3级感染、房颤和输注相关反应的风险较低(各2%)。阿卡替尼和阿托珠单抗3个周期的导入有效降低了在开始使用维奈托克时的TLS风险 (图3)。没有观察到由于维奈托克的TLS事件。AVO与AV与化学免疫疗法的III期试验目前正在招募中(NCT03836261)。
图3: 基于阿卡替尼和阿托珠单抗的3周期导入的肿瘤溶解综合征风险降低
限时药物与连续性药物的荟萃分析
Molica等人进行了系统的文献综述和网络荟萃分析,以评估FDA和/或EMA批准的用于CLL前期治疗的靶向药物 (即依鲁替尼、阿卡替尼和维奈托克)的相对疗效和安全性[10]。具体地,基于以下试验,将限时的基于维奈托克的方案与连续的基于BTK抑制剂的疗法进行了比较:ILLUMINATE(依鲁替尼+阿托珠单抗;IO)、CLL14(维奈托克+阿托珠单抗;VO)和ELEVATE-TN(阿卡替尼单药和阿卡替尼+阿托珠单抗;AO)。有总计1,191人的数据可用。
PFS在限时(VO)与连续治疗(IO和阿卡替尼单药治疗)之间没有差异。但是,相对于接受IO和VO的群组,接受AO治疗的群组在PFS方面表现更好。专注于TP53畸变患者的亚组分析显示类似的结果,与使用的靶向药物无关。同样,在依鲁替尼、阿卡替尼和维奈托克治疗中,3-4级不良事件的发生率也没有显著 异。正在进行的研究将根据疗效、可用性、安全性、成本、治疗目标和患者选择,进一步划定CLL治疗中不同靶向疗法的位置以及给药时间表。
SEQUOIA: 缺失17p时的泽布替尼
携带缺失17p的CLL/SLL患者的预后不良,对标准化学免疫疗法的应答较差[11, 12]。已显示BTK和Bcl-2抑制剂可改善具有缺失17p患者的预后[13, 14]。但是,第一代BTK抑制剂依鲁替尼在该群体中显示出有限的疗效。在ASH 2020上介绍的实际数据强化了该证据,表明与无缺失17p的患者相比,在缺失17p阳性患者中使用一线依鲁替尼的生存期较差,这反映了对更有效疗法的持续需求[15]。
全球、III期、开放标签、随机化的SEQUOIA研究旨在评估第二代BTK抑制剂泽布替尼在有或没有缺失17p的CLL/SLL患者中的一线使用。泽布替尼被设计成最大程度地提高BTK的占据,并最大程度地降低TEC和EGFR家族激酶的脱靶抑制作用[16, 17]。SEQUOIA试验的C组中包括的患者具有缺失17p,并接受了泽布替尼单药治疗。Brown等人介绍了在中位随访22个月后,该组的更新结果[18]。在109名招募的患者中,有95名在分析时仍在接受研究治疗。单药泽布替尼的ORR为94.5 %,CR/Cri率为6.4 %,高于一年前估计的1.9 %的初始CR/CRi率[19]。近88 %的患者在至少18个月内显示出持续的缓解。18个月时的PFS和OS率分别为90.6 %和95.4 %。通过IGHV突变和核型状态分析了PFS。通过有限的随访,在IGHV未突变与突变的患者之间以及复杂与非复杂核型患者之间的发现似乎相似。泽布替尼单药治疗的耐受性通常与先前报告的各种B细胞恶性肿瘤患者的观察结果一致[17, 20-22]。
基于在C组中获得的令人鼓舞的结果,SEQUOIA研究的D组被设计为评估泽布替尼加维奈托克 [23]。目前,正在全球8个国家招募患者,计划招募约50人。泽布替尼单药治疗3个月后,加入维奈托克持续12-24个周期。每3个月定期进行一次重新分期和MRD测量。在血液和骨髓中达到确认uMRD的患者分别至少经过27和12个周期的治疗后才能中止泽布替尼和维奈托克治疗。
泽布替尼、阿托珠单抗和维奈托克:BOVen
依鲁替尼加维奈托克二联以及与阿托珠单抗三联很有效,但与特征性毒性有关。BOVen研究是基于以下假设进行的,即使用泽布替尼、阿托珠单抗和维奈托克的一线治疗(BOVen)将实现频繁的uMRD,而MRD驱动的治疗中止将使治疗持久耐受[24]。在用泽布替尼和阿托珠单抗进行2个月的导入后,在第3周期中引入维奈托克。患者完成了8个周期的阿托珠单抗和6个周期的三联组合。此后,通过预先指定的MRD终点确定管理方案,最小和最大治疗时长分别为8个月和24个月。如果根据流式细胞术出现uMRD(<10-4),则患者将再接受2个周期。如果在下次血液MRD测试时仍确认uMRD,则患者中止治疗,并在进展时可选择再次治疗。在血液和骨髓中确认uMRD的频率是主要结果。
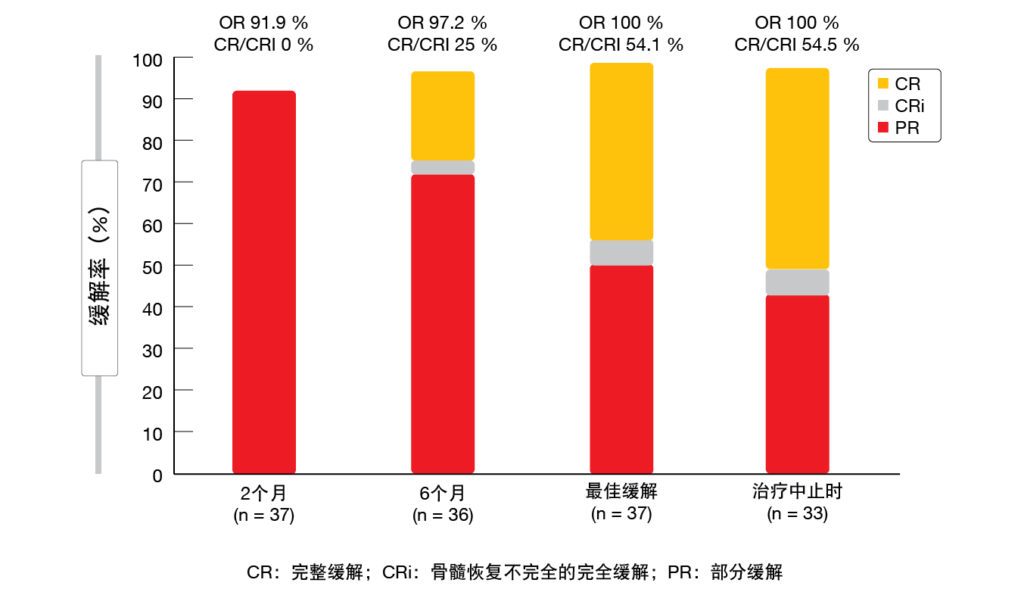
在37名可评估的患者中,有89.2 %在血液和骨髓中均达到uMRD,在中位10个月后中止治疗。所有患者均缓解,在停药时达到CR/CRi的比例为54.5 %(图4)。BOVen的耐受性良好;仅有少数≥3级治疗紧急AE发生。在通过流式细胞术确认在外周血中实现uMRD的34名患者中,有97 %的患者根据免疫测序的截止值< 10-5实现了uMRD。在开始BOVen三联治疗后的6个周期内,≥ 400倍降低的快速清除可以很好地预测uMRD,因此可以确定一个有利的患者群组。
图4: 在BOVen研究中观察到的根据iwCLL标准的缓解率
泽布替尼的早期使用与晚期使用
来自探索泽布替尼单药治疗CLL/SLL患者的两项I期研究(NCT02343120和NCT03189524)和一项II期研究(NCT03206918)的汇总数据显示,在早期治疗线中使用该药物可获得更好的疗效[25]。初治患者的ORR显著高于复发/难治性疾病的患者(100 %与90.6 %;p < 0.001),中位PFS的数值更长(HR,0.32;p=0.14)。对于OS,比较显示没有差异。一般而言,初治患者显示出比r/r CLL患者更好的经暴露调整的安全特性,特别是对于特别关注的AE,例如腹泻、高血压和心房颤动/扑动。
另一项在经1个先前治疗线的患者与经≥2个先前治疗线的患者之间的比较得出的结果相似。在此,早期治疗线中的ORR的数值更高(97 %与88.3 %; p=0.05),且中位PFS明显更长(HR,0.13;p < 0.001)。24个月的PFS率分别为95 %和75.3 %。同样,OS没有差异。两组的经暴露调整的安全特性总体相似,但仅经1个治疗线的患者表现出特别关注AE的发生率较低。
新兴BTK抑制剂
奥布替尼的可靠结果
正在进行的多中心、开放标签、单组、II期ICP-CL-00103研究正在80名r/r CLL患者中评估新型、高度选择性、不可逆的BTK抑制剂奥布替尼。根据Xu等人在2020年ASH大会上提供的更新信息,结果证实了奥布替尼的疗效[26]。中位随访时间为14.3个月,根据独立评审的ORR为91.3 %,获得的CR/CRi率为10 %。疾病控制率为95 %。随着时间的流逝,CR率显著增加。同样,在细胞遗传学高危亚组中也出现了很高的ORR(缺失17p,100 %;TP53突变,100 %;缺失11q,94.7 %; IGHV未突变,93.9 %)。
截止数据时,中位PFS和中位缓解持续时间均未达到。在12个月时,PFS率为81.1 %,有77.1 %的患者缓解。奥布替尼表现出了强大的安全特性,并且被发现具有良好的耐受性,且脱靶副作用率低。嗜中性粒细胞减少、血小板减少和上呼吸道感染最常见。没有关于房颤/扑动和≥3级高血压的事件的报告。1例发生≥3级腹泻,2例见大出血。
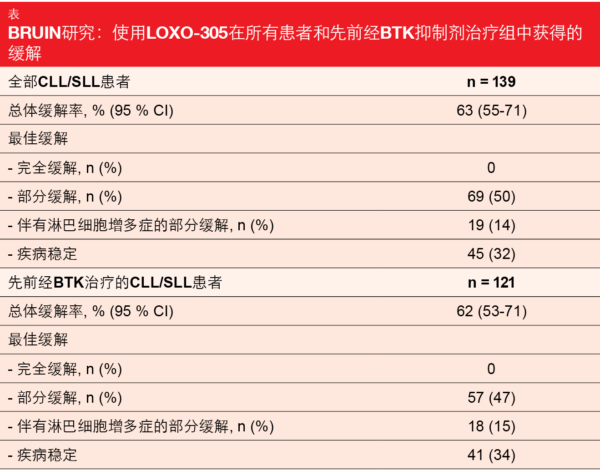
LOXO-305: BRUIN
I/II BRUIN期研究证明了新型非共价BTK抑制剂LOXO-305在以前接受过各种类型可用疗法治疗的CLL/SLL患者中的疗效令人鼓舞[27]。BRUIN包括170名先前接受过1到11种全身治疗的患者。86 %的患者接受过BTK抑制,其中疾病进展是停药的最常见原因 (67 %)。高风险分子特征存在于相当比例的患者中。
LOXO-305的安全性和耐受性良好,并且与该药物作为高度选择性和非共价BTK抑制剂的设计相一致。没有发生剂量限制的毒性反应,仅1.5 %的患者因治疗相关的AE而停用LOXO-305。 选择200 mg的日剂量作为推荐的II期剂量。
不论是否存在BTK先前治疗、是否使用其他现有药物、停止BTK抑制的原因如何(即进展与不耐受)以及是否存在BTK C481突变状态,LOXO-305均显示出疗效。在总群体和BTK先前治疗组中,ORR分别为63 %和62 % (表)。中位随访6个月后,缓解随着时间的推移而增加,并且94 %的缓解者仍然继续缓解。尚未达到中位PFS。
靶向PI3Kδ和CD20的新型药物
UNITY-CLL
由于并非所有患者都是BTK和Bcl-2抑制剂的理想候选者,因此评估了其他药物,例如具有不同作用机制的磷脂酰肌醇-3-激酶-δ(PI3Kδ)抑制剂。但是,在初治CLL患者中对前几代PI3Kδ抑制剂的研究显示了相当大的毒性[28,29]。Umbralisib是PI3Kδ和酪蛋白激酶1ε的口服双重抑制剂,对PI3Kδ亚型表现出更高的选择性,并具有较低的免疫介导毒性和由AE引起的停药[30,31]。Umbralisib与提供增强的抗体依赖性细胞毒性的新型抗CD20单克隆抗体ublituximab的组合在经过大量治疗的CLL患者中已显示出令人鼓舞的活性[32]。
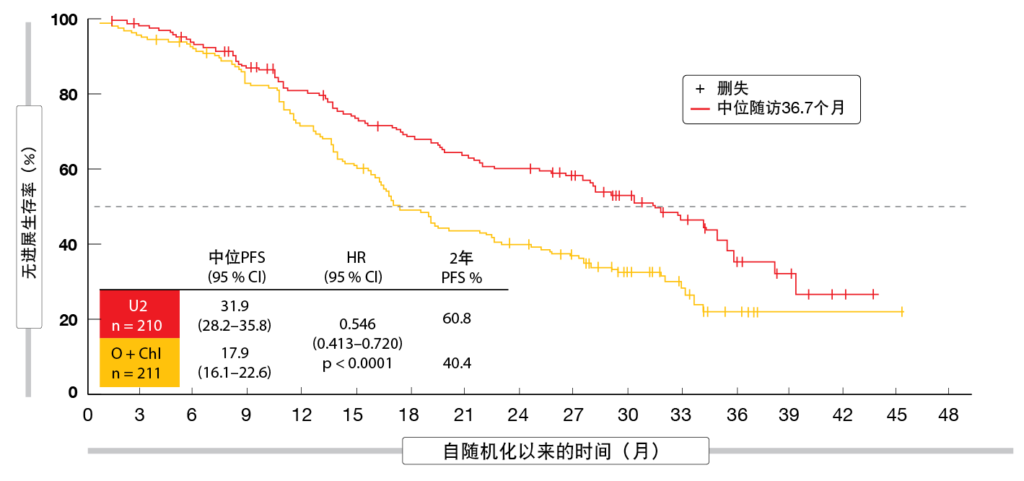
UNITY-CLL研究在初治或r/r CLL患者中将umbralisib加ublituximab(U2;n=210)与由阿托珠单抗和苯丁酸氮芥组成的化学免疫疗法(n=211)进行了比较[33]。根据独立评审委员会的PFS被定义为主要终点。在两组中,分别有57 %和43 %的患者未接受过治疗和接受过先前治疗。对于U2和阿托珠单抗加苯丁酸氮芥,先前治疗的中位数分别为2和1。
不分亚组的持久缓解
在主要终点方面,该新型组合在ITT群体中优于阿托珠单抗加苯丁酸氮芥,中位PFS为31.9与17.9个 (HR,0.546; p < 0.0001;图5)。在2年时,PFS率为60.8 %与40.4 %。与经先前治疗群体(19.5与12.9个月 HR,0.601; p < 0.01)相比,初治群体(38.5与26.1个月;HR,0.482;p <0.001)在两组中得到的PFS获益均更大,但对于这两组,方案之间的差异都较大。
此外,使用U2观察到的ORR超过了在对照组中取得的缓解率(83.3 %与68.7 %;p < 0.001);对于这部分CR/CRi患者也是如此(5 %与1 %)。在初治患者和先前接受过治疗的患者中,这种新方案的ORR均更佳。先前接受过BTK抑制的群体中,U2组中的患者表现地相对较好(ORR,57 %与25 %)。 而且,缓解是持久的,2年时仍有62 %的患者缓解。疾病控制率为93 %。采用新型组合时≥3级AE的发生率更高(82 %与66 %),这可能是由于中位暴露时间比对照组长4倍以上(21与5个月)引起的。在实验组中观察到的最常见AE包括腹泻、恶心和输注相关反应。在3/4级水平下,只有嗜中性粒细胞减少和腹泻发生率较高(分别为13 %和12 %)。初治群体比先前接受治疗的患者发生腹泻的频率更高,但嗜中性粒细胞减少的情况恰恰相反。
作者在结论中指出,UNITY-CLL是PI3Kδ抑制剂在初治CLL中的首个随机化试验,因此在该条件下确立了新的作用机制。非化学疗法的U2方案在CLL患者中非常有效,并且正在被探索作为包括与维奈托克和BTK抑制剂组合的三联疗法的基础。
图5: UNITY-CLL:与阿托珠单抗加苯丁酸氮芥相比,使用umbralisib加ublituximab的无进展生存率
先U2后维奈托克
基于观察到靶向PI3K可能会阻止对Bcl-2抑制的耐药性[34, 35],一项多中心、I/II期、剂量递增试验研究了U2与维奈托克的联合使用[36]。具有r/r CLL的患者接受固定剂量的ublituximab(900 mg)和两种剂量的umbralisib(600 mg和800 mg),持续3个周期(诱导/减灭期)。随后是巩固期,其中包括在5周的上升后以400 mg标准剂量的9个周期的维奈托克。对方案进行了修改,在第4、5和6个周期的第1天增加了ublixitumab输注,这与维奈托克治疗期相重叠。在总共12个周期的治疗期后,患者接受了全面的缓解评估,包括对其血液和骨髓进行MRD测试。uMRD的患者停止治疗,而MRD可检出的患者继续使用单药umbralisib治疗。分别评估了43名和39名患者的安全性和有效性。该试验的主要目的是U2诱导后增加维奈托克的安全性。
U2和维奈托克在II期剂量下表现出良好的耐受性。只有7 %的患者在第12周期之前中止了方案。而且,U2诱导期降低了TLS风险;在诱导期后,显示这种风险相对降低了81 %。在维奈托克上升期间,没有患者发展出临床或实验室TLS。该方案在包括那些先前对BTK抑制无效的患者(即占总群体的52 %)的患者队列中显示出令人鼓舞的疗效。所有患者均缓解,第12周期的CR率为41 %。那时,在血液和骨髓中分别检测不到MRD的比率为96 %和77 %。
迄今为止,只有1名患者在血液和骨髓中达到uMRD并停止治疗后10个月时发生进展。正在研究再治疗策略。在Richter转化和套细胞淋巴瘤的背景下进一步探索该方案。此外,一项评估U2加维奈托克的II期研究正在初治和r/r CLL患者中进行。
参考文献
- Burger JA et al., Long-term efficacy and safety of first-line ibrutinib treatment for patients with CLL/SLL: 5 years of follow-up from the phase 3 RESONATE-2 study. Leukemia 2020; 34(3): 787-798
- Shanafelt TD et al., Ibrutinib-rituximab or chemoimmunotherapy for chronic lymphocytic leukemia. N Engl J Med 2019; 381(1): 432-443
- Wierda WG et al., Ibrutinib plus venetoclax for first-line treatment of chronic lymphocytic leukemia/small lymphocyctic lymphoma: 1-year disease-free survival results from the MRD cohort of the phase 2 CAPTIVATE study. ASH 2020, abstract 123
- Al-Sawaf O et al., Venetoclax plus obinutuzumab versus chlorambucil plus obinutuzumab for previously untreated chronic lymphocytic leukaemia (CLL14): follow-up results from a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2020; 21(9): 1188-1200
- Scarfò L et al., Minimal residual disease-driven treatment intensification by sequential addition of ibrutinib to venetoclax in relapsed/refractory (r/r) chronic lymphocytic leukemia: results of the monotherapy and combination phases of the IMPROVE study. ASH 2020, abstract 2217
- Rogers KA et al., Three-year follow-up from a phase 2 study of combination obinutuzumab, ibrutinib, and venetoclax in chronic lymphocyctic leukemia. ASH 2020, abstract 1305
- Ghia P et al., Acalabrutinib vs idelalisib plus rituximab or bendamustine plus rituximab in relapsed/refractory chronic lymphocytic leukemia: ASCEND final results. ASH 2020, abstract 3140
- Woyach JA et al., Acalabrutinib in combination with venetoclax and obinutuzumab or rituximab in patients with treatment-naïve or relapsed/refractory chronic lymphocytic leukemia. ASH 2020, abstract 1312
- Davids MS et al., Updated safety and efficacy results from a phase 2 study of acalabrutinib, venetoclax and obinutuzumab (AVO) for frontline treatment of chronic lymphocytic leukemia (CLL). ASH 2020, abstract 2216
- Molica S et al., Comparison between time-limited, venetoclax-based and continuous Bruton tyrosine kinase inhibitor-based therapy in the upfront treatment of chronic lymphocytic leukemia (CLL): a systematic review. ASH 2020, abstract 3152
- Puiggros A et al., Genetic abnormalities in chronic lymphocytic leukemia: where we are and where we go. Biomed Res Int 2014; 2014: 435983
- Hallek M et al., Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet 2010; 376(9747): 1164-1174
- O’Brien S et al., Ibrutinib for patients with relapsed or refractory chronic lymphocytic leukaemia with 17p deletion (RESONATE-17): a phase 2, open-label, multicentre study. Lancet Oncol 2016; 17(10): 1409-1418
- Stilgenbauer S et al., Venetoclax for patients with chronic lymphocytic leukemia with 17p deletion: results from the full population of a phase II pivotal trial. J Clin Oncol 2018; 36(19): 1973-1980
- Mato A et al., A clinical practice comparison of patients with CLL/SLL with and without del(17p) receiving first-line treatment with ibrutinib. ASH 2020, abstract 2498
- Guo Y et al., Discovery of zanubrutinib (BGB-3111), a novel, potent, and selective covalent inhibitor of Bruton’s tyrosine kinase. J Med Chem 2019; 62(17): 7923-7940
- Tam CS et al., Phase 1 study of the selective BTK inhibitor zanubrutinib in B-cell malignancies and safety and efficacy evaluation in CLL. Blood 2019; 134(11): 851-859
- Brown JR et al., Efficacy and safety of zanubrutinib in patients with treatment-naïve chronic lymphocytic leukemia (CLL) or small lymphocytic lymphoma (SLL) with del(17p): follow-up results from Arm C of the SEQUOIA (BGB-3111-304) trial. ASH 2020, abstract 1306
- Tam CS et al., Efficacy and safety of zanubrutinib in patients with treatment-naïve chronic lymphocytic (CLL) or small lymphocytic lymphoma (SLL) with del(17p): initial results from Arm C of the SEQUOIA (BGB-3111-304) trial. Blood 2019; 134(Supplement_1): 499
- Tam CS et al., A randomized phase 3 trial of zanubrutinib vs ibrutinib in symptomatic Waldenström macroglobulinemia: the ASPEN study. Blood 2020; 136(18): 2038-2050
- Song Y et al., Treatment of patients with relapsed or refractory mantle-cell lymphoma with zanubrutinib, a selective inhibitor of Bruton’s tyrosine kinase. Clin Cancer Res 2020; 26(16): 4216-4224
- Tam CS et al., Pooled analysis of safety data from monotherapy studies of the Bruton tyrosine kinase (BTK) inhibitor, zanubrutinib (BGB-3111), in B-cell malignancies. EHA 2019; abstract: PS1159
- Tam CS et al., Zanubrutinib in combination with venetoclax for patients with treatment-naïve chronic lymphocytic leukemia or small lymphocytic lymphoma and del(17p): Arm D of the SEQUOIA (BGB-3111-304) trial. ASH 2020, abstract 1318
- Soumerai JD et al., MRD-driven time-limited therapy with zanubrutinib, obinutuzumab, and venetoclax (BOVen) in previously untreated chronic lymphocytic leukemia. ASH 2020, abstract 1307
- Xu W et al., Earlier use of zanubrutinib monotherapy in patients with chronic lymphocytic leukemia/small lymphocytic lymphoma associated with greater efficacy: a pooled analysis from 3 studies. ASH 2020, abstract 2229
- Xu W et al., Updates results from the phase II study of orelabrutinib monotherapy in Chinese patients with relapsed or refractory chronic lymphocytic leukemia/small cell lymphoma. ASH 2020, abstract 1320
- Mato AR et al., LOXO-305, a next generation, highly selective non-covalent BTK inhibitor in previously treated CLL/SLL: results from the phase 1/2 BRUIN study. ASH 2020, abstract 542
- Ghia P et al., Acalabrutinib versus idelalisib plus rituximab (IdR) or bendamustine plus rituximab (BR) in relapsed/refractory (R/R) chronic lymphocytic leukemia (CLL): ASCEND final results. Clin Lymphoma Myeloma Leukemia 2020; 20: S105-107 (abstract CLL-091)
- Lampson BL et al., Efficacy results of a phase 2 trial of first-line idelalisib plus ofatumumab in chronic lymphocytic leukemia. Blood Adv 2019; 3(7): 1167-1174
- Burris HA et al., Umbralisib, a novel PI3Kδ and casein kinase-1ε inhibitor, in relapsed or refractory chronic lymphocytic leukaemia and lymphoma: an open-label, phase 1, dose-escalation, first-in-human study. Lancet Oncol 2018; 19(4): 486-496
- Davids MS et al., An integrated safety analysis of the next generation PI3Kδ inhibitor umbralisib (TGR-1202) in patients with relapsed/refractory lymphoid malignancies. Blood 2017: 130(Suppl 1): 4037-4037
- Lunning M et al., Ublituximab and umbralisib in relapsed/refractory B-cell non-Hodgkin lymphoma and chronic lymphocytic leukemia. Blood 2019; 134(21): 1811-1820
- Gribben JG et al., Phase 3 study of umbralisib combined with ublituximab vs obinutuzumab plus chlorambucil in patients with chronic lymphocyctic leukemia: results from UNITY-CLL. ASH 2020, abstract 543
- Cervantes-Gomez F et al., Pharmacological and protein profiling suggests venetoclax (ABT-199) as optimal partner with ibrutinib in chronic lymphocytic leukemia. Cancer Res 2015; 21(16): 3705-3715
- Choudhary GS et al., MCL-1 and BCL-xL-dependent resistance to the BCL-2 inhibitor ABT-199 can be overcome by preventing PI3K/AKT/mTOR activation in lymphoid malignancies. Cell Death Dis 2015; 6(1): e1593
- Barr PM et al., A phase 1/2 study of umbralisib, ublituximab and venetoclax in patients with relapsed or refractory chronic lymphocytic leukemia. ASH 2020, abstract 3137
© 2020 Springer-Verlag GmbH, Impressum