バイオマーカーに基づく臨床試験:試験のデザインおよび規制上の要件
はじめに
分子診断の分野では最近の開発により、かなりの生物学的な違いが特定の解剖学的サブタイプの中でさえ存在していることから、癌自体としての存在はないことが明白になった。ゲノム特性はより良好に腫瘍のサブタイプを定義することに寄与するだけでなく、これらのサブタイプを標的とする機会も提供している。このため、これは有効性と認容性に関して、従来の治療を上回る治療的なアプローチの開発につながり得る。国際がんゲノムコンソーシアム (http://icgc.org/) は、世界中で50種類の癌型および/またはサブタイプから腫瘍におけるゲノム異常(体細胞突然変異、異常な遺伝子発現、エピジェネテ ィック修飾)の包括的カタログを作成し、これらのデータを一般公開するための業務を実施してきた。これは、直近の数十年で最も大きな自然史プロジェクトのうちの1つである。
迅速かつ比較的安価な分子プロフ ァイリングの入手はトランスレーショナルリサーチを支持し、前臨床上の洞察から臨床試験における新規治療の試験の世界的な実施への移行を可能にする。コンパニオンバイオマーカーの組み入れは、腫瘍学の分野における標的療法に対して実施されるすべての新薬試験で義務となった。「バイオマーカ ー」という用語は、分子特性を越えるパラメータの幅広い分野を網羅する一方、それはゲノミクスと他の「オミクス」分析と最も密接に関係するようになった。
定義
1998年に、米国立予防衛生研究所のバイオマーカー定義づけ作業グループは、バイオマーカーを「正常な生物学的プロセス、発病プロセスまたは治療的介入への薬理的な反応の指標として客観的に測定、評価される特性」と定義した。これは、バイオマーカーがゲノム特性を含むがこれに限定はされないさまざまなパラメータを示すことを意味する。表1はバイオマーカーの一部の例を提供している。患者の年齢と患者の性別のみならず、診断そのものまたは腫瘍の組織構造でさえ、バイオマーカーとみなされている。薬物代謝は重要な一面でもあるが、これは見過ごされることが多い。薬物動態に関して、生物学的マーカーになる可能性があるものには薬物吸収、代謝、分配および排泄が含まれる。患者間の違いおよび薬剤分解能力(すなわち、迅速または緩徐な代謝)は、生物学的利用能と毒性に対して重要な場合がある。薬理ゲノミクスは治療に対する反応における患者の遺伝的構成の役割を評価するものであるが、これは非常に重要なものとなった。ゲノムマーカーは特定の治療によって直接の標的とされ、その効果に影響を及ぼし得る。
予後バイオマーカーおよび効果予測バイオマーカー
患者の治療に関係なく予後バイオマーカーは特定の疾患に罹患した患者に生じそうな結果を示唆する一方、効果予測バイオマーカーはその患者が特定の薬剤に反応するか否かに関する情報を提供する。一部のマーカーは上記の機能の双方ともに提供する。例えば、乳癌患者におけるエストロゲン受容体陽性は、好ましい予後(予後情報を提供する)を示すと同時に、その患者が恐らくホルモン療法(効果予測情報を提供する)に応える可能性が高いことを意味する。
代用バイオマーカー
初期相の試験では、代替バイオマーカ ーの評価項目では、例えば無増悪生存期間または全生存期間などの関心のある最終的な臨床評価項目よりも早期の時点で治療効果の判定が可能である。有効な代替バイオマーカーも分子作用の機序を明らかにすることから、それらには予後特性および効果予測特性の双方がある。一方、バイオマーカーに対する治療効果が確実に臨床評価項目に対する治療効果を予測するか否かに関係なく、問題は残る。
覚えておいてほしいこと
バイオマーカーは、客観的に測定可能であるあらゆる種類の生物学的マーカ ーである。分子特性は別として、それらには血液数値、薬物動態およびイメージングなどのパラメータが含まれる。予後バイオマーカーは特定の疾患に罹患した患者の転帰を示唆する一方、効果予測バイオマーカーはその患者が特定の薬剤に反応するか否かに関する情報を提供する。代用バイオマーカーの評価項目は、初期相の試験の臨床評価項目よりも早期に治療効果の評価を可能にする。
試験におけるバイオマーカーの使用
臨床試験では、バイオマーカーは次の実用分野の役に立つ。すなわち、
- 適格性のための患者のスクリーニング
- サブグループへの層別化
- 反応の監視
- 将来の参考のための相関試験
多くの試験プロトコルには、特異的な試験の評価項目のために必ずしも使われるわけではなくて、むしろ将来の試験のデザインの目的のためである追加検体の収集を含む。また、試験は更なる研究(例えば、新規マーカーまたは遺伝子)によって明らかにされてきた新たな情報に照らしてそれ以降のデ ータセットを再分析する考えでデザイン可能である。 微小浸潤のサンプリングを必要とする理想的なマーカーは、信頼性が高く( 例えば、内部的に一貫性がある)、安価、非常に感受性が高く、特異的である。クローンの進化が最初の腫瘍とその転移腫瘍との間、さらに特定の患者中の転移性病巣の間にさえ分子特性の違いをもたらす場合があることから、再生検は進行癌の設定では頻繁に推奨されている。他の用途では、たとえば、生物学的効果が最大忍容量未満である場合にバイオマーカーは早期試験終了の必要性を研究者に注意喚起する無益性の指標として役立つことができる。
バスケット試験およびアンブレラ試験
ゲノムバイオマーカーの出現は、特定の解剖学的に定義された癌型に制限されない試験の発達を促してきた。これらのいわゆる「バスケット試験」では、さまざまな起源の腫瘍に生じる特定の突然変異が標的とされる。一方、「アンブレラ試験」は、さまざまな分子変性を有する1つの癌型における種々の薬剤を通常は評価する。ここでは、単一の腫瘍型または組織を有する患者が登録されるが、複数のサブ試験は分子的に定義されたサブセットの範囲内の標的療法を評価する。バスケット試験とアンブレラ試験の実施は、分子組み入れ基準の適用数を増やすことにに加えて、そのパイプラインにおいて競合薬剤を有する可能性のある製薬会社の協力を必要とする試験を行う必要性によって適格患者数が減少することから、これらの採用採用の双方に特定の難問をもたらす。
覚えておいてほしいこと
理想的には、バイオマーカーは信頼性が高く、安価で、非常に感受性が高く、特異的であり、微小浸潤サンプリングを必要とする。臨床試験でのバイオマーカーの使用は、適格性に対する患者のスクリ ーニング、質の向上、反応の監視および将来の関連試験を目的とすることから成る。新規情報が利用できるようになったことから、試験はそれ以降にバイオマーカーを再分析することを視野に入れてデザインすることができる。バスケット試験は、同じ突然変異を有するさまざまな起源の腫瘍を試験に含み、アンブレラ試験は、同じ腫瘍に罹患した患者のサブセット内で、さまざまな標的薬剤を評価する。
倫理および実際的限界
倫理上の観点から、分子スクリーニングは進行疾患のステージよりも診断時に実施する必要があると論じることができるが、それは患者が早い段階で特定の治療から利益を得ることができるからである。一方、患者が支払いをしなければならない場合には早期試験では財政的な懸念が生じ、さらに政府が支払う場合には費用と便益の観点における懸念が生じる。発生する可能性のあるもう一つの倫理的あつれきは、対照群への患者の無作為化である。非常に有効な治療が否定される可能性があると知って、多くの患者は無作為化を断る。
バイオマーカーが不明確な傾向があることから、実際的な問題も起こる。より広範囲にわたるゲノム分析では、遺伝子の浸透度がしばしば不完全であることが明らかになり、一部の主要な交絡因子では例えば微小環境などの理解の向上を待っている状況である。例えば、腸のバクテリアは患者が治療に反応する方法に影響を及ぼすことが知られている。また、標的経路と免疫系との間に推定される相互作用に関しては更なる研究が必要である。さらに、上記の「定義」のセクションで述べたとおり、客観的な可測性により臨床業務における問題が提起されることがある。突然変異の存在が、はい、または、いいえの原則で評価される一方、免疫組織化学では正確な定量化を避けることが多い値の範囲を使用する。
第Ⅳ相の登録からのデータが将来蓄積されて、これらの問題の解明に光を投げ掛けると想定できる。製薬会社はこれらの登録事項をセットアップする義務があり、それはバイオマーカーの存在を臨床転帰に関連させるものである。
覚えておいてほしいこと
バイオマーカー試験に関する倫理上の懸念には、早期分子スクリーニングおよび対照群への無作為化がある。遺伝子および微小環境または経路と免疫系との間の未知の相互作用などの交絡因子の不完全な浸透度は、制限因子である。
予後バイオマーカーおよび効果予測バイオマーカーの妥当性確認
登録の観点から、バイオマーカーは有効かつ再生可能な必要がある。規制当局は、標準検査がバイオマーカー試験に必ず利用できることを要求している。平均的な病理学検査室は、迅速、安価かつ有効な方法でそれらを提供可能である必要がある。登録にとって等しく重要であるが、バイオマーカーはあらゆる払い戻しスケジュールにも含める必要がある。
臨床試験のバイオマーカーの妥当性確認には以下が含まれる。すなわち、
- 概念の吟味、
- 実験の妥当性確認、
- 分析能力の妥当性確認、
- プロトコル標準化。
概念の吟味
概念吟味の評価の古典的な例は、抗EGFR抗体療法の状況で効果予測マーカーとしてのKRAS突然変異の状態を同定することである。KRAS突然変異は、1990年代以降結腸直腸癌 (CRC) の重要なマーカーとして確立されてきた。KRASタンパクは、腫瘍の生存、血管形成、増殖および転移と関係しているEGFRシグナル伝達経路の下流タンパクを調整する。野生型KRASがタンパクの保存された機能を示す一方、変異体KRASは持続性の成長促進の指標である。この突然変異はCRC患者の3分の1に認められる。
無作為化、第Ⅲ相NCIC/AGITG CO.17試験では、KRAS突然変異状態に対して階層化がなされなかったが、進行したCRCに罹患した患者でプラセボを上回る抗EGFR抗体セツキシマブの臨床的に関連した長所はもたらさなかった[1]。一方、事後分析によれば、突然変異状態が考慮されたときには、2種類の治療群間に明確な違いがあった[2]。KRAS-変異体患者では、セツキシマブは少しの便益も示さなかったが、この抗体を用いた治療を受けたときには、野生型のKRASを有した患者は有意な全生存便益を得た。
実験の妥当性確認
いったんバイオマーカーの開発が診断検査室のレベルに達したならば、非常に高度な基準が必要とされる。実験の妥当性確認は、分析および臨床の妥当性確認からなる2種類の要素を含む( 表2および3)[3]。臨床の妥当性確認は後ろ向き試験の設定よりむしろ理想的には前向き試験で実施する必要があるが、それは、無作為化対照臨床試験からの既存のデータを基礎としたバイオマーカー分析にはいくつかの欠点が存在するからである[4]。多くの場合、当初の試験では相関的な科学的評価項目に対する検出力がもたらされることはなく、組織は無作為化された患者の全てで必ずしも得られたわけではない。後ろ向きの設定で得られる結果は、通常、仮説をたてることと考えられ、前向き試験での確認が必要である。
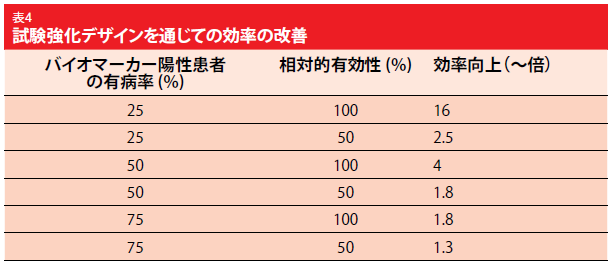
有効性を得ることは、バイオマーカ ー陽性およびバイオマーカー陰性患者における、マーカーの普及度と相対的な有効性に依存する。強化デザインを用いた試験は、奏効する可能性の高い患者を登録するにとどまる。強化デザインの使用すれば効率(表4)が改善され、その使用は費用に関する重要な因子でもある[5]。一方、便益を得そうではない患者の除外は標的療法の科学的な原理を理解する必要を意味し、統計シミュレーションでは強化を通して改善された有効性が明らかになる必要がある。
分析能力の妥当性確認
分析能力の妥当性確認は、さまざまなバイオマーカーアッセイの分析性能を評価する目的のある臨床検査測定を含む。KRAS突然変異試験に対しては、7種類の方法が2009年に比較された[6]。今日、次世代の塩基配列決定は、いくつかの標的化が可能な経路全体の突然変異を調べるよりいっそう広範なパネルの一部としての標準技術となっている。
プロトコル標準化
KRAS試験に関しては、NRASエクソンの変異と同様にさまざまなKRASエクソンの変異が等しく転帰に影響を及ぼすように、CRYSTAL試験からのデータかた拡大RAS試験がより適切であることが示唆された[7]。今日、すべてのRASの突然変異試験がガイドラインによって推奨されている[8]。
覚えておいてほしいこと
コンパニオンバイオマーカーは薬剤登録と払い戻しの重要な部分である。規制当局の観点から、バイオマーカーは有効かつ再生可能であり、検査室は迅速かつ安価なバイオマーカー試験を提供可能な必要がある。
臨床試験のバイオマーカーの妥当性確認には、概念の吟味、実験の妥当性確認(分析および臨床上の妥当性確認を含む)、分析能力の妥当性確認およびプロトコル標準化の証明が含まれる。臨床上の妥当性確認は、前向きの設定で実施する必要がある。強化デザインを使用すれば効率が改善する。
バイオマーカーの承認:規制上の要件
規制当局は通常、気難しく官僚的であると知られているが、公衆衛生を保護、促進する観点から重要な機能を果たしている。彼らは、治療の品質、安全性および有効性を請け負っている。また、彼らは十分かつ適切な情報を患者と医師の双方に提供している。当然、彼らの側の過失には極めて重大な結果があり得ることから、その取り組みは保存的かつ慎重である。研究者の観点から彼らの目的に共感し、その目的に応じれば、協力が楽になり、対立が減る。このため、規制当局の指示には厳密に従う必要がある。
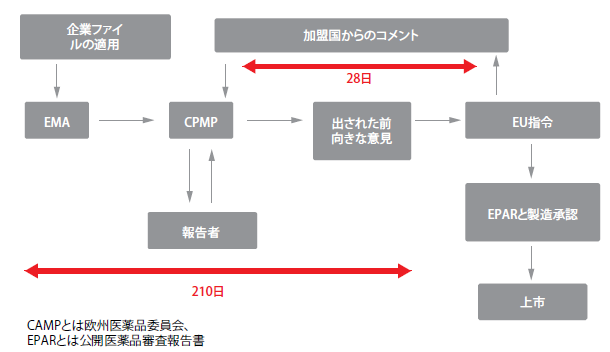
規制への取り組みは、世界中でさまざまである。例えば、日本の規制当局は外国の患者からの臨床データは日本の患者への適用時に制限を受けると考えているが、それは同当局が独立型の開発計画を必要とする理由である。しかしながら、多くの類似点がある。規制当局は、例えば最適試験デザインへの多数の学術情報入力などバイオマ ーカーの必要条件に関して役立つ情報を提供する総合的なウェブサイトを一般的に運営している。情報を用意されたその構造内に加えることが可能なテンプレートは、米国食品医薬品局(FDA) のウェブサイト (www.fda.gov)に提供されている。欧州医薬品庁(EMA) のウェブサイト (http://www. ema.europa.eu/ema/) には、研究者が集中化した承認処置の一部として加盟国からのコメントを受け取る機会がある(図1)。
図1:EMA:集中化承認手続き
レビューおよびプロトコル
規制当局は、バイオマーカーを臨床試験に組み込む最適方法を依然として評価している。将来のために、各国がますますこの点で協同することが期待され得る。
現時点では、研究者は品質保証手段のみならず本試験のために予定される手続きの全てを詳述するプロトコルを提供しなければならない。ほとんどの場合、試験の論理的根拠は、他の研究グループが提供した実験的発見により支持されている。自らの臨床検査デ ータを提供することができるのは研究者の少数のみである。従って、利用できる文献の詳細なレビューは背景記述として必要である。FDAはバイオマーカ ーの必要条件に対する使用の陳述状況の作成を研究者に要求しているが、それは一般的なプロトコルの一部であ って、薬剤開発におけるバイオマーカ ーの使用方法、解釈および使用目的について説明するものである[9]。使用の陳述状況の5つの要素は、明確に定義されている(表5)。品質改善と品質保証の状況では、採血管の正しい取扱いまたは病理学者による評価のタイミングなどの明らかに小さな側面さえ重要な場合がある。これらの全ては、試験のプロトコルで定義される必要がある。
覚えておいてほしいこと
自らのウェブサイトで、規制当局は臨床試験にバイオマーカーを含む枠組みを提供している。研究者達は文献中の既存データを見直し、試験に対して計画された手続きおよび品質保証手段の全てを詳述するプロトコルを提供することを要求されている。FDAの要求はバイオマーカーの必要条件に対する使用の陳述状況の作成であるが、それは薬剤開発におけるバイオマーカーの使用方法、解釈および使用目的について説明している。
NSCLCにおける橋渡し研究
この10年にわたる進行した小細胞型肺癌 (NSCLC) の管理の変遷は、科学的な発展によってもたらされ得る治療パラダイムの変化の大きさを例証するものである。橋渡し研究はその方法に沿ったそれぞれの段階に大きく寄与してきた。
有効性の鍵としての酵素発現
2008年まで、肺癌患者の治療の選択は、主に小細胞型組織および非小細胞型組織の間の区別に依存し、ダブレット化学療法が標準的取り組みであった。毒性はあらゆる治療決定における重要な決定要素であった。
当時、初の前向き治験は、組織学を予測可能な因子として評価するために予め予定された分析を含めてNSCLC患者で行われた[10]。これはペメトレキセド+シスプラチンが腺癌患者でより有効であることを示した一方、扁平上皮細胞組織を有した患者で得られた結果はゲムシタビン+シスプラチンを支持した。これらの所見は、ペメトレキセドの適応の改訂を促進し(ペメトレキセドは、現在進行した非扁平上皮NSCLCの治療のために承認されている)、疾患へのこの集学的アプローチの関連性を強調するものであった。
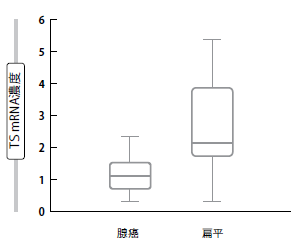
橋渡し研究は、当時異例であった組織学的階層化に対する正当性をもたらした。チミジル酸シンターゼ (TS) はペメトレキセド代謝に関係する酵素のうちの1つであるが、肺の腺癌に比べて扁平上皮細胞癌において有意により高度に発現されることが示された(図2)[11]。一方、メタ解析ではNSCLCにおけるペメトレキセドベースの化学療法の設定で、いくつかの評価項目(すなわち奏効率、無増悪生存期間、全生存期間)に対するTS発現の予測の重要性が確認された[12]。小細胞肺癌 (SCLC) については、反対に無作為化GALES試験によりエトポシド+カルボプラチンの標準処方と比較した場合にペメトレキセド+カルボプ
図2:肺の腺癌および扁平上皮細胞癌におけるチミジル酸シン
ターゼ (TS) の発現の有意差(ホルマリン固定パラフィン包埋組織)
ラチンの能力が劣ることが明らかにな った[13]。いずれのTSがSCLCの高度発現するかに基づいて、これらの所見は前臨床設定で並行して得られた洞察と整合している。
試験結果陰性の理由
一方、薬理ゲノミクス研究および橋渡し研究は必ずしも成功していない。この証拠はNSCLCに対するアジュバント試験の展望であり、そしてそれは一連の試験結果陰性によってこれまで示されてきた。橋渡し研究は、豊富に利用できる組織が原因でアジュバント設定では最も容易に実施できる。
これにはいくつかのあり得る理由がある。1つは診断検査そのものであるが、それは不十分な感度または特異度によって損なわれることがある。TASTE試験では、薬理ゲノミクスに基づく試験のデザインにおけるバイオマーカーとして除去修復交差相補群1 (ERCC1) を使用してそのタンパクの発現を確認した。一方、試験ははERCC1 IHC読み出しの信頼性が予想外に低かったことから患者150名の試験は中止となり、第Ⅲ相試験は取り消しとなった。歴史的な国際肺癌補助療法試験 (IALT) のデータを使用して、予想され観察されたバイオマーカーの分布は、お互いにかなり偏位していた[15]。また、検出と強化の選択は、おそらくRADIANT試験の結果が陰性であることが理由であった。RADIANT試験は、完全な腫瘍切除と標準治療の後にエルロチニブとプラセボを比較した[16]。ここでは、研究者はEGFRの状態を確認するためにIHCとFISHを使用したが、それが本試験のデザイン時に最新であるとみなされた場合であっても、おそらく適切な技術ではなかった。
橋渡し研究の陰性結果の裏にあるもう一つの理由は、1つのバイオマーカ ーのみを選択したことであった。一般的により完全な分析結果は、薬理ゲノミクスに基づく試験で定義されるべきである。単一のバイオマーカーは、それが明確なドライバー異常である場合のみ条件を満たし、EGFR突然変異はこの状況における良い例である。一般的に言って、単一のバイオマーカーのみで実施されるあらゆる薬理ゲノミクスに基づく試験は補助療法および進行時の設定の双方で陰性であった。
試験デザインには欠点が存在することもあり、それは適切な比較を困難とする。とりわけ、補助ITACA試験のデザインで使われたように、分子プロファイルは実験群対対照群に患者を割り付ける(またはランダム化)前に定義する必要がある[17]。ITACAはリアルタイムPCRを使用したERCC1およびTSの評価の後に標準化学療法に対して薬理ゲノミクスに基づく療法を比較し、4つの異なるプロファイルを同定した。
覚えておいてほしいこと
肺癌の治療において、長期的パラダイムは組織学に対して予め予定された分析を含んだ初の前向き治験により2008年に変更され、それはペメトレキセドの承認への改正をもたらした。チミジル酸シンターゼの発現は、この治療に由来する臨床的な便益に非常に関連性が強いことが明らかになった。橋渡し研究は必ずしも成功してこなかったが、試験が陰性結果となった理由は診断検査、試験のデザイン、方法および単一のバイオマーカ ーの使用に関して欠点を含んでいたからであった。
参考文献
- Jonker D et al., Cetuximab for the treatment of colorectal cancer.N Engl J Med 2007; 357: 2040-2048
- Karapetis CS et al., K-ras mutations and bene-fit from cetuximab in advanced colorectal cancer.N Engl J Med 2008; 359: 1757-1765
- Gandara et al., CAPR Workshop, April 2011
- Lee CK et al., Molecular biomarkers to indivi-dualise treatment: assessing the evidence.Med J Aust 2009; 190: 631-636
- Simon R, Maitournam A, Evaluating the effici-ency of targeted designs for randomized clinical trials.Clin Cancer Res 2004; 10(20): 759-6763
- Whitehall V et al., A multicenter blinded study to evaluate KRAS mutation testing methodolo-gies in the clinical setting.J Mol Diagn 2009; 11(6): 543-552
- Van Cutsem E et al., Fluorouracil, leucovorin, and irinotecan plus cetuximab treatment and RAS mutations in colorectal cancer.J Clin Oncol 2015; 33(7): 692-700
- Van Cutsem E et al., ESMO consensus guidelines for the management of patients with metastatic colorectal cancer.Ann Oncol 2016; 27: 1386-1422
- http://www.fda.gov/Drugs/DevelopmentAp-provalProcess/DrugDevelopmentToolsQualifica-tionProgram/ucm284620.htm
- Scagliotti GV et al., Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pe-metrexed in chemotherapy-naive patients with advanced-stage non‒small-cell lung cancer.J Clin Oncol 2008; 26: 3543-3551
- Ceppi P et al., Squamous cell carcinoma of the lung compared with other histotypes shows higher messenger RNA and protein levels for thymidylate synthase.Cancer 2006; 107(7): 1589-1596
- Liu Y et al., Expression of thymidylate synthase predicts clinical outcomes of pemetrexed-contai-ning chemotherapy for non‒small-cell lung can-cer: a systemic review and meta-analysis.Cancer Chemother Pharmacol 2013; 72: 1125-1132
- Socinski MA et al., Phase III study of peme-trexed plus carboplatin compared with etopo-side plus carboplatin in chemotherapy-naive pa-tients with extensive-stage small-cell lung cancer.J Clin Oncol 2009; 27(28): 4787-4792
- Monica V et al., Differential thymidylate synthase expression in different variants of large-cell carcinoma of the lung.Clin Cancer Res 2009; 15(24): 7547-7552
- Soria JC et al., Results of the prospective, ran-domized, and customized NSCLC adjuvant phase II trial (IFCT-0801, TASTE trial) from the French Collaborative Intergroup.J Clin Oncol 31, 2013 (suppl; abstr 7505)
- Kelly K et al., A randomized, double-blind phase 3 trial of adjuvant erlotinib (E) versus pla-cebo (P) following complete tumor resection with or without adjuvant chemotherapy in pati-ents (pts) with stage IB-IIIA EGFR positive (IHC/FISH) non‒small-cell lung cancer (NSCLC):
RADIANT results.J Clin Oncol 32:5s, 2014 (suppl; abstr 7501) - Novello S et al., Preliminary results of the in-ternational tailored chemotherapy adjuvant trial: the ITACA trial.J Thorac Oncol 2015; 10(9), ORAL04.03