微生物组在癌变和对检查点抑制的应答中的潜在作用
细菌对于人体的健康和功能具有至关重要的作用,人体含有的细菌比人体细胞更多,比例为1.3:1 [1, 2]。人体内已鉴定出超过10,000种不同的微生物物种。每个人都携带10至100万亿个共生微生物细胞,这些微生物主要在肠道中。它们的基因数量超过人类基因组的基因数量,比例大致为100:1。肠道微生物组完成了许多与免疫系统的代谢和调节有关的重要任务(表)[3]。
在这里,生态失调的概念开始发挥作用,该概念是指宿主的共生微生物生态系统从健康相关的稳态状态向癌促进性和/或维持性表型的持续偏离[4, 5]。然而,生态失调似乎是个体、疾病和生态位特定的。在门水平(拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes))上发现了相似的“核心微生物组”,但在较低的分类学水平上,在看起来健康的个体中普遍存在差异。
微生物与癌症
微生物可以既是共生体又是病原体,在癌症的发病机理中具有潜在作用。许多最常见的癌症至少部分归因于感染。该范围估计从淋巴瘤和白血病的20 %到宫颈癌的几乎100 %[6]。与感染相关性不太明显的其他类型的癌症也可能由功能异常的细菌生长引发或促使。指出微生物群在肠癌中重要性的报道于1969年首次发表[7]。同时,各种研究已在具核梭杆菌(Fusobacterium nucleatum)与大肠癌之间建立了联系。与正常组织相比,这种病原体显示在结直肠癌中富集[8, 9]。不同的肠道微生物组模式与共识分子亚型相关[10],并且发现与特定的解剖学位置、分期和分子特征相关联[11, 12]。最近,还通过宏基因组测序在结直肠肝转移中检测到了梭杆菌,通过原位杂交使其可视化并通过培养进行了分离,表明结直肠肿瘤细胞为这种微生物提供了特定的生态位[13]。这些数据已促使对梭杆菌和总体肠道微生物组在CRC发生和发展中的致病作用进行研究。
潜在机制模型
特定微生物已显示通过多种机制调节癌症的众多特征[14]。所有这些机制导致延长的宿主细胞存活、增强的复制能力和去分化。已经提出了两个概念框架,恰当地描述了人类微生物组对癌变的促进作用。Alpha-bug假说指出,某些具有独特毒力特性的微生物组成员直接致癌,并且还能够重塑结肠细菌群落,最终诱发结肠癌[15]。另一方面,根据驾驶员-乘客(driver-passenger)假说,随着突变的积累和腺瘤向癌的转变,乘客细菌在与驾驶员细菌的竞争中占据上风[16]。
2019年,国际癌症微生物组协会发表了关于人类微生物组在癌变中作用的共识声明[17]。专家组得出结论认为,尽管有动物和人类研究的机理性和支持证据,但目前尚无直接证据表明人类共生微生物组是癌症发病机理的关键决定因素。这其中一个首要决定因素是缺乏大型纵向队列研究。然而,与此同时,专家认为微生物组,与环境因素和表观遗传/遗传易感宿主一起,代表驱动癌变的三方多向相互作用组的一个顶点。
因此,来自大型国际纵向队列研究的数据应成为未来研究的重点,以确认人类微生物组在癌症发病机理中的作用。还需要更加关注介入研究、数据与其他肿瘤学研究的整合以及报告微生物组研究的标准化和透明度。
抗生素和对免疫疗法的应答
从治疗的角度来看,微生物组已成为免疫检查点抑制(ICI)应答的生物标志物。正如小鼠模型所指出,缺乏完整的肠道微生物组会对免疫疗法的疗效产生负面影响[18, 19]。这意味着抗生素的使用在其中起到重要作用。事实上,Elkrief等人最近发表的论文总结了包括超过1,800名患者在内的多项临床研究,证明了广谱抗生素对ICI治疗的患者具有负面的预测性影响[20]。数据表明,如果在免疫疗法之前(而非期间)开具抗生素处方,则有害作用尤为明显。因此,ICI前的抗生素治疗通过改变肠道微生物群的多样性和组成而代表耐药性的一个危险因素。微生物组谱分析显示,在对免疫疗法有应答的NSCLC和黑素瘤患者中,多样性更高和某些免疫原性细菌(如阿克曼氏菌(Akkermansia)、厚壁菌和双歧杆菌(Bifidobacterium))过量[18, 21, 22]。将这些免疫原性细菌与CD4 +和CD8 + T细胞启动相连接的当前机制似乎与ICI活性降低有关。
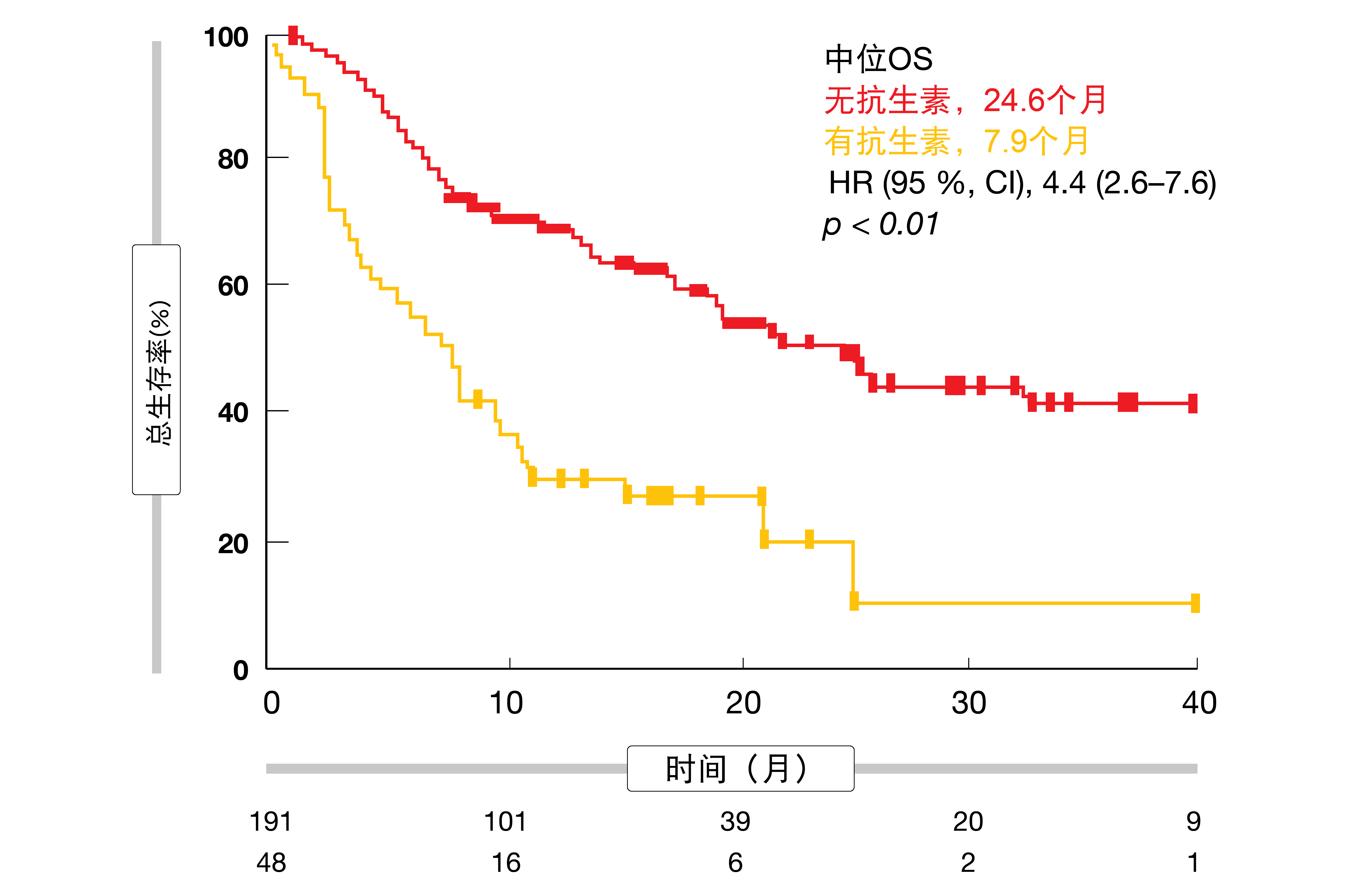
生存结果可能会因抗微生物预先治疗而显著变化。Derosa等人展示,在肾细胞癌患者中,与不使用抗生素相比,使用抗生素与原发性疾病进展的风险增加(75 %与22 %;p < 0.01)、PFS缩短(1.9与7.4个月;p < 0.01)和OS缩短(17.3与30.6个月;p = 0.03)相关联[23]。在肺癌患者中,PFS(1.9与3.8个月;p = 0.03)和OS(7.9与24.6个月;p < 0.01;图)均降低。然而,争议仍然存在,因为抗生素治疗可能仅构成不健康或免疫缺陷患者的替代标志物。
图: 使用抗生素对肺癌患者总体生存结果的影响
如何恢复微生物组健康?
尽管如此,肠道微生物组的修饰已被评价为免疫肿瘤学中的创新性治疗机遇。多项临床试验正在进行当中,以尝试有利地改变微生物组的组成。此处评估的方法包括来自ICI缓解者或健康供体的粪便微生物群移植(FMT)、细菌聚生体/混合物、高纤维/全食物饮食干预以及炭基胶囊与抗生素的共同给药。已经招募了具有包括黑素瘤、胃癌和肺癌在内的多种肿瘤类型的患者。一项在难治性转移性黑色瘤患者中评估FMT和抗PD-1治疗再诱导的I期试验发现FMT是安全的[24]。根据作者的结论,这种治疗可以改变接受者的肠道微生物群,以使其类似于缓解者供体的肠道微生物群,从而导致能够转化为临床和放射学获益的肿瘤内T细胞活性。
此外,肠道微生物组与免疫介导的结肠炎之间可能存在关联。Wang等人首次报道了用FMT成功治疗ICI相关性结肠炎的病例系列[25]。研究人员观察到肠道微生物组的重构以及结肠粘膜内调节T细胞比例的相对增加。这些初步数据提供了肠道微生物组的调节可能会消除ICI相关性结肠炎的证据。
一般性建议
Elkrief等人建议了各个步骤,提倡在ICI治疗的患者中合理使用抗生素 [20]。如果在给定患者中高度怀疑存在细菌感染,则应在开具抗生素处方之前通过适当的测试(例如,血液培养、成像)来确认该诊断。应首选窄谱药物,并在可能的情况下应选择随后进行较短的疗程。可以考虑进行感染性疾病会诊以进行抗生素管理。免疫疗法前一个月应避免使用抗生素。
总体而言,尽管肠道微生物组的临床意义仍需进一步阐明,但其构成了需要纳入个性化免疫肿瘤学试验的潜在生物标志物。
资料来源:
Lecture “The importance of the microbiome in cancer”, Paolo Nuciforo, MD, PhD, Vall d’Hebron Institute of Oncology, Barcelona, Spain; ESMO Congress 2019, 29th September
Lecture “Working on the microbiome”, Bertrand Routy, MD, PhD, University of Montreal Medical Center, Canada; ESMO Congress 2019, 28th September
参考文献
- Sender R et al., Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell 2016; 164(3): 337-340
- Turnbaugh PJ et al., The human microbiome project: exploring the microbial part of ourselves in a changing world. Nature 2007; 449(7164): 804-810
- Kinross JM et al., Gut microbiome-host interactions in health and disease. Genome Med 2011; 3(3): 14
- Hall AB et al., Human genetic variation and the gut microbiome in disease. Nature Rev 2017; 18(11): 690-699
- Herbst RS et al., Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387(10027): 1540-1550
- Gilbert JA et al., Current understanding of the human microbiome. Nature Med 2018; 24(4):392-400
- www.cancer.org/canceratlas
- Aries V et al., Bacteria and the aetiology of cancer of the large bowel. Gut 1969; 10(5): 334-335
- Kostic AD et al., Genomic analysis identifies association of Fusobacterium with colorectal carcinoma. Genome Res 2012; 22(2): 292-298
- Castellarin M et al., Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma. Genome Res 2012; 22(2): 299-306
- Purcell RV et al., Distinct gut microbiome patterns associate with consensus molecular subtypes of colorectal cancer. Scientific Reports 2017; 7(1): 11590
- Mima K et al., Fusobacterium nucleatum in colorectal carcinoma tissue according to tumor location. Clin Transl Gastroenterol 2016; 7(11): e200
- Mima et al., Fusobacterium nucleatum in colorectal carcinoma tissue and patient prognosis. Gut 2016; 65(12):1973-1980
- Bullman S et al., Analysis of Fusobacterium persistence and antibiotic response in colorectal cancer. Science 2017; 358(6369): 1443-1448
- Fulbright L et al., The microbiome and the hallmarks of cancer. PLoS Pathog 2017; 13(9): e1006480.
- Sears CL & Pardoll DM, Perspective: alpha-bugs, their microbial partners, and the link to colon cancer. J Infect Dis 2011; 203(3): 306-311
- Tjalsma H et al., A bacterial driver-passenger model for colorectal cancer: beyond the usual suspects. Nat Rev Microbiol 2012; 10(8): 575-582
- Scott AJ et al., International Cancer Microbiome Consortium consensus statement on the role of the human microbiome in carcinogenesis. Gut 2019; 68: 1624-1632
- Routy B et al., Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science 2018; 359(6371): 91-97
- Vétizou M et al., Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science 2015; 350(6264): 1079-84
- Elkrief A et al., The negative impact of antibiotics on outcomes in cancer patients treated with immunotherapy: a new independent prognostic factor? Ann Oncol 2019 Jul 3. pii: mdz206. doi: 10.1093/annonc/mdz206. [Epub ahead of print]
- Gopalakrishnan V et al., Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science 2018; 359(6371): 97-103
- Derosa L et al., Negative association of antibiotics on clinical activity of immune checkpoint inhibitors in patients with advanced renal cell and non-small-cell lung cancer. Ann Oncol 2018; 29(6): 1437-1444
- Baruch EN et al. Fecal microbiota transplantation (FMT) and re-induction of anti-PD-1 therapy in refractory metastatic melanoma patients – preliminary results from a phase I clinical trial (NCT03353402). AACR Annual Meeting 2019, abstract CT042
- Wang Y et al., Fecal microbiota transplantation for refractory immune checkpoint inhibitor-associated colitis. Nat Med 2019; 25(1): 188
More posts
PARP抑制剂的新应用
PARP抑制剂的新应用 转移性去势抵抗性前列腺癌 在雄激素受体(AR)靶向治疗(即恩杂鲁胺(enzalutamide)或阿比特龙(abiraterone))和紫杉烷类化疗后
妇科癌症中的PARP抑制:最新见解
妇科癌症中的PARP抑制:最新见解 聚(ADP-核糖)聚合酶(PARP)抑制剂已被确定为治疗晚期卵巢癌(OC)的重要药物类别,而晚期卵巢癌是女性癌症死亡的主要原因。奥拉帕尼
微生物组在癌变和对检查点抑制的应答中的潜在作用
微生物组在癌变和对检查点抑制的应答中的潜在作用 细菌对于人体的健康和功能具有至关重要的作用,人体含有的细菌比人体细胞更多,比例为1.3:1 [1, 2]。人体内已鉴定出超过
胃癌和食管癌、肝细胞癌以及尿路上皮癌中的PD-1抑制
胃癌和食管癌、肝细胞癌以及尿路上皮癌中的PD-1抑制 胃癌和食管癌 胃和胃食管交界处(GEJ)发生的腺癌在全球最常见的恶性肿瘤中排名第五[1, 2],在男性和女性中均为癌症
序言
序言 亲爱的读者们, 借助“memo inOncology”,施普林格创建了一个能够全球访问的医学教育平台,向肿瘤学领域的医疗保健专业人士提供有价值的内容(www.memo