ALK突变阳性NSCLC患者治疗新见解
间变性淋巴瘤激酶(ALK)是一种融合致癌基因,且NSCLC患者中ALK突变的发生率在不同种族间类似。在2017年CSCO年会上,治疗ALK突变阳性NSCLC患者的主要进展与针对一线和二线治疗的新建议,以及对ALK酪氨酸激酶抑制剂(TKI)产生耐药前后管理患者的最佳策略有关。会议还报道了伴随EGFR-ALK突变患者的管理策略。
ALK突变阳性NSCLC患者的一线治疗
CSCO推荐使用克唑替尼(crizotinib)作为ALK突变阳性NSCLC患者的一线治疗。然而,最近发表的J-ALEX和ALEX研究对艾乐替尼(alectinib)与克唑替尼作为这些患者的一线治疗进行了比较,结果显示,与克唑替尼相比,艾乐替尼获得改善的无进展生存期 [1]。因此,NCCN的NSCLC指南推荐使用艾乐替尼作为ALK突变阳性NSCLC患者的一线治疗[2]。
基于J-ALEX和ALEX试验的结果,中国北京大学肿瘤医院胸部肿瘤内科主任王洁教授指出,虽然艾乐替尼已被证实比克唑替尼更加有效,但目前正在进行中的关于其他ALK抑制剂的III期研究(即使用布加替尼(brigatinib)的ALTA-1L试验,使用劳拉替尼(lorlatinib)的CROWN试验和使用ensartinib的eXalt3试验)仍使用克唑替尼作为对照组的一线治疗。因此,使用克唑替尼作为对照一线治疗的这种设置目前是否适当存在疑问[3]。
ALK突变阳性NSCLC的二线治疗:新的突破?
获得性耐药是ALK TKI在临床实践中作为一线治疗的主要限制。约有30%使用克唑替尼治疗的难治性肿瘤在ALK激酶结构域(包括G1269A、L1196M、C1156Y、L1152R、S1206Y、1151Tins、G1202R和F1174L)中显示出具有耐药突变[4]。劳拉替尼是第三代ALK TKI,在临床前研究中显示对大多数耐药突变有效[5]。虽然这些数据很有前景,但仍需在对一线治疗耐药的ALK突变阳性NSCLC患者中进行临床研究加以证实。
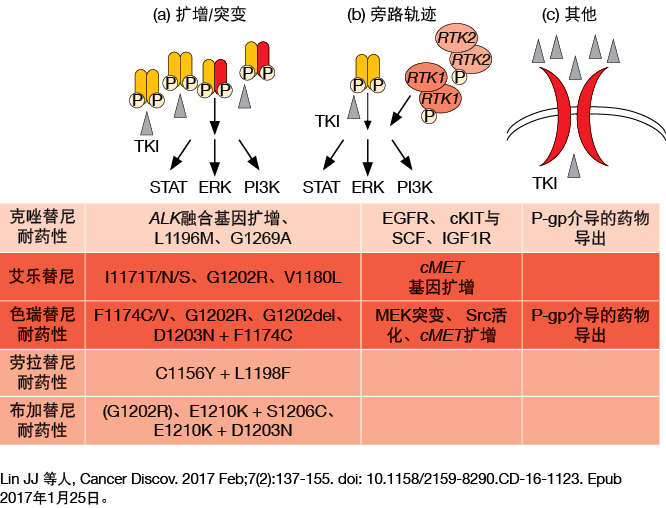
ALK TKI耐药机制:研究和结果
几项研究正在探索克唑替尼耐药机制,而对第二代和第三代ALK TKI的此类研究甚少。然而,在2017年CSCO年会上,王教授指出,对第二代和第三代ALK TKI耐药似乎主要存在三种机制:(i)扩增/突变,诸如对艾乐替尼耐药的G1202R、对色瑞替尼(ceritinib)耐药的F1174C/V、对劳拉替尼耐药的C1156Y+L1198F以及对布加替尼耐药的G1202R;(ii)旁路激活,诸如对艾乐替尼耐药的cMET基因扩增和对色瑞替尼耐药的MEK突变;以及(iii)其他机制,诸如P-gp介导的药物导出(图1)。
因此,王教授认为,诸如与EGFR TKI联合等治疗策略可能有利于防止旁路激活产生的耐药性,阻断通过EGFR旁路途径产生的耐药。
图1: 对第二代和第三代ALK TKI耐药的三种主要机制的图解
ALK阳性NSCLC的异质性诊断和治疗
在NSCLC患者中已经观察到伴随突变,其中EGFR-ALK伴随突变的发生率约为0.1% [6]。Lou等人[7]报道,与化疗、克唑替尼或血管内皮生长因子受体TKI相比,使用EGFR TKI对EGFR-ALK突变NSCLC患者进行一线治疗提供了更好的结果。然而,Lo Russo G等人进行的研究[8]报道认为,对于同时出现EML4-ALK重排和EGFR突变的NSCLC患者,ALK TKI相比EGFR TKI提供了更高比率的完全/部分缓解(51.3%与
43.4%)。作者指出,Lou等人[7]和Lo Russo G等人[8]之间的差异可能是由于伴随ALK/EGFR突变的异质性模式[9]。
参考文献
- Peters S et al., Alectinib versus Crizotinib in Untreated ALK-Positive Non–Small-Cell Lung Cancer. N Engl J Med. 2017;377(9):829-838.
- NCCN Clinical Practice Guidelines in Oncology: Non–Small Cell Lung Cancer; version 7, 2017.
- Jie W et al., Treatment Strategy for Advanced ALK-Positive NSCLC. CSCO 2017.
- Gainor JF et al., Emerging Paradigms in the Development of Resistance to Tyrosine Kinase Inhibitors in Lung Cancer. J Clin Oncol. 2013;31:3987-3996.
- Zou HY et al., PF-06463922, an ALK/ROS1 Inhibitor, Overcomes Resistance to First and Second Generation ALK Inhibitors in Preclinical Models. Cancer Cell. 2015;28(1):70-81.
- Ulivi P et al., Nonsquamous, Non–Small-Cell Lung Cancer Patients Who Carry a Double Mutation of EGFR, EML4-ALK or KRAS: Frequency, Clinical-Pathological Characteristics, and Response to Therapy. Clin Lung Cancer. 2016;17(5):384-390.
- Lou NN et al., Clinical Outcomes of Advanced Non–Small-Cell Lung Cancer Patients with EGFR Mutation, ALK Rearrangement and EGFR/ALK Co-Alterations. Oncotarget. 2016;7(40):65185-65195.
- Lo Russo G et al., Concomitant EML4-ALK Rearrangement and EGFR Mutation in Non–Small Cell Lung Cancer Patients: a Literature Review of 100 Cases. Oncotarget. 2017;8(35):59889-59900.
- Cai W et al., Intratumoral Heterogeneity of ALK-Rearranged and ALK/EGFR Coaltered Lung Adenocarcinoma. J Clin Oncol. 2015;33(32):3701-3709.
More posts
序言
序言 周彩存,医学博士 中国上海同济大学医学院附属上海市肺科医院肿瘤科主任 亲爱的同事们, 在全球对抗癌症的斗争中,覆盖世界多个地区进行临床试验已成为习惯作法,其最终目的