Hémoglobinurie paroxystique nocturne:
améliorer les résultats grâce à de nouvelles stratégies
L’hémoglobinurie paroxystique nocturne (HPN) est une maladie clonale rare et potentiellement mortelle des cellules souches hématopoïétiques; elle est caractérisée par une anémie hémolytique, une insuffisance médullaire, des thromboses et une cytopénie du sang périphérique. Cette maladie provient d’une mutation acquise causant une perte fonctionnelle du gène PIGA impliqué dans la synthèse des protéines CD59 et CD55, molécules d’ancrage du glycophophatidylinositol qui inhibent le complément [1-4]. Leur absence conduit à une activation incontrôlée de la voie finale du complément et à une lyse d’érythrocytes due au complément. L’HPN est associée à un lourd fardeau de maladie et à une détérioration de la qualité de vie liée à la santé [4].
Les options thérapeutiques lors d’HPN étaient limitées jusqu’à l’introduction de l’anticorps monoclonal éculizumab. L’éculizumab, qui est administré par voie intraveineuse, cible la fraction 5 (C5) de la cascade du complément et prévient ainsi l’hémolyse intravasculaire [5, 6]. Une normalisation complète du taux d’hémoglobine sous éculizumab n’a toutefois été constatée que chez un tiers des patients atteints d’HPN [7]. De nombreux patients continuent à souffrir d’une anémie plus ou moins prononcée, exigeant dans certains cas des transfusions régulières d’érythrocytes. Les facteurs contribuant à l’anémie résiduelle comprennent une dysfonction sous-jacente de la moelle osseuse, une hémolyse intravasculaire résiduelle et la survenue d’une hémolyse extravasculaire due au C3, sur lequel les inhibiteurs du C5 tels que l’éculizumab n’ont pas d’effet [8].
Les approches thérapeutiques novatrices ciblant le complément se concentrent par conséquent sur certains de ces mécanismes. Des stratégies sont actuellement étudiées pour une inhibition proximale du complément avec inclusion d’agents ciblant le C3 et les facteurs D et B impliqués dans la formation de la C3 convertase de la voie alterne.
PEGASUS: le pegcétacoplan induit une augmentation de l’hémoglobine
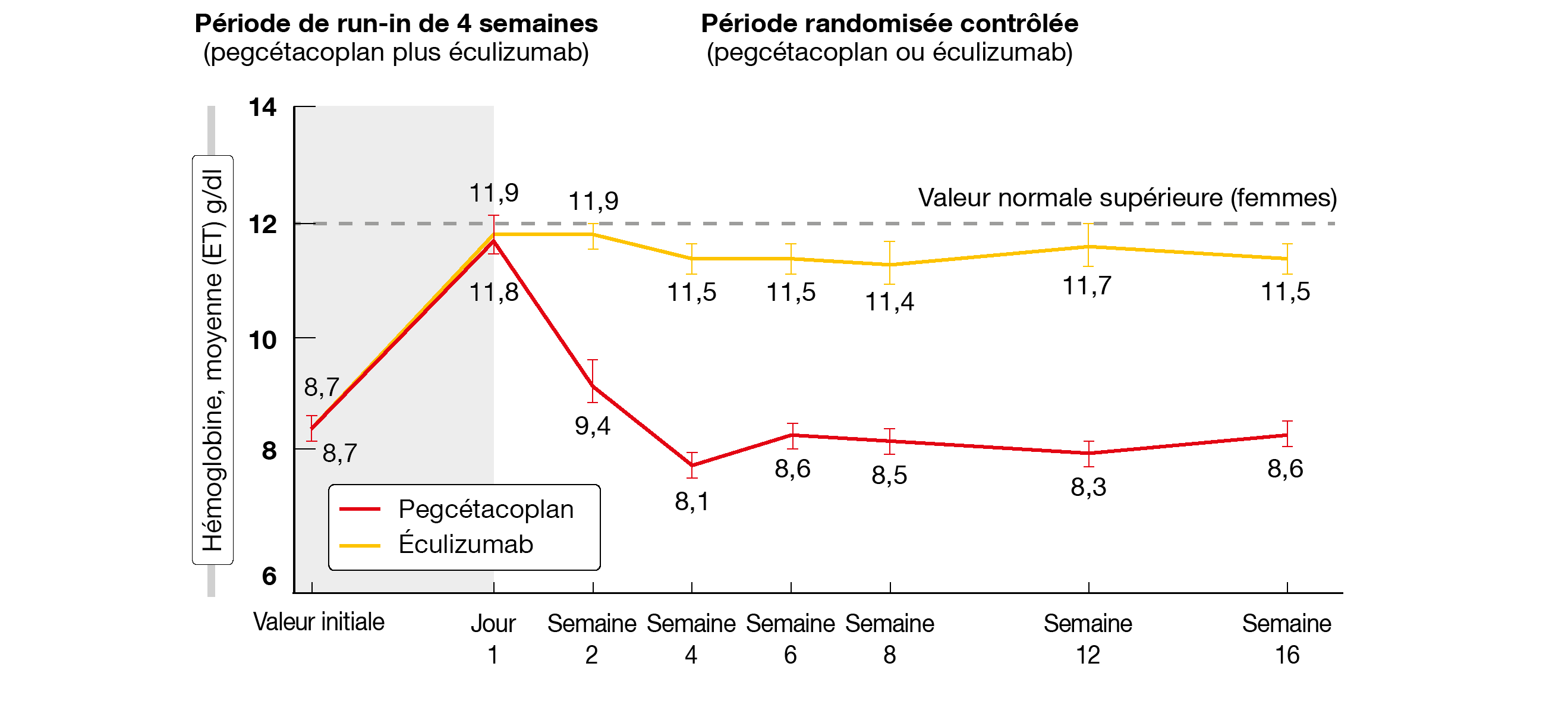
L’agent expérimental pegcétacoplan, un inhibiteur de C3 administré par voie sous-cutanée, a le potentiel de contrôler à la fois l’hémolyse intravasculaire et l’hémolyse extravasculaire chez les patients atteints d’HPN [9]. Le pegcétacoplan en monothérapie a été évalué dans l’étude PEGASUS, une étude randomisée de phase III, chez des patients présentant des taux d’hémoglobine <10,5 g/dl malgré ≥6 mois de traitement par l’éculizumab [10]. Pendant la période de run-in de 4 semaines, tous les participants ont reçu 1080 mg de pegcétacoplan deux fois par semaine en plus de la dose standard d’éculizumab. Ils ont ensuite été randomisés pour recevoir soit 1080 mg de pegcétacoplan deux fois par semaine (n = 41), soit leur dose actuelle d’éculizumab (n = 39). Le critère d’évaluation primaire de l’étude était la variation du taux d’hémoglobine à 16 semaines par rapport à la valeur initiale. À cette date, les patients du groupe de contrôle sont passés à l’autre traitement et toute la population de l’étude a été traitée par le pegcétacoplan seul pendant une période de 32 semaines en ouvert.
Le traitement expérimental a causé une amélioration hautement significative des taux d’hémoglobine versus traitement standard, avec une différence ajustée de 3,84 g/dl (p < 0,0001) entre les deux traitements. Le taux initial d’hémoglobine avait été de 8,7 g/dl dans les deux groupes; il a augmenté de 2,37 g/dl sous pegcétacoplan et baissé encore de 1,47 g/dl dans le groupe traité par l’éculizumab. Cet effet a été observé indépendamment des antécédents de transfusion (< 4 vs ≥ 4 événements de transfusion). L’estimateur de Kaplan-Meier montre que l’augmentation a été atteinte pendant la période de run-in et s’est maintenue dans le groupe traité par pegcétacoplan, tandis qu’elle a régressé ensuite chez les patients du groupe de contrôle. Ces derniers sont revenus aux valeurs initiales en l’espace de 4 semaines post-randomisation (Figure 1).
Figure 1: PEGASUS: l’augmentation du taux d’hémoglobine se maintient sous pegcétacoplan,
mais régresse sous éculizumab après la randomisation
Avantages en termes de résultats secondaires
p>Concernant l’évitement de transfusions (le critère secondaire principal), l’analyse a révélé 62,5 % de différence ajustée du risque en faveur du pegcétacoplan (85,4 % vs 15,4 %). Cet avantage était particulièrement marqué chez les patients qui avaient auparavant un besoin élevé de transfusions (85,7 % vs 4,3 %), mais est apparu également chez les patients qui avaient reçu peu de transfusions (85,0 % vs 31,3 %). Les taux de réticulocytes ont baissé de 136 x 109/l sous pegcétacoplan, tandis qu’ils ont augmenté de 28 x 109/l sous éculizumab, ce qui correspond à une différence significative de 164 x 109/l. L’analyse de la sensibilité sans censure pour les transfusions indique que des valeurs dans la normale se sont rétablies sous pegcétacoplan pour les taux de lactate déshydrogénase (LDH), les nombres de réticulocytes et les taux de bilirubine, tandis que l’éculizumab n’a guère influencé ces paramètres. Une normalisation a été atteinte chez 34 % vs 0 % pour les taux d’hémoglobine; chez 70,7 % vs 15,4 % pour les taux de LDH et chez 78 % vs 2,6 % pour les réticulocytes. De plus, les patients du bras expérimental ont moins souffert d’états de fatigue selon les évaluations réalisées au cours de l’étude à l’aide du score FACIT de fatigue. Là, 73,2 % ont atteint une amélioration de ≥3 points versus valeur initiale, par rapport à 0 % sous éculizumab.
Les effets indésirables étaient en majorité légers ou modérés. Parmi les EI d’intérêt, les plus fréquents étaient des réactions au site d’injection (36,6 % sous pegcétacoplan vs 2,6 % sous éculizumab), mais les événements étaient pour la plupart légers et limités à la période initiale du traitement. 3 patients du bras expérimental de l’étude ont arrêté le traitement prématurément à cause d’une hémolyse survenue malgré le traitement. Chez 2 de ces patients, les concentrations sériques de pegcétacoplan avant ces événements étaient plus basses qu’attendu et aucun de ces patients n’avait augmenté la dose à 1080 mg tous les 3 jours avant d’arrêter le traitement.
Globalement, les résultats de l’étude PEGASUS ont confirmé que le pegcétacoplan permet de contrôler à la fois l’hémolyse intravasculaire et l’hémolyse extravasculaire chez les patients atteints d’HPN et présente le potentiel d’une nouvelle option thérapeutique.
Activité de l’éculizumab en fonction de l’âge
Lee et al. ont présenté une analyse évaluant les résultats cliniques obtenus sous éculizumab chez des patients âgés de ≥65 ans inclus au registre international d’HPN [11]. Ce registre est une étude prospective internationale en cours sur la biologie de l’HPN et les propriétés d’efficacité et de sécurité à long terme de l’éculizumab. Des patients adultes (âgés de 18 à 64 ans, n = 1537) ont été comparés à des patients âgés (n = 270) inclus au registre.
Les résultats suggèrent une influence de l’âge sur l’efficacité de l’éculizumab concernant la réduction de l’hémolyse intravasculaire, l’obtention d’une indépendance des transfusions et la prévention d’incidents thrombotiques et d’effets indésirables vasculaires majeurs. Aussi bien les patients du groupe adulte que ceux du groupe âgé ont atteint des réductions substantielles du taux de LDH, passant de 5 fois la limite supérieure de la normale (LSN) à des valeurs dans la normale ou proches de la normale au dernier contrôle de suivi. L’indépendance des transfusions a été atteinte chez environ un tiers des participants dans les deux groupes (35,9 % vs 31,2 %). Les changements des pourcentages de participants rapportant au médecin la survenue de symptômes associés à l’HPN (p.ex. douleurs abdominales, dysphagie, dyspnée) étaient également similaires dans les deux groupes. Les patients plus jeunes ont toutefois présenté des augmentations significativement supérieures du taux d’hémoglobine au dernier contrôle par rapport à la valeur initiale (1,4 g/dl vs 0,4 g/dl; p < 0,0001). Des événements vasculaires majeurs se sont produits significativement plus souvent dans la cohorte âgée, bien que les deux cohortes aient présenté pour ce critère des changements similaires entre la valeur initiale et le dernier contrôle.
Les infections ont été rares de façon similaire dans les deux cohortes. Il y a eu un plus grand pourcentage de décès dans le groupe âgé, mais ces décès étaient généralement sans rapport avec le traitement par l’éculizumab. Les auteurs ont conclu que l’éculizumab est un traitement efficace et bien toléré de l’HPN chez les patients âgés dans les conditions de la vie réelle.
Danicopan: effet sur les besoins de transfusion
Le danicopan, un inhibiteur du facteur D administré par voie orale, bloque la formation de C3 convertase et pourrait ainsi contrôler l’hémolyse intravasculaire et extravasculaire. Une étude de phase II de preuve du concept et de détermination de la dose optimale de danicopan lors d’une utilisation en ajout au traitement en cours de l’HPN par l’éculizumab chez des patients présentant une réponse inadéquate à l’éculizumab et continuant à dépendre de transfusions. Sur 12 patients ayant complété le traitement, 11 ont atteint des améliorations significatives des taux d’hémoglobine, des besoins de transfusion et d’autres paramètres [12].
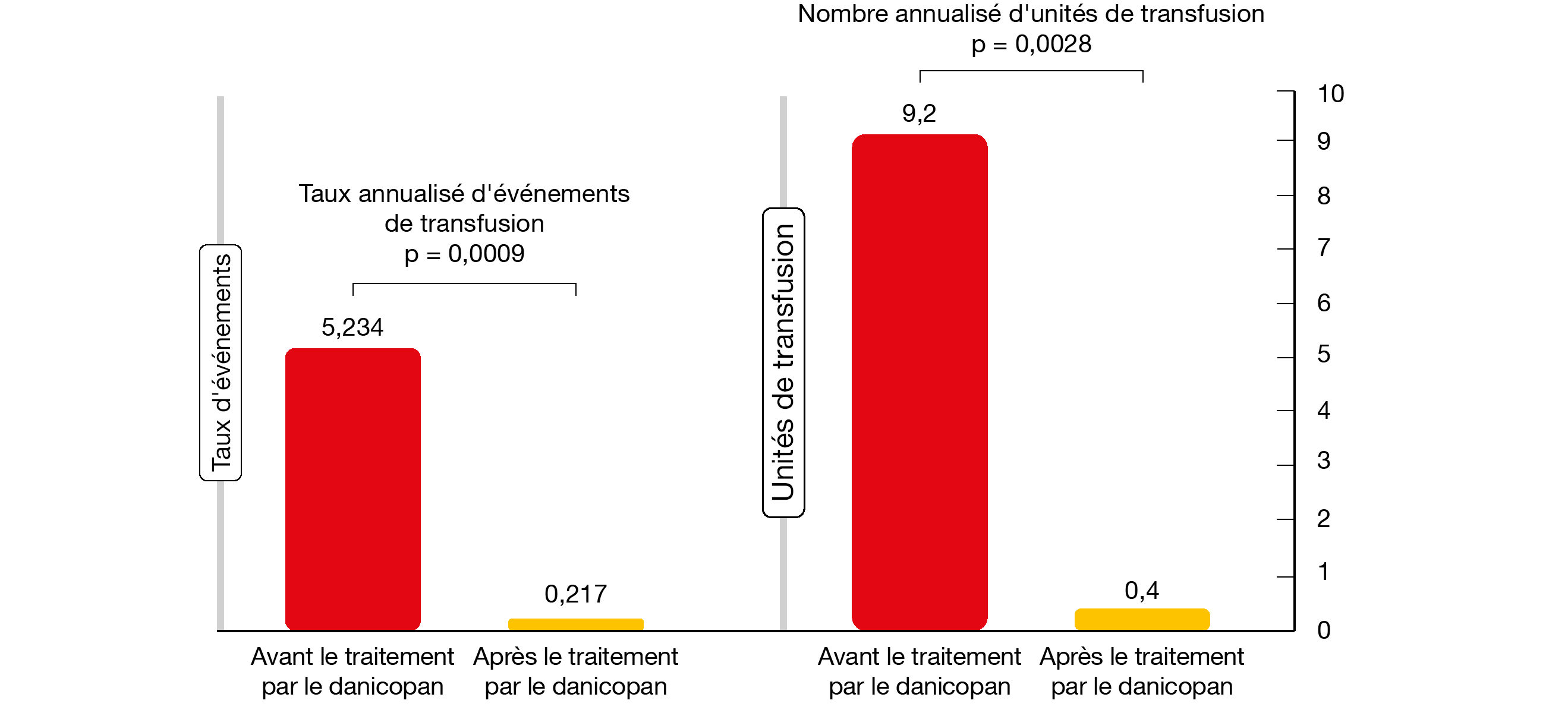
Une analyse post hoc de cette étude, présentée à l’EHA 2020, a évalué l’impact de l’ajout de danicopan sur les besoins de transfusion [13]. Au cours de 24 semaines, le taux d’hémoglobine est passé de 7,9 g/dl à 10,3 g/dl et la fréquence des transfusions a baissé de façon hautement significative en mesure de 95,8 % (p = 0,0009; Figure 2). C’était le cas aussi pour le nombre d’unités d’érythrocytes transfusées (p = 0,0028). Ainsi que l’ont remarqué les auteurs, le bénéfice supplémentaire est probablement dû à la prévention de l’hémolyse extravasculaire due au C3. Le danicopan a globalement été bien toléré. Presque tous les EI apparus sous le traitement étaient légers ou modérés, à l’exception d’un cas d’hémolyse malgré le traitement et un cas de pneumonie sévère chez un patient qui avait des antécédents de neutropénie.
Figure 2: Impact du danicopan sur les besoins annualisés de transfusion
Formule de ravulizumab à longue durée d’action
Le ravulizumab, un inhibiteur de C5 conçu pour une administration intraveineuse, devient un traitement de référence de l’HPN dans les pays où il a été homologué. La longue durée d’action de ce médicament permet une moindre fréquence des perfusions, avec des intervalles d’administration de 8 semaines. Le ravulizumab 10 mg/ml a prouvé son efficacité et sa sécurité dans deux grandes études de phase III [14, 15]. Sur la base de l’observation qu’une formule de 100 mg/ml réduit le temps de perfusion en mesure de 78 à 102 minutes par rapport à la formule de 10 mg/ml, une étude de phase II en ouvert avait évalué plusieurs doses croissantes de ravulizumab chez des patients atteints d’HPN et naïfs d’inhibiteurs du complément. 25 patients ont été répartis en 4 cohortes pour recevoir des doses d’entretien de ravulizumab de 1000 mg/4 semaines, 1600 mg/6 semaines, 2400 mg/8 semaines ou 5400 mg/12 semaines. Après la période de traitement initiale, les cohortes 1 à 3 sont passées à la phase d’extension encore en cours, pendant laquelle ces patients reçoivent des doses en fonction de leur poids. Toutes les cohortes ont commencé par le ravulizumab 10 mg/ml et sont passés à 100 mg/ml pendant la période d’extension.
L’analyse intermédiaire a révélé que le ravulizumab 100 mg/ml est similaire au ravulizumab 10 mg/ml en ce qui concerne l’efficacité, la sécurité, la pharmacocinétique et l’immunogénicité [16]. Dans toutes les cohortes, les taux de LDH n’ont pas significativement changé après la modification du traitement. Les EI survenus au cours du traitement étaient en accord avec le profil de sécurité établi du ravulizumab 10 mg/ml. Aucune toxicité n’a exigé une interruption ou un arrêt définitif du traitement. De même, les concentrations à la fin de l’intervalle d’administration n’étaient pas significativement différentes après la modification du traitement et aucune des formules n’a provoqué l’apparition d’anticorps dirigés contre le médicament. Par rapport à la formule de 10 mg/ml, les temps de perfusion étaient réduits en mesure de 78 à 102 minutes. Les investigateurs ont conclu que le ravulizumab 100 mg/ml permet une réduction de 60 à 77 % du temps de perfusion sans perdre en efficacité, et réduit ainsi les contraintes du traitement pour les patients, leurs soignants et leurs médecins.
Le pozélimab, un inhibiteur novateur de C5
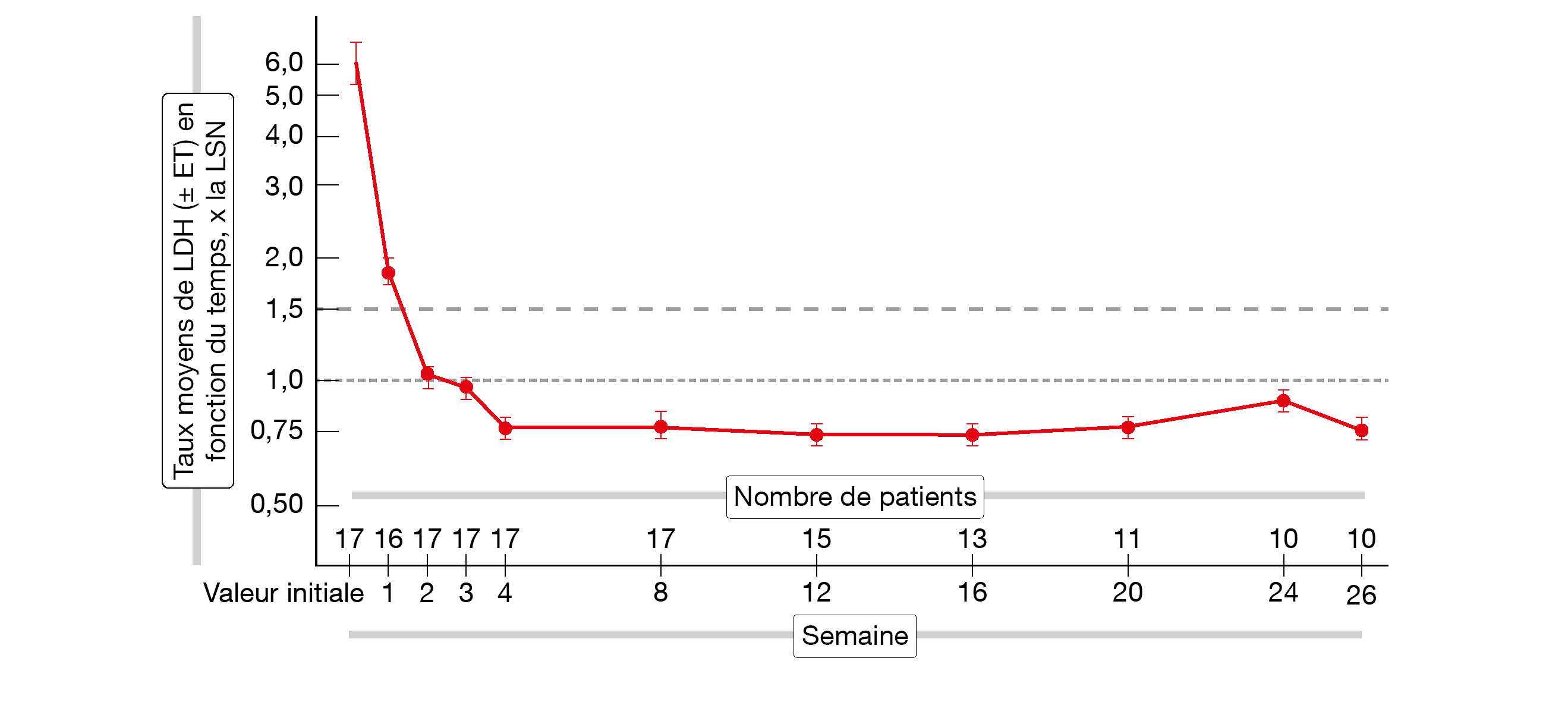
Une étude de phase II en cours, réalisée en ouvert avec un seul bras d’étude, évalue l’inhibiteur de C5 pozélimab chez des patients atteints d’HPN active qui sont naïfs de tout traitement par un inhibiteur du complément ou n’ont reçu récemment aucun inhibiteur du complément [17]. Le pozélimab est administré par voie sous-cutanée une fois par semaine pendant 26 semaines. Une analyse intermédiaire portant sur 17 patients a montré que le pozélimab a conduit à des réponses rapides et durables du taux de LDH (Figure 3). Celui-ci a baissé chez tous les patients à un niveau inférieur au seuil cliniquement significatif de ≤1,5x la LSN et cette réduction s’est maintenue jusqu’au jour 183 de l’étude. 16 personnes ont atteint le contrôle de l’hémolyse intravasculaire (LDH, ≤1,5x la LSN) en l’espace de 2 semaines et la normalisation du taux de LDH (≤1,0x la LSN) a été observée à 4 semaines chez tous les patients sauf un. Fait important: un patient porteur d’une variante de C5 connue pour résister au blocage par l’éculizumab/ravulizumab a atteint une normalisation rapide et persistante du taux de LDH. Les taux d’hémoglobine ont augmenté sur 26 semaines, ce qui s’est traduit aussi par une amélioration du score FACIT de fatigue. Le pozélimab a été bien toléré. On n’a observé aucun EI sérieux, aucun EI causant un arrêt du traitement et aucun événement d’hémolyse malgré le traitement. Les EI les plus fréquemment rapportés étaient des maux de tête et des nausées.
Selon les investigateurs, ces données intermédiaires sont en faveur de la poursuite du développement du pozélimab pour le traitement des patients atteints d’HPN, et éventuellement des patients atteints d’autres maladies dues au complément. Les résultats indiquent qu’un traitement par voie sous-cutanée peut offrir une alternative aux traitements intraveineux actuellement disponibles.
Figure 3: réduction rapide et persistante des taux de LDH sous pozélimab
Références
- Takeda J et al., Deficiency of the GPI anchor caused by a somatic mutation of the PIGA gene in paroxysmal nocturnal hemoglobinuria. Cell 1993: 73:703-711
- Bessler M et al., Paroxysmal nocturnal haemoglobinuria (PNH) is caused by somatic mutations in the PIG-A gene. EMBO J 1994; 13: 110-117
- Miyata T et al., Abnormalities of PIG-A transcripts in granulocytes from patients with paroxysmal nocturnal hemoglobinuria. N Engl J Med 1994: 330: 249-255
- Brodsky RA, Paroxysmal nocturnal hemoglobinuria. Blood 2014; 124(18): 2804-2811
- Hillmen P et al., The complement inhibitor eculizumab in paroxysmal nocturnal hemoglobinuria. N Engl J Med 2006; 355: 1233-1243
- Brodsky RA et al., Multicenter phase 3 study of the complement inhibitor eculizumab for the treatment of patients with paroxysmal nocturnal hemoglobinuria. Blood 2008; 111: 1840-1847
- Risitano AM et al., Complement fraction 3 binding on erythrocytes as additional mechanism of disease in paroxysmal nocturnal hemoglobinuria patients treated by eculizumab. Blood 2009; 113: 4094-4100
- Risitano AM et al, Anti-complement treatment for paroxysmal nocturnal hemoglobinuria: time for proximal complement inhibition? A position paper from the SAAWP of the EBMT. Front Immunol 2019; 10: 1157
- Risitano AM et al., Peptide inhibitors of C3 activation as a novel strategy of complement inhibition for the treatment of paroxysmal nocturnal hemoglobinuria. Blood 2014; 123(13): 2094-2101
- Hillmen P et al., Results of the PEGASUS phase 3 randomized trial demonstrating superiority of the C3 inhibitor, pegcetacoplan, compared to eculizumab in patients with paroxysmal nocturnal hemoglobinuria. EHA 2020, abstract S192
- Lee JW et al., Effectiveness of eculizumab treatment in patients aged ≥ 65 years with paroxysmal nocturnal hemoglobinuria (PNH): results from the International PNH Registry. EHA 2020, abstract EP853
- Kulasekararaj A et al., A phase 2 open-label study of danicopan (ACH-0144471) in patients with paroxysmal nocturnal hemoglobinuria (PNH) who have an inadequate response to eculizumab monotherapy. Blood (2019) 134 (Supplement_1): 3514
- Kulasekararaj A et al., Effects of oral, factor D inhibitor danicopan on transfusion rates in transfusion-dependent paroxysmal nocturnal hemoglobinuria (PNH) patients with an inadequate response to eculizumab: phase 2 study. EHA 2020, EP855
- Lee JW et al., Ravulizumab (ALXN1210) vs eculizumab in adult patients with PNH naive to complement inhibitors: the 301 Study. Blood 2019; 133(6): 530-539
- Kulasekararaj AG et al., Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor-experienced adult patients with PNH: the 302 study. Blood 2019; 133(6): 540-549
- Röth A et al., An interim analysis of a phase 2 study evaluating the efficacy, safety, and pharmacokinetics of intravenous ravulizumab 100 mg/mL formulation in patients with paroxysmal nocturnal hemoglobinuria. EHA 2020, abstract EP862
- Jang JH et al., Pozelimab inhibits hemolysis in patients with paroxysmal nocturnal hemoglobinuria. EHA 2020, abstract EP860
© 2019 Springer-Verlag GmbH, Impressum