Maladie des agglutinines froides: vers de nouveaux acquis et de nouvelles options thérapeutiques possibles
La maladie des agglutinines froides (MAF) est un type rare d’anémie hémolytique auto-immune (AHAI) dû à des anticorps sensibles au froid tels que les agglutinines froides. 90 % des agglutinines froides sont de type IgM kappa; elles se fixent aux antigènes de surface des globules rouges à des températures ≤37 °C et induisent ainsi une hémolyse [1-3]. La MAF correspond à ~25 % des cas d’AHAI, avec une incidence de 1 cas sur un million de personnes par an et une prévalence de 16 cas sur un million de personnes [4, 5].
Le type primaire de cette maladie est une condition chronique généralement associée à une légère lymphoprolifération, affectant typiquement des adultes relativement âgés (l’âge médian au début de la maladie est de 67 ans) [4, 5]. La MAF secondaire – également appelée syndrome des agglutinines froides (SAF) – se développe sur le terrain de conditions sous-jacentes telles qu’un cancer ou une infection aiguë [5, 6]. L’AHAI mixte à anticorps chauds et froids est un trouble apparenté [5].
Les patients atteints de la MAF ont un lourd fardeau de souffrance. Les complexes IgM-antigène activent l’hémolyse extravasculaire et (à un moindre degré) l’hémolyse intravasculaire dépendantes du complément, ce qui cause une anémie et un état de fatigue invalidant [7, 8]. Le risque de thromboembolies est accru et la mortalité en 5 ans est supérieure à celle des personnes de contrôle comparables [9, 10]. Il n’existe toujours pas de traitement approuvé de la MAF. Les approches actuelles telles que les traitements ciblant les lymphocytes B et les chimiothérapies n’obtiennent que de faibles taux de réponse et peuvent causer une toxicité importante [6, 11].
Le registre CADENCE
En raison de la rareté de la MAF, on manque de données prospectives longitudinales décrivant les caractéristiques des patients, les caractéristiques cliniques et les résultats. Cette lacune sera comblée par le registre CADENCE. Ce registre observationnel, non interventionnel, multicentrique, prospectif et longitudinal a été commencé en décembre 2019 [12]. Dans 121 sites de 11 pays du monde, incluant les États-Unis, la France, le Royaume-Uni, l’Allemagne, l’Autriche, le Japon et l’Australie, il collectionne les données de plus de 700 adultes âgés d’au moins 18 ans qui sont atteints de la MAF, du SAF ou d’une AHAI mixte à anticorps chauds et froids. La période de recrutement sera complétée fin 2021 et les patients seront suivis jusque fin 2024.
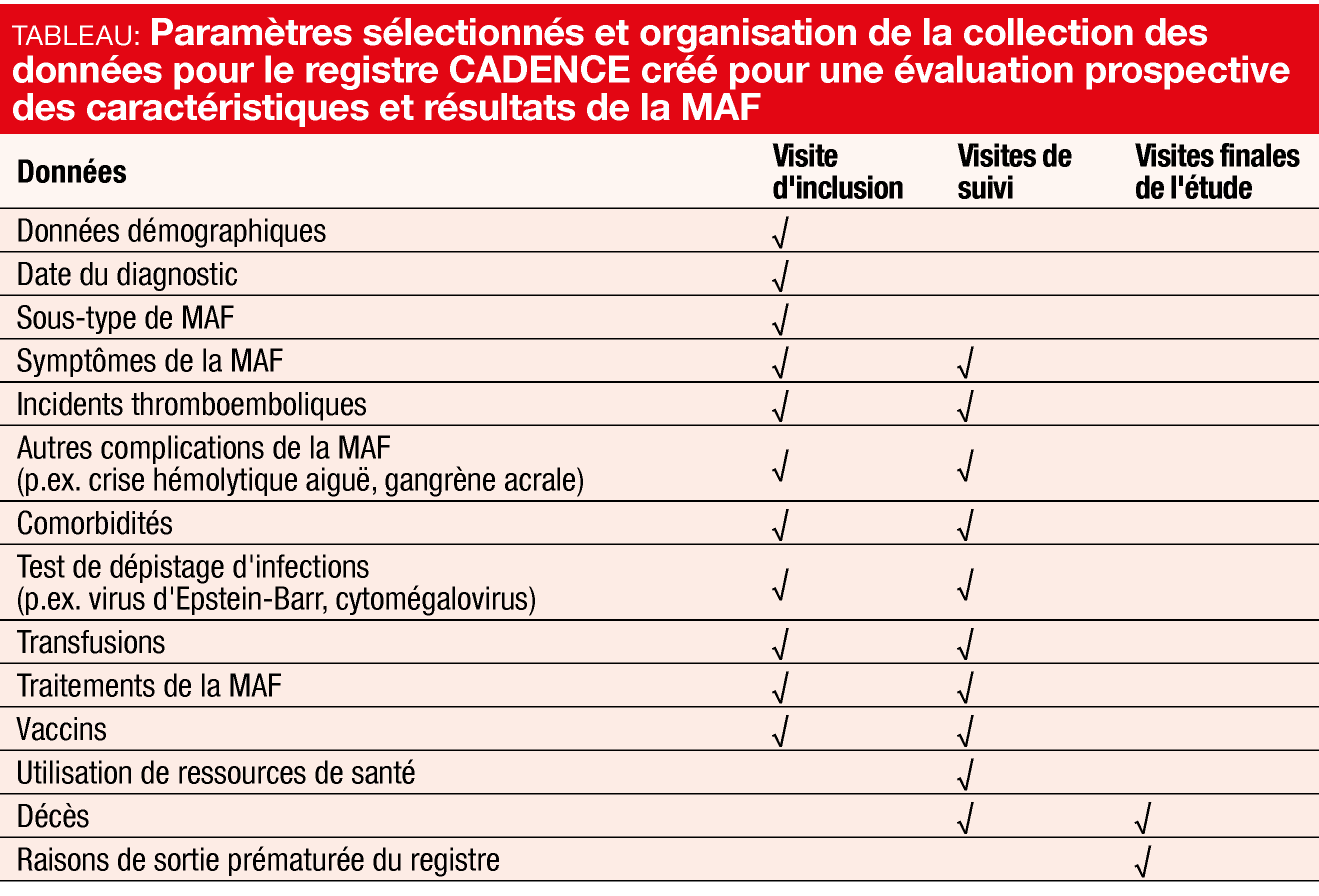
Les objectifs de ce registre sont de mieux comprendre les caractéristiques des patients et les caractéristiques cliniques, les configurations et utilisations des traitements de la MAF, les résultats cliniques à long terme, la qualité de vie des patients en rapport avec la santé et l’utilisation des ressources de santé (Tableau). La biologie de la MAF, de ses complications et de ses comorbidités sera également explorée. Des analyses intermédiaires seront menées après le recrutement de 100, de 250 et de 500 patients.
Données de l’étude CARDINAL sur la qualité de vie
Le sutimlimab, premier agent de la classe des anticorps monoclonaux humanisés anti-C1, est actuellement étudié pour le traitement des patients atteints de la MAF. En inhibant la sérine protéase C1s du complexe C1, le sutimlimab empêche les dommages tissulaires dus au complément et prévient l’activation à long terme des lymphocytes B auto-immuns ainsi que la production d’auto-anticorps [13]. L’étude multicentrique de phase III CARDINAL, réalisée en ouvert avec un seul bras d’étude, a évalué l’efficacité et la sécurité du sutimlimab chez des patients atteints de la MAF qui présentaient des taux initiaux d’hémoglobine ≤10 g/dl et une hémolyse active (bilirubine supérieure à la normale) et avaient reçu au moins une transfusion de sang au cours des 6 mois précédant leur inclusion à l’étude. La phase A de l’étude a évalué l’efficacité et la sécurité du sutimlimab administré par voie ntraveineuse les jours 0 et 7 aux doses de 6,5 g (poids corporel <75 kg) ou de 7,5 g (≥75 kg), puis aux mêmes doses toutes les 2 semaines pendant une période totale de 26 semaines. La phase B est une extension de l’étude à long terme; elle est actuellement encore en cours.
Les résultats concernant la qualité de vie liée à la santé étaient des critères d’évaluation secondaires de l’étude. Roth et al. ont rapporté les résultats concernant ce critère dans le cadre du congrès de 2020 de l’EHA [14]. Les échelles d’évaluation utilisées ont inclus FACIT-F (Functional Assessment of Chronic Illness Therapy-Fatigue), SF-12 (12-Item Short Form Health Survey), EQ-5D (EuroQoL 5D Index and visual analog scale scores), PGIC (Patient Global Impression of Change) et PGIS (Patient Global Impression of (Fatigue) Severity). Les patients (n = 24) avaient un âge moyen de 71 ans et étaient en majorité des femmes (62,5 %). Ils avaient reçu en moyenne 3,2 transfusions au cours des 6 mois précédant l’étude. La majorité avait été traitée par au moins un traitement ciblé de la MAF au cours des 5 dernières années. Un tiers avait déjà eu au moins un incident thromboembolique.
Améliorations rapides et durables
L’étude a montré que le traitement par le sutimlimab a causé des améliorations rapides et cliniquement significatives de tous les paramètres évalués rapportés par les patients. Presque 90 % des patients ont atteint une amélioration cliniquement significative (augmentation de ≥3 points) du score FACIT-F. Ce changement s’est produit en l’espace d’une semaine après le début du traitement et était associé à une inhibition de la voie classique du complément telle que mesurée à l’aide du test Wieslab-CP et par détermination des taux de C4. De façon similaire, les améliorations des scores SF-12 étaient en corrélation avec une inhibition presque totale de la voie du complément et avec une normalisation de C4. Ces observations suggèrent qu’en plus de l’anémie, une activation de la voie du complément avec hémolyse consécutive est une cause majeure de la fatigue et de la mauvaise qualité de vie des patients atteints de la MAF.
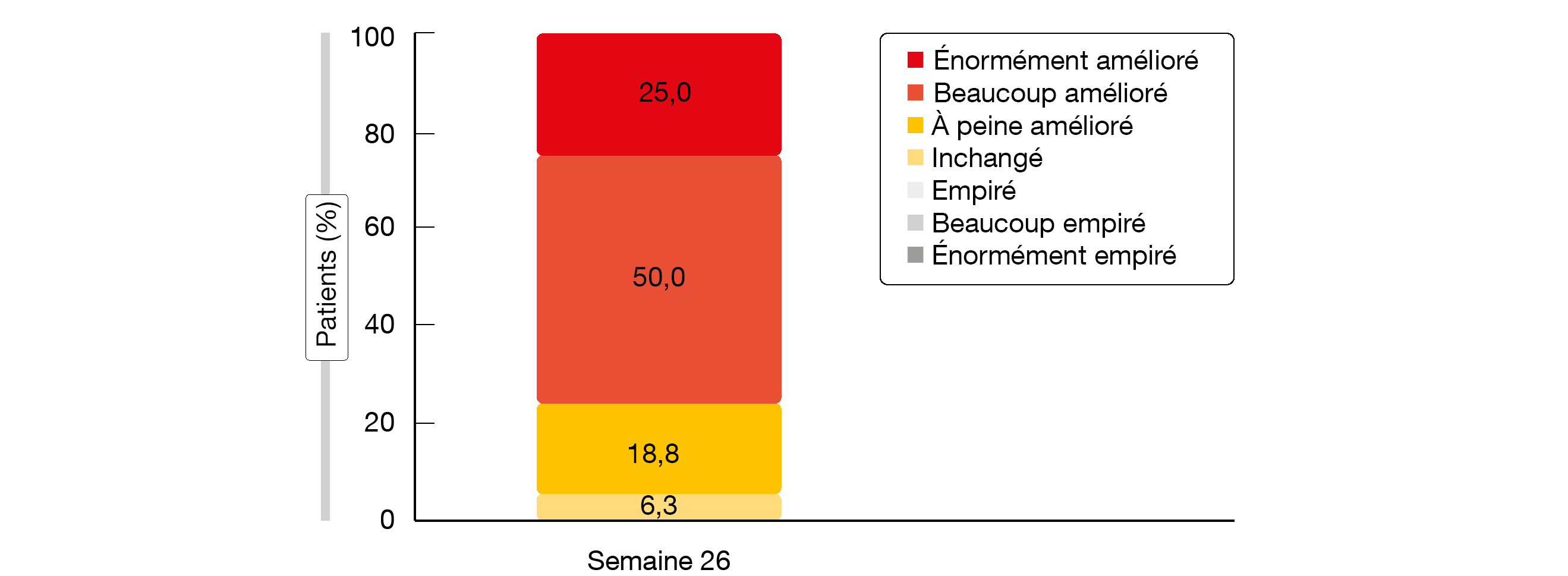
Des augmentations cliniquement significatives de la partie physique et de la partie mentale de l’échelle SF-12 ont été observées à 5 semaines et se sont révélées persistantes. L’indice EQ-5D et les scores à l’EVA de l’EQ-5D ont augmenté de 0,074 et de 16,8 respectivement jusqu’à la semaine 26. Des améliorations ont été observées pour chaque domaine de l’EQ-5D; les problèmes modérés, sévères ou extrêmes concernant la mobilité, les soins auto-administrés, les activités usuelles, la douleur/l’inconfort et l’anxiété/la dépression ont diminué au cours de l’étude. À l’échelle PGIC, 93,8 % des patients ont remarqué une amélioration globale jusqu’à la semaine 26 (Figure). 75 % ont remarqué une forte ou très forte amélioration de leur état.
La fatigue était légère ou modérée chez 88,2 % des patients la semaine 26 d’après l’échelle PGIS, par rapport à 11,8 % dont l’état était inchangé. Un total de 83,3 % des patients avait initialement rapporté une fatigue, sévère dans un tiers des cas. Aucun patient n’a subi une détérioration de son état général ou une fatigue sévère à la fin du traitement. Au total, ces résultats viennent s’ajouter à l’édifice en faveur d’un ciblage de la voie classique du complément dans la prise en charge des patients atteints de la MAF.
Figure: PGIC (Patient Global Impression of Change): résultats rapportés par les patients à la fin
de la période de 26 semaines de traitement par le sutimlimab
REFERENCES
- Berentsen S et al., Primary chronic cold agglutinin disease: an update on pathogenesis, clinical features and therapy. Hematology 2007; 12(5): 361-370
- Berentsen S et al., Cold agglutinin-mediated autoimmune hemolytic anemia. Hematol Oncol Clin North Am 2015; 29(3): 455-471
- Gertz MA, Management of cold haemolytic syndrome. Br J Haematol 2007; 138(4): 422-429
- Berentsen S et al., Primary chronic cold agglutinin disease: a population based clinical study of 86 patients. Haematologica 2006; 91(4): 460-466
- Berentsen S et al., Diagnosis and treatment of cold agglutinin mediated autoimmune hemolytic anemia. Blood Reviews 2012; 26(3): 107-115
- Jäger U et al., Diagnosis and treatment of autoimmune hemolytic anemia in adults: recommendations from the first international consensus meeting. Blood Rev 2020; 41: 100648
- Berentsen S, Sundic T, Red blood cell destruction in autoimmune hemolytic anemia: role of complement and potential new targets for therapy. Biomed Res Int 2015; 2015: 363278
- Swiecicki PL et al., Cold agglutinin disease. Blood 2013; 122(7): 1114-1121
- Broome CM et al., Increased risk of thrombotic events in cold agglutinin disease: a 10-year retrospective analysis. Res Pract Thromb Haemost 2020; 4(4): 628-635
- Bylsma LC et al., Occurrence, thromboembolic risk, and mortality in Danish patients with cold agglutinin disease. Blood Adv 2019; 3(20): 2980-2985
- Berentsen S, How I manage patients with cold agglutinin disease. Br J Haematol 2018; 181(3): 320-330
- Röth A et al., Cold Agglutinin Disease Real World Evidence (CADENCE) Registry: design of the first international, prospective CAD Registry. EHA 2020, abstract EP1618
- Nikitin PA et al., C1s inhibition by BIVV009 (sutimlimab) prevents complement-enhanced activation of autoimmune human B cells in vitro. J Immunol 2019; 202(4): 1200-1209
- Röth A et al., Sutimlimab, a complement C1s inhibitor, improves quality of life in patients with cold agglutinin disease: patient-reported outcomes results of the phase 3 Cardinal study. EHA 2020, abstract S333
© 2019 Springer-Verlag GmbH, Impressum