Kälteagglutininkrankheit: auf dem Weg zu neuen Einblicken und potenziellen Therapieoptionen
Die Kälteagglutininkrankheit (cold agglutinin disease; CAD) ist eine seltene Form der autoimmunhämolytischen Anämie (AIHA), die durch Kälteantikörper einschließlich Kälteagglutininen ausgelöst wird. 90% der Kälteagglutinine gehören zum Typ IgM kappa und binden bei ≤ 37 °C an Erythrozytenoberflächenantigene, wodurch eine Hämolyse induziert wird [1-3]. Die CAD macht ca. 25% aller AIHA-Fälle aus; die Inzidenz beträgt 1/1.000.000 jährlich, die Prävalenz 16/1.000.000 [4, 5].
Die primäre CAD ist eine chronische Erkrankung, die für gewöhnlich mit geringgradiger Lymphoproliferation assoziiert ist, und tritt typischerweise bei älteren Erwachsenen auf (medianes Alter: 67 Jahre) [4, 5]. Als Kälteagglutininsyndrom (cold agglutinin syndrome; CAS) wird die sekundäre CAD bezeichnet, die auf der Basis von Malignomen, akuten Infektionen und anderen Vorerkrankungen entsteht [5, 6]. Als assoziierte Erkrankung findet sich eine Mischform der AIHA mit Wärme- und Kälte-Autoantikörpern [5].
Patienten mit CAD erfahren eine hohe Belastung durch ihre Krankheit. IgM-Antigenkomplexe aktivieren die komplementabhängige extravaskuläre und – in geringerem Ausmaß – auch die intravaskuläre Hämolyse, was zu Anämie und lähmender Fatigue führt [7, 8]. Das Thromboembolierisiko ist erhöht, und die 5-Jahres-Mortalität übersteigt jene gematchter Kontrollpersonen [9, 10]. Zugelassene Therapien bei CAD stehen noch aus. Aktuelle Ansätze wie B-Zell-gerichtete Behandlungen und Chemotherapien bedingen lediglich niedrige Ansprechraten und können substanzielle Toxizitäten hervorrufen [6, 11].
Das CADENCE-Register
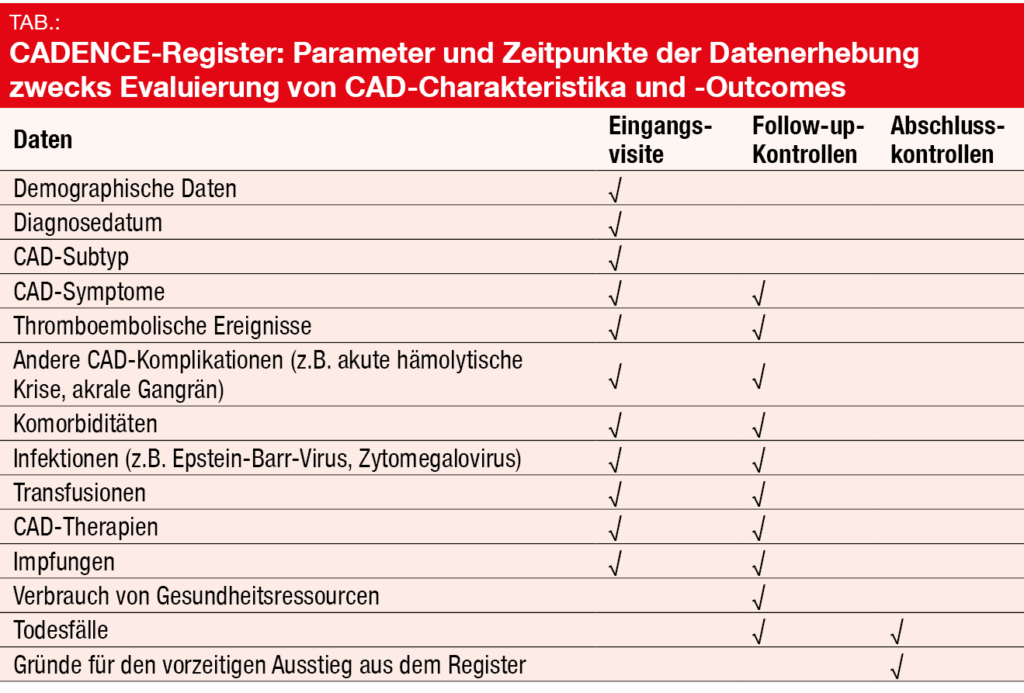
In Anbetracht der Seltenheit der CAD besteht ein Mangel an prospektiven Langzeitdaten zu patientenbezogenen und klinischen Charakteristika sowie klinischen Ergebnissen. Diese Lücke wird durch das im Dezember 2019 initiierte CADENCE-Register, eine nicht-interventionelle, multizentrische, prospektive, longitudinale Beobachtungsstudie, geschlossen werden [12]. An 121 Zentren in 11 Ländern weltweit (USA, Frankreich, UK, Deutschland, Österreich, Japan, Australien) werden die Daten von mehr als 700 Erwachsenen im Alter von ≥ 18 Jahren mit CAD, CAS oder der Wärmetyp/Kältetyp-Mischform der AIHA gesammelt. Die Rekrutierungsphase wird Ende 2021 auslaufen, und die Patienten werden bis Ende 2024 nachbeobachtet.
Die Zielsetzungen dieses Registers umfassen ein besseres Verständnis der patientenbezogenen und klinischen Charakteristika, Verwendungsmuster und Einsatz von CAD-Therapien, klinischer Langzeitergebnisse, der gesundheitsbezogenen Lebensqualität sowie des Verbrauchs von Gesundheitsressourcen (s. Tab.). Ebenso wird der natürliche Krankheitsverlauf der CAD inklusive Komplikationen und Komorbiditäten untersucht. Interimsanalysen werden nach der Einbringung von 100, 250 und 500 Patienten durchgeführt werden.
Lebensqualitätsdaten aus der Cardinal-Studie
Der neuartige, humanisierte monoklonale Anti-C1s-Antikörper Sutimlimab wird derzeit in der Therapie von CAD-Patienten evaluiert. Sutimlimab blockiert durch die Inhibition der C1s-Serinprotease des C1-Komplexes den komplementvermittelten Gewebeschaden und unterbindet somit die Langzeitaktivierung autoimmuner B-Zellen sowie die Bildung von Autoantikörpern [13].
Die Cardinal-Studie, eine offene, einarmige, multizentrische Phase-III-Untersuchung, prüfte die Wirksamkeit und Sicherheit von Sutimlimab bei CAD-Patienten mit Hämoglobin-Ausgangswerten ≤ 10 g/dl und aktiver Hämolyse (d.h. erhöhtes Gesamtbilirubin), die innerhalb von 6 Monaten vor der Rekrutierung zumindest eine Bluttransfusion erhalten hatten. Teil A der Studie untersuchte die Wirksamkeit und Sicherheit von Sutimlimab 6,5 g (Körpergewicht < 75 kg) oder 7,5 g (≥ 75 kg) intravenös an den Tagen 0 und 7 gefolgt von denselben Dosierungen alle 2 Wochen über insgesamt 26 Wochen. Teil B ist eine im Laufen befindliche Langzeit-Extensionsstudie.
Ergebnisse zur gesundheitsbezogenen Lebensqualität bildeten die sekundären exploratorischen Endpunkte der Studie. Röth et al. stellten diese Outcomes am EHA-Kongress 2020 vor [14]. Als Messinstrumente gelangten u.a. die Functional Assessment of Chronic Illness Therapy-Fatigue(FACIT-F)-Skala, der 12-Item Short Form Health Survey (SF-12), der EuroQoL (EQ)-5D Index und die visuelle Analogskala (VAS), die Patient Global Impression of Change(PGIC)-Skala sowie die Patient Global Impression of (Fatigue) Severity(PGIS)-Skala zum Einsatz. Die Patienten (n = 24) waren im Mittel 71 Jahre alt und mehrheitlich weiblich (62,5%). In den vorausgegangenen 6 Monaten hatten sie im Mittel 3,2 Transfusionen erhalten.
Der Großteil war im Verlauf der vergangenen 5 Jahre zumindest mit einer gezielten CAD-Therapie behandelt worden. Ein Drittel wies zumindest ein thromboembolisches Ereignis in der Anamnese auf.
Rasche und dauerhafte Verbesserungen
Die Behandlung mit Sutimlimab bewirkte rasche und klinisch bedeutsame Verbesserungen aller evaluierten PROs (patient-reported outcomes). Bei nahezu 90% der Patienten wurde eine klinisch bedeutsame Verbesserung (≥ 3 Punkte) des FACIT-F-Score erzielt. Diese Veränderung trat bereits innerhalb einer Woche nach Therapiebeginn ein und ging laut Wieslab-CP-Assay und Messung der C4-Spiegel mit einer Inhibition des klassischen Komplementwegs einher. Ebenso korrelierte die Verbesserung der SF-12-Werte mit einer nahezu kompletten Inhibition des Komplementwegs und einer C4-Normalisierung. Diese Beobachtungen legen nahe, dass die Aktivierung des Komplementwegs mit der nachfolgenden Hämolyse zusätzlich zur Anämie ein entscheidender Verursacher von Fatigue und herabgesetzter Lebensqualität bei CAD-Patienten ist.
Klinisch bedeutsame Zuwächse in den physischen sowie auch psychischen Komponenten des SF-12 wurden in der Woche 5 beobachtet und erwiesen sich als dauerhaft. Der EQ-5D-Index und die EQ-5D-VAS-Scores nahmen bis zur Woche 26 um 0,074 bzw. 16,8 zu. Verbesserungen wurden für alle EQ-5D-Domänen beobachtet; leichte, schwere und extreme Probleme hinsichtlich Mobilität, Selbstversorgung, alltäglichen Tätigkeiten, Schmerz/körperlichen Beschwerden und Angst/Niedergeschlagenheit verringerten sich im Studienverlauf. Im Bezug auf die PGIC-Skala resultierte bei 93,8% der Patienten eine allgemeine Verbesserung bis zur Woche 26 (s. Abb.). 75% gaben an, dass ihr Zustand sich stark oder sehr stark verbessert hatte. Laut PGIS-Skala lag Fatigue bei 88,2% der Patienten in Woche 26 nur in leichter oder mäßiger Ausprägung vor, während die verbleibenden 11,8% über keine Veränderungen berichteten. Zu Behandlungsbeginn hatten insgesamt 83,3% der Patienten Fatigue angegeben, die in einem Drittel der Fälle schwer war. Bei Studienende war bei keinem Patienten eine Verschlechterung des Allgemeinzustands oder schwerwiegende Fatigue eingetreten. Insgesamt sprechen diese Ergebnisse für die Wirksamkeit einer CAD-Therapie, die am klassischen Komplementweg ansetzt.
Abb.: Patient Global Impression of Change (PGIC): deutliche Verbesserung nach der 26-wöchigen Sutimlimab-Therapie laut Patientenangaben
REFERENCES
- Berentsen S et al., Primary chronic cold agglutinin disease: an update on pathogenesis, clinical features and therapy. Hematology 2007; 12(5): 361-370
- Berentsen S et al., Cold agglutinin-mediated autoimmune hemolytic anemia. Hematol Oncol Clin North Am 2015; 29(3): 455-471
- Gertz MA, Management of cold haemolytic syndrome. Br J Haematol 2007; 138(4): 422-429
- Berentsen S et al., Primary chronic cold agglutinin disease: a population based clinical study of 86 patients. Haematologica 2006; 91(4): 460-466
- Berentsen S et al., Diagnosis and treatment of cold agglutinin mediated autoimmune hemolytic anemia. Blood Reviews 2012; 26(3): 107-115
- Jäger U et al., Diagnosis and treatment of autoimmune hemolytic anemia in adults: recommendations from the first international consensus meeting. Blood Rev 2020; 41: 100648
- Berentsen S, Sundic T, Red blood cell destruction in autoimmune hemolytic anemia: role of complement and potential new targets for therapy. Biomed Res Int 2015; 2015: 363278
- Swiecicki PL et al., Cold agglutinin disease. Blood 2013; 122(7): 1114-1121
- Broome CM et al., Increased risk of thrombotic events in cold agglutinin disease: a 10-year retrospective analysis. Res Pract Thromb Haemost 2020; 4(4): 628-635
- Bylsma LC et al., Occurrence, thromboembolic risk, and mortality in Danish patients with cold agglutinin disease. Blood Adv 2019; 3(20): 2980-2985
- Berentsen S, How I manage patients with cold agglutinin disease. Br J Haematol 2018; 181(3): 320-330
- Röth A et al., Cold Agglutinin Disease Real World Evidence (CADENCE) Registry: design of the first international, prospective CAD Registry. EHA 2020, abstract EP1618
- Nikitin PA et al., C1s inhibition by BIVV009 (sutimlimab) prevents complement-enhanced activation of autoimmune human B cells in vitro. J Immunol 2019; 202(4): 1200-1209
- Röth A et al., Sutimlimab, a complement C1s inhibitor, improves quality of life in patients with cold agglutinin disease: patient-reported outcomes results of the phase 3 Cardinal study. EHA 2020, abstract S333
© 2020 Springer-Verlag GmbH, Impressum