Paroxysmale nächtliche Hämoglobinurie: verbesserte Ergebnisse durch neuartige Strategien
Die paroxysmale nächtliche Hämoglobinurie (PNH) ist eine seltene, potenziell lebensbedrohliche klonale Erkrankung der hämatopoetischen Stammzellen, welche durch hämolytische Anämie, Knochenmarksversagen, Thrombose und periphere Zytopenie gekennzeichnet ist. Sie entwickelt sich aus einer erworbenen Funktionsverlustmutation des PIGA-Gens, das an der Synthese der Glycosylphosphatidylinositol-verankerten Komplementinhibitoren CD55 und CD59 beteiligt ist [1-4]. Das Fehlen dieser Proteine führt zu einer unkontrollierten Aktivierung des terminalen Komplementwegs und einer komplementvermittelten Erythrozytenlyse. Die PNH geht mit einer hohen Krankheitslast und eingeschränkten gesundheitsbezogenen Lebensqualität einher [4].
Die Behandlungsoptionen bei hämolytischer PNH waren bis zur Verfügbarkeit des intravenös zu verabreichenden Wirkstoffs Eculizumab eingeschränkt. Eculizumab bindet an die Komponente 5 (C5) der Komplementkaskade an und beugt so der intravaskulären Hämolyse vor [5, 6]. Allerdings wurde lediglich bei einem Drittel der PNH-Patienten eine komplette Normalisierung der Hämoglobinspiegel unter Eculizumab beobachtet [7]. Viele Patienten leiden weiterhin an Anämien unterschiedlicher Schweregrade, und in einigen Fällen sind regelmäßige Erythrozytentransfusionen erforderlich. Die Faktoren, die zur residuellen Anämie beitragen, umfassen u.a. eine zugrundeliegende Knochenmarkdysfunktion, residuelle intravaskuläre Hämolyse sowie die Entstehung einer C3-vermittelten extravaskulären Hämolyse, welche nicht durch C5-Inhibitoren wie Eculizumab verbessert werden kann [8].
Aus diesem Grunde konzentrieren sich neuartige antikomplementäre Behandlungsansätze auf einige dieser Mechanismen. Die Strategien, die im Setting der proximalen Komplementinhibition untersucht werden, setzen u.a. an C3 sowie den Faktoren D und B an, die an der Bildung der C3-Konvertase auf dem alternativen Pfad beteiligt sind.
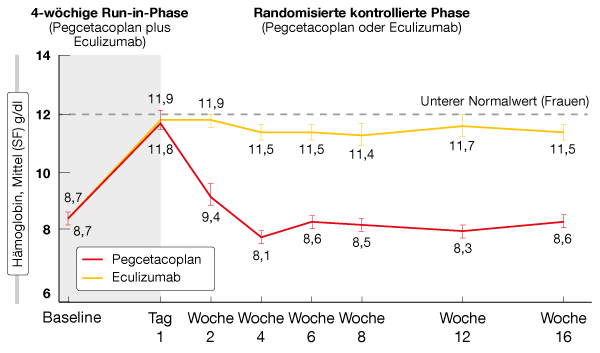
PEGASUS: Hämoglobinanstiege durch Pegcetacopan
Das in Entwicklung befindliche Präparat Pegcetacoplan ist ein subkutan verabreichter C3-Inhibitor, mit dem die intra- und extravaskuläre Hämolyse bei PNH kontrolliert werden kann [9]. Eine Monotherapie mit Pegcetacoplan wurde in der randomisierten, unverblindeten, kontrollierten Phase-III-Studie PEGASUS evaluiert, in die PNH-Patienten eingebracht wurden, die nach zumindest sechsmonatiger Eculizumabtherapie noch Hämoglobinspiegel < 10,5 g/dl aufwiesen [10]. Zusätzlich zu Eculizumab in der Standarddosis erhielten alle Patienten während der vierwöchigen Run-in-Phase Pegcetacoplan 1.080 mg zweimal wöchentlich. Anschließend wurden sie entweder einer Behandlung mit Pegcetacoplan in derselben Dosierung (n = 41) oder Eculizumab gemäß ihrem aktuellen Dosierungsschema (n = 39) randomisiert zugeteilt. Als primärer Endpunkt der Studie galt die Hämoglobinveränderung zwischen Baseline-Spiegel und der 16. Behandlungswoche. Zu diesem Zeitpunkt führten die Patienten in der Kontrollgruppe einen Crossover durch, sodass die gesamte Population über einen 32-wöchigen unverblindeten Zeitraum eine Monotherapie mit Pegcetacoplan erhielt.
Im Vergleich zum Behandlungsstandard ergab die experimentelle Therapie eine hochsignifikante Verbesserung der Hämogloblinspiegel mit einem bereinigten mittleren Behandlungsunterschied von 3,84 g/dl (p < 0,0001). Bei einem Hämoglobinausgangswert von 8,7 g/dl in beiden Gruppen bewirkte Pegcetacoplan einen Anstieg um 2,37 g/dl, während der Wert unter Eculizumab um 1,47 g/dl abnahm. Dieser Effekt war ungeachtet der Transfusionsanamnese (< 4 vs. ≥ 4 Transfusionsereignisse) zu beobachten. Die Kaplan-Meier-Schätzung zeigte, dass der Anstieg im Pegcetacoplan-Arm während der Run-in-Phase erreicht und anschließend beibehalten wurde, während er bei den Kontrollpatienten wieder verloren ging; hier fielen die Hämoglobinspiegel innerhalb von 4 Wochen nach der Randomisierung auf die Ausgangswerte ab (Abb. 1).
Abb. 1: Hämoglobinerhöhung in der PEGASUS-Studie: anhaltender Effekt unter Pegcetacoplan
und Verlust unter Eculizumab im Studienverlauf nach initialem Anstieg
Benefits hinsichtlich sekundärer Endpunkte
In Bezug auf die Vermeidung von Transfusionen, den wesentlichen sekundären Endpunkt, ergab die Analyse eine bereinigte Risikodifferenz von 62,5% zugunsten von Pegcetacoplan (85,4% vs. 15,4%). Dieser Vorteil war bei Patienten mit einer hohen Transfusionsnotwendigkeit in der Vorgeschichte besonders stark ausgeprägt (85,7% vs. 4,3%), er wurde aber auch bei jenen mit geringeren Raten an stattgehabten Transfusionen beobachtet (85,0% vs. 31,3%). Die Retikulozytenzahlen nahmen unter Pegcetacoplan um 136 x 109/l ab und unter Eculizumab um 28 x 109/l zu, woraus ein signifikanter Unterschied von 164 x 109/l resultierte. Eine Sensitivitätsanalyse ohne Zensur hinsichtlich der Transfusionen ergab, dass Pegcetacoplan zu einer Normalisierung der Lactatdehydrogenase (LDH)-, Retikulozytenund Bilirubinspiegel führte, während Eculizumab diese Werte kaum beeinflusste. Eine Normalisierung der Hämoglobinspiegel fand sich in 34% vs. 0%; in Bezug auf das LDH traf dies in 70,7% vs. 15,4% zu und im Hinblick auf die Retikulozytenzahlen in 78% vs. 2,6%. Auch zeigten Patienten im experimentellen Arm gemäß dem im gesamten Studienverlauf erfassten FACIT-Fatigue-Score geringere Fatigue. 73,2% erfuhren eine Verbesserung um ≥ 3 Punkte, während dies unter unter Eculizumab nicht der Fall war.
Unerwünschte Ereignisse (UEs) waren hauptsächlich von milder oder mäßiger Ausprägung. Im Bereich der UEs von besonderem Interesse traten Reaktionen an Injektionsstellen am häufigsten auf (36,6% unter Pegcetacoplan vs. 2,6% unter Eculizumab), wenngleich die Ereignisse mehrheitlich leicht und auf die initiale Behandlungsphase beschränkt waren. Abbrüche aufgrund von Durchbruchshämolysen wurden bei drei Patienten im experimentellen Arm beobachtet, wovon zwei vor den Ereignissen geringere Pegcetacoplan-Serumkonzentrationen aufwiesen als erwartet. Bei keinem der Patienten wurde vor Behandlungsabbruch die Dosierung auf 1.080 mg alle 3 Tage erhöht.
Insgesamt unterstreichen die Ergebnisse der PEGASUS-Studie die Fähigkeit der Pegcetacoplan-Therapie, bei Patienten mit PNH sowohl die intravaskuläre wie auch die extravaskuläre Hämolyse zu kontrollieren, woraus sich eine potenzielle neue Behandlungsoption ergibt.
Eculizumab: altersbezogene Aktivität
Lee et al. präsentierten eine Analyse der klinischen Ergebnisse einer Eculizumab-Therapie bei Patienten im Alter von ≥ 65 Jahren, die im Internationalen PNH-Register inkludiert waren [11]. Dieses Register ist eine im Laufen befindliche prospektive, internationale Studie zum natürlichen Verlauf der PNH und zur Langzeitwirksamkeit und -sicherheit von Eculizumab. In der aktuellen Auswertung wurden erwachsene Patienten im Alter zwischen 18 und 64 Jahren (n = 1.537) mit Registerteilnehmern fortgeschritteneren Alters (n = 270) verglichen.
Die Resultate legen eine altersunabhängige Wirksamkeit von Eculizumab hinsichtlich der Reduktion intravaskulärer Hämolysen, des Erreichens einer Transfusionsunabhängigkeit sowie der Prävention thrombotischer Ereignisse und schwerwiegender vaskulärer UEs nahe. Patienten in beiden Gruppen erfuhren substanzielle Reduktionen der LDH-Ratio, die zu Beginn mehr als das Fünffache des ONW (oberen Normalwerts) betrug, auf normale bzw. nahezu normale Werte zum Zeitpunkt der letzten Kontrolluntersuchung. Eine Transfusionsunabhängigkeit erzielten beide Gruppen zu je etwa einem Drittel (35,9% vs. 31,2%). Auch die Anteile der Patienten mit PNH-bezogenen Symptomen laut Angabe der Ärzte (z.B. Bauchschmerzen, Schluckstörungen, Atembeschwerden) waren vergleichbar. Jüngere Patienten zeigten allerdings signifikant höhere Hämoglobinanstiege zwischen dem Studienbeginn und der letzten Kontrolle (1,4 g/dl vs. 0,4 g/dl; p < 0,0001). Schwere vaskuläre Ereignisse wurden signifikant häufiger in der älteren Kohorte beobachtet, wenngleich in diesem Zusammenhang in beiden Gruppen ähnliche Veränderungen zwischen Baseline und der letzten Kontrolluntersuchung zu verzeichnen waren.
Die Infektionsraten waren in beiden Kohorten niedrig und vergleichbar. Ein größerer Anteil an Patienten in der älteren Altersgruppe verstarb, allerdings standen diese Todesfälle nicht generell mit der Eculizumab-Behandlung in Zusammenhang. Die Autoren zogen den Schluss, dass Eculizumab als PNH-Therapie bei Patienten fortgeschrittenen Alters in einem praxisnahen Setting wirksam und gut verträglich ist.
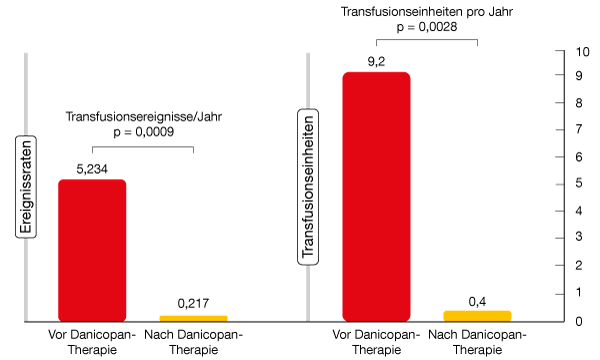
Danicopan: Effekt auf die Transfusionsnotwendigkeit
Der orale Faktor-D-Inhibitor Danicopan blockiert die Bildung der C3-Konvertase und kontrolliert damit potenziell sowohl die intra- als auch die extravaskuläre Hämolyse. Eine im Phase-II-Setting durchgeführte ‚Proof-of-Concept‘- und Dosisfindungsstudie untersuchte die Zugabe von Danicopan zum aktuellen Eculizumab-Regime bei transfusionsabhängigen Patienten mit inadäquatem Ansprechen auf Eculizumab. Von den 12 Patienten, die die Behandlung abschlossen, erreichten 11 klinisch relevante Verbesserungen im Bereich der Hämoglobinspiegel, der Transfusionsnotwendigkeit und anderer Parameter [12].
Eine beim EHA-Kongress 2020 präsentierte Post-hoc-Analyse dieser Studie bewertete den Einfluss der Zugabe von Danicopan auf die Transfusionsnotwendigkeit [13]. Über einen 24-wöchigen Zeitraum stieg der Hämoglobinspiegel von 7,9 g/dl auf 10,3 g/dl an, während sich die Transfusionshäufigkeit statistisch hochsignifikant um 95,8% verringerte (p = 0,0009; Abb. 2). Dies traf auch auf die Anzahl der transfundierten Erythrozyteneinheiten zu (p = 0,0028). Wie von den Autoren angemerkt, ist der zusätzliche Benefit wahrscheinlich auf die Prävention der C3-vermittelten extravaskulären Hämolyse zurückzuführen.
Danicopan zeigte im Allgemeinen gute Verträglichkeit. Mit Ausnahme einer Durchbruchshämolyse und einer schwerwiegenden Pneumonie bei einem Patienten mit Neutropenie in der Anamnese waren alle behandlungsassoziierten UEs von leichter oder mäßiger Ausprägung.
Abb. 2: Danicopan: Einfluss auf Transfusionsereignisse und Transfusionseinheiten pro Jahr
Ravulizumab: Langzeitformulierung
Ravulizumab, ein für die intravenöse Anwendung konzipierter C5-Inhibitor, ist ein neuer Behandlungsstandard bei PNH-Patienten in Ländern mit entsprechender Zulassung. Die Langzeitwirkung dieses Präparats ermöglicht eine verringerte Infusionshäufigkeit mit achtwöchigen Dosierungsintervallen. Zwei große Phase-III-Studien haben die Wirksamkeit und Sicherheit von Ravulizumab 10 mg/ml nachgewiesen [14, 15]. Eine unverblindete Phase-II-Studie testete mehrere ansteigende Dosierungen bei Komplementinhibitor-naiven Patienten mit PNH. Grundlage war die Beobachtung, dass die Formulierung mit 100 mg/ml im Vergleich zu jener mit 10 mg/ml die Infusionszeit um 78 bis 102 Minuten verringert. In vier Kohorten erhielten 25 Patienten Ravulizumab-Erhaltungsdosen mit 1.000 mg alle 4 Wochen, 1.600 mg alle 6 Wochen, 2.400 mg alle 8 Wochen oder 5.400 mg alle 12 Wochen. Nach der Initialbehandlung wurden die Kohorten 1 bis 3 in der laufenden Verlängerungsphase auf gewichtsbasierte Dosierungsschemata gesetzt. Alle Kohorten begannen mit Ravulizumab 10 mg/ml und wechselten in der Verlängerungsphase zu 100 mg/ml.
Die Interimsanalyse zeigte ähnliche Wirksamkeit, Sicherheit, Pharmakokinetik und Immunogenität der Formulierungen mit 100 mg/ml und 10 mg/ml [16]. In keiner Kohorte veränderten sich die LDH-Spiegel nach dem Wechsel signifikant. Die behandlungsassoziierten UEs stimmten mit dem etablierten Sicherheitsprofil von Ravulizumab 10 mg/ml überein. Keine Nebenwirkung erforderte einen Abbruch der Therapie oder eine Behandlungspause. Die Talspiegel unterschieden sich nach der Umstellung ebenfalls nicht wesentlich, und keine der beiden Formulierungen führte zu ADA(anti-drug-antibody)-Reaktionen. Im Vergleich zur Formulierung mit 10 mg/ml reduzierten sich die Infusionszeiten um 78 bis 102 Minuten. Die Autoren folgerten, dass Ravulizumab 100 mg/ml bei gleicher Wirksamkeit eine 60- bis 77-prozentige Reduktion der Infusionszeit ermöglicht und dadurch die Therapiebelastung der Patienten, ihrer Pflegepersonen und der Gesundheitsdienstleister verringert.
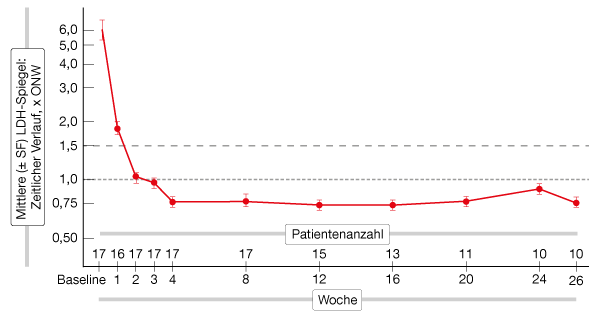
Pozelimab: ein neuartiger C5-Inhibitor
Der C5-Inhibitor Pozelimab wird in einer laufenden, unverblindeten, einarmigen Phase-II-Studie bei Patienten untersucht, die in Bezug auf Komplementinhibitoren therapienaiv sind oder bis vor Kurzem keine solche Behandlung erhalten haben [17]. Pozelimab wird über 26 Wochen einmal wöchentlich subkutan verabreicht. Eine Interimsanalyse mit 17 Patienten zeigte, dass der C5-Inhibitor zu einem raschen und dauerhaften LDH-Ansprechen führt (Abb. 3). Alle Patienten erreichten Reduktionen auf Werte unterhalb der klinisch signifikanten Schwelle vom maximal 1,5-Fachen des oberen Normalwerts (ONW), die bis zum 183. Studientag anhielten. In Woche 2 war bei 16 Patienten eine Kontrolle der intravaskulären Hämolyse (LDH: ≤ 1,5 x ONW) festzustellen, und eine Normalisierung der LDH-Spiegel (≤ 1,0 x ONW) wurde mit einer Ausnahme bei allen Patienten in Woche 4 beobachtet. Zudem zeigte ein Träger einer gegen die Blockade durch Eculizumab/Ravulizumab bekanntlich resistenten C5-Variante eine rasche und anhaltende LDH-Normalisierung. Die Hämoglobinspiegel stiegen im Verlauf von 26 Wochen an, was sich in einer Verbesserung des FACIT-Fatigue-Score widerspiegelte. Pozelimab erwies sich als gut verträglich. Es gab weder Fälle von schwerwiegenden oder zu Therapieabbrüchen führenden UEs noch Durchbruchshämolysen. Kopfschmerzen und Übelkeit waren die am häufigsten angegebenen UEs.
Den Studienautoren zufolge unterstützen diese Interimsdaten eine Fortsetzung der Entwicklung von Pozelimab als Behandlungsoption bei Patienten mit PNH sowie möglicherweise auch anderen komplementvermittelten Erkrankungen. Die Ergebnisse weisen darauf hin, dass ein subkutanes Regime eine Alternative zu den derzeit verfügbaren intravenösen Schemata darstellen könnte.
Abb. 3: Pozelimab: rasche und dauerhafte Reduktion der LDH-Spiegel
REFERENCES
- Takeda J et al., Deficiency of the GPI anchor caused by a somatic mutation of the PIGA gene in paroxysmal nocturnal hemoglobinuria. Cell 1993: 73:703-711
- Bessler M et al., Paroxysmal nocturnal haemoglobinuria (PNH) is caused by somatic mutations in the PIG-A gene. EMBO J 1994; 13: 110-117
- Miyata T et al., Abnormalities of PIG-A transcripts in granulocytes from patients with paroxysmal nocturnal hemoglobinuria. N Engl J Med 1994: 330: 249-255
- Brodsky RA, Paroxysmal nocturnal hemoglobinuria. Blood 2014; 124(18): 2804-2811
- Hillmen P et al., The complement inhibitor eculizumab in paroxysmal nocturnal hemoglobinuria. N Engl J Med 2006; 355: 1233-1243
- Brodsky RA et al., Multicenter phase 3 study of the complement inhibitor eculizumab for the treatment of patients with paroxysmal nocturnal hemoglobinuria. Blood 2008; 111: 1840-1847
- Risitano AM et al., Complement fraction 3 binding on erythrocytes as additional mechanism of disease in paroxysmal nocturnal hemoglobinuria patients treated by eculizumab. Blood 2009; 113: 4094-4100
- Risitano AM et al, Anti-complement treatment for paroxysmal nocturnal hemoglobinuria: time for proximal complement inhibition? A position paper from the SAAWP of the EBMT. Front Immunol 2019; 10: 1157
- Risitano AM et al., Peptide inhibitors of C3 activation as a novel strategy of complement inhibition for the treatment of paroxysmal nocturnal hemoglobinuria. Blood 2014; 123(13): 2094-2101
- Hillmen P et al., Results of the PEGASUS phase 3 randomized trial demonstrating superiority of the C3 inhibitor, pegcetacoplan, compared to eculizumab in patients with paroxysmal nocturnal hemoglobinuria. EHA 2020, abstract S192
- Lee JW et al., Effectiveness of eculizumab treatment in patients aged ≥ 65 years with paroxysmal nocturnal hemoglobinuria (PNH): results from the International PNH Registry. EHA 2020, abstract EP853
- Kulasekararaj A et al., A phase 2 open-label study of danicopan (ACH-0144471) in patients with paroxysmal nocturnal hemoglobinuria (PNH) who have an inadequate response to eculizumab monotherapy. Blood (2019) 134 (Supplement_1): 3514
- Kulasekararaj A et al., Effects of oral, factor D inhibitor danicopan on transfusion rates in transfusion-dependent paroxysmal nocturnal hemoglobinuria (PNH) patients with an inadequate response to eculizumab: phase 2 study. EHA 2020, EP855
- Lee JW et al., Ravulizumab (ALXN1210) vs eculizumab in adult patients with PNH naive to complement inhibitors: the 301 Study. Blood 2019; 133(6): 530-539
- Kulasekararaj AG et al., Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor-experienced adult patients with PNH: the 302 study. Blood 2019; 133(6): 540-549
- Röth A et al., An interim analysis of a phase 2 study evaluating the efficacy, safety, and pharmacokinetics of intravenous ravulizumab 100 mg/mL formulation in patients with paroxysmal nocturnal hemoglobinuria. EHA 2020, abstract EP862
- Jang JH et al., Pozelimab inhibits hemolysis in patients with paroxysmal nocturnal hemoglobinuria. EHA 2020, abstract EP860
© 2020 Springer-Verlag GmbH, Impressum