广泛期小细胞肿瘤:活性信号
CheckMate 451:免疫疗法维持
大多数小细胞肺癌(SCLC)患者在广泛期(ED-SCLC)得以诊断。它们通常对一线铂类化疗反应良好;然而,反应并不持久,且预后较差[1, 2]。在二线及以后,NCCN指南建议患者参与临床试验,取决于患者的表现状态和无复发间隔持续时间的全身治疗,或姑息症状管理[1]。 目前没有可用的维持治疗来延长一线化疗获得的效果。CheckMate 451试验设计用于评估这种条件下的免疫疗法[3]。在4个周期的铂类一线化疗后经历CR、PR或SD形式持续缓解的共834名ED-SCLC患者随机分配为给予纳武单抗(nivolumab)加易普利姆玛(ipilimumab)(n = 279)、纳武单抗240 mg Q2W(n = 280)或安慰剂 (n = 275)。在组合组中,纳武单抗以基于体重的方式(1 mg/kg Q3W)与易普利姆玛3 mg/kg Q3W一起给予最多4个剂量,然后给予纳武单抗 240 mg Q2W。治疗持续至进展或不可接受的毒性,但最多2年。 CheckMate 451未能显示纳武单抗加易普利姆玛与安慰剂相比的显著OS改善, OS改善被定义为主要终点(中位OS,9.2与9.6个月;HR,0.92)。12个月时的标志分析同样如此(41 %与 40 %)。
短期无治疗间隔后的获益
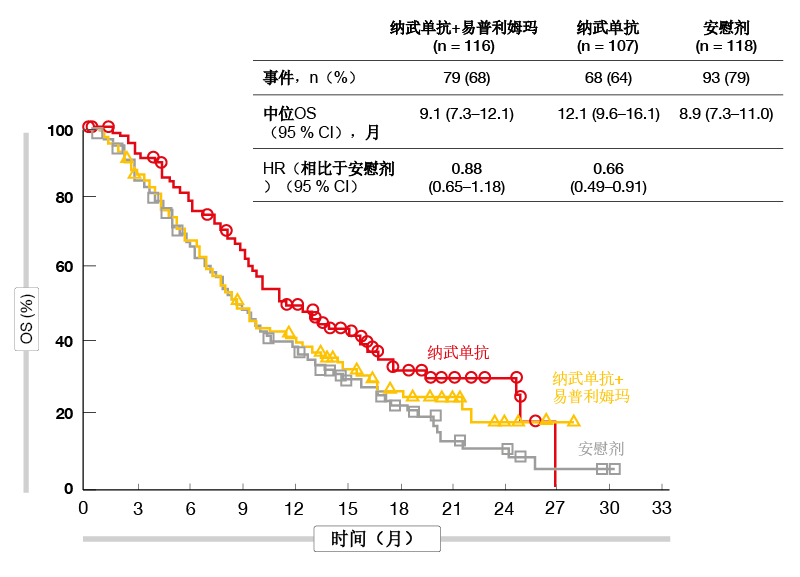
由于研究的分层测试要求,其他终点未进行统计显著性检验,而是仅针对描述性目的进行了分析。与组合相比,使用纳武单抗单药疗法与安慰剂在总人群中没有OS差异(10.4与9.6个月;HR,0.84)。然而,与安慰剂相比,在最后一剂前线化疗后5周内开始免疫疗法的患者中,亚组分析显示出显著的获益(中位OS,12.1与8.9个月;HR,0.66;图)。纳武单抗加易普利姆玛在该队列中未产生任何OS优势(HR,0.88)。另一方面,超过5周的间隔后接受免疫疗法的患者使用纳武单抗单药或组合均未显示生存期获益(HR均为0.96)。 PFS分析显示,与安慰剂相比,纳武单抗加易普利姆玛(HR,0.72;6个月PFS率,20 %与10 %)和单独使用纳武单抗(HR,0.67;6个月PFS率, 21 %与10 %)的结果均有改善。同样,实验组发生的缓解更为有利。临床获益(即CR加PR加SD)在使用组合、纳武单抗和安慰剂治疗患者中的发生率分别为45 %、47 %和35 %。中位缓解持续时间分别为10个月、11个月和8个月。免疫疗法方案的安全性特征符合针对相同剂量和时间表的先前报道。纳武单抗单药疗法证明比组合更耐受。 作者得出结论认为,PFS和缓解率数据表明免疫疗法在ED-SCLC维持治疗条件下的活性。纳武单抗可在从最后一剂一线化疗至开始治疗之间间隔较短的患者中提供改善的OS。
图: 在前线化疗后5周内开始免疫疗法的患者中,使用纳武单抗与安慰剂相比死亡率降低
Rova-T:三线条件
迄今为止,尚未批准任何药物用于ED-SCLC的三线治疗。抗体药物偶联物rovalpituzumab tesirine(Rova-T)靶向在SCLC和神经内分泌癌(NEC)中高度表达的δ样蛋白3(DLL3)[4]。单药Rova-T在I期和II期研究中进行治疗的SCLC患者中显示出令人鼓舞的抗肿瘤活性和可控的安全性特征[5, 6]。 在2019年ELCC大会上介绍的回顾性分析评估了现实条件下在至少两个周期全身治疗失败后的患者中使用Rova-T的DLL3检测结果和临床经 验[7]。在其中包括61例SCLC病例和7例大细胞NEC病例的68名高等级NEC患者中进行DLL3免疫组织化学。大多数样品显示DLL3染色。49个样本(72.1 %)被分类为高度阳性,10个样本(14.7%)为阳性,9个样本 (13.2 %)为阴性。16名没有其他治疗选择的患者接受两个计划周期 0.3 mg/kg Rova-T中的至少一个。在该组中,2名患者为DLL3阴性,4名为DLL3阳性,10名为高度DLL3阳性。 向7名患者给予两个治疗周期,而9名患者由于疾病进展或发生AE仅接受一个周期。4名患者(25 %)经历了部分缓解,4名(25 %)具有疾病稳定,8名患者发生疾病进展(50 %)。常见的药物相关AE包括疲劳、光敏感、胸腔积液、外周性水肿和血小板减少症。AE通常是可控的。 作者得出结论认为,Rova-T在选定患者中产生了临床获益,因此似乎是后线中针对ED-SCLC的一种选择。大部分SCLC患者检测为DLL3阳性,但需要进一步研究来评估DLL3该条件下作为生物标志物在的可行性。
Rova-T:三线条件
迄今为止,尚未批准任何药物用于ED-SCLC的三线治疗。抗体药物偶联物rovalpituzumab tesirine(Rova-T)靶向在SCLC和神经内分泌癌(NEC)中高度表达的δ样蛋白3(DLL3)[4]。单药Rova-T在I期和II期研究中进行治疗的SCLC患者中显示出令人鼓舞的抗肿瘤活性和可控的安全性特征[5, 6]。 在2019年ELCC大会上介绍的回顾性分析评估了现实条件下在至少两个周期全身治疗失败后的患者中使用Rova-T的DLL3检测结果和临床经 验[7]。在其中包括61例SCLC病例和7例大细胞NEC病例的68名高等级NEC患者中进行DLL3免疫组织化学。大多数样品显示DLL3染色。49个样本(72.1 %)被分类为高度阳性,10个样本(14.7%)为阳性,9个样本 (13.2 %)为阴性。16名没有其他治疗选择的患者接受两个计划周期 0.3 mg/kg Rova-T中的至少一个。在该组中,2名患者为DLL3阴性,4名为DLL3阳性,10名为高度DLL3阳性。 向7名患者给予两个治疗周期,而9名患者由于疾病进展或发生AE仅接受一个周期。4名患者(25 %)经历了部分缓解,4名(25 %)具有疾病稳定,8名患者发生疾病进展(50 %)。常见的药物相关AE包括疲劳、光敏感、胸腔积液、外周性水肿和血小板减少症。AE通常是可控的。 作者得出结论认为,Rova-T在选定患者中产生了临床获益,因此似乎是后线中针对ED-SCLC的一种选择。大部分SCLC患者检测为DLL3阳性,但需要进一步研究来评估DLL3该条件下作为生物标志物在的可行性。
More posts
序言
序言 亲爱的同事们, 一年一度的欧洲肺癌大会已成为全球性会议,吸引了世界各地肺癌领域专家的参与。本年度会议于4月10日至13日在日内瓦召开,超过120位发言人在会上与来自7