NTRK-、ROS1-和ALK-阳性肺癌中令人鼓舞的发现
TRK抑制:拉罗替尼(larotrectinib)
神经营养受体酪氨酸激酶(NTRK)基因融合发生在包括诸如婴儿纤维肉瘤等罕见肿瘤的多种不同的癌症中,但也存在于包括黑素瘤、结肠癌和肺癌在内的常见肿瘤中 [1]。它们在肺癌中的发病率估计为0.2 %至3.3 %[1,2]。高选择性的口服CNS活性TRK抑制剂拉罗替尼已被美国食品药品监督管理局批准用于治疗患有显示NTRK融合的实体瘤的成人和儿童患者。Drilon等人介绍了来自11名TRK融合阳性肺癌患者的汇总数据,这些患者在针对晚期实体肿瘤进行的I期研究和II期篮子试验中接受了拉罗替尼[3]。5名患者先前接受过1种或2种全身治疗,5名患者曾经接受过3种或更多种治疗。治疗包括连续100 mg每日两次拉罗替尼。 事实上,该分析证明了拉罗替尼在携带TRK融合的晚期肺癌中的活性。7名患者(71 %)发生缓解,其中分别有1名和4名患者经历完全缓解(CR)和部分缓解(PR)。在2例病例中发生了疾病稳定。没有患者发生原发性疾病进展。在分析时尚未达到缓解的中位持续时间。此外,拉罗替尼显示颅内活性。一名经历了确认PR的女性患者发生多个脑部病灶的几乎完全颅内缓解。 拉罗替尼在包括没有肺癌的患者在内的整个数据集中表现出良好的耐受性。最常发生疲劳、头晕和恶心。大多数AE是低等级事件。剂量减少在不超过9 %的总研究人群中是必要的,并且中止率低至< 1 %。总体而言,这些结果支持对NSCLC患者的TRK融合进行常规分子检测。
使用恩曲替尼(Entrectinib)获得的有意义缓解
另一种口服选择性CNS活性TRK抑制剂是恩曲替尼,其同样靶向ROS1和ALK。Paz-Ares等人报道了针对ALKA-372-001、STARTRK-1和STARTRK-2试验中纳入的具有NTRK融合阳性且TRK-抑制剂初治实体瘤的成年患者进行的综合分析[4]。ALKA-372-001和STARTRK-1是I期剂量递增研究,而全球性II期STARTRK-2试验评估了600 mg/天恩曲替尼。在入选这些试验的54名患有各种NTRK融合阳性实体瘤的患者中,10名患有肺癌。其中,6名患者在研究入选时显示脑转移。3名患者接受过一次先前全身治疗,另外3名患者接受过≥ 2次治疗。 恩曲替尼诱导了具有临床意义的持久全身和颅内缓解。根据盲独立中央审查,在具有不同NTRK融合阳性实体瘤的总人群中,ORR为57.4 %。对于NSCLC患者,ORR为70.0 %,并且尚未达到中位缓解持续时间。1名患者达到CR,6名患者获得PR,并且1名患者疾病稳定。中位PFS为14.9个月。对基 线处具有脑转移的患者的分析显示 颅内缓解率为66.7 %。2名患者获得CR (表1)。 恩曲替尼耐受性良好;AE主要为1级或2级。味觉障碍是最常见的毒性,发生率为47.1 %,其次是便秘、疲劳和腹泻。大多数AE借助剂量中断或减少来控制,中止率较低,为4.4 %。
恩曲替尼在ROS1阳性疾病中的活性
在ROS1阳性肺癌中,ALK/ROS1/MET抑制剂克唑替尼(crizotinib)已被确定为治疗标准。然而,由于CNS是克唑替尼治疗的ROS1阳性NSCLC患者中常见的首个进展部位,因而需求未得到满足[5]。因此,在一线条件下引入CNS渗透性ROS1抑制剂似乎是可取的。与克唑替尼相比,恩曲替尼在临床前研究中显示出在ROS1抑制方面更高的效力[6]。恩曲替尼在多种肿瘤组织学中表现出临床活性,包括原发性脑肿瘤和继发性CNS转移[7]。 评价恩曲替尼的ALKA-372-001、 STARTRK-1和STARTRK-2试验共纳入了53名ROS1抑制剂初治的ROS1阳性NSCLC患者。其中23名在基线处具有CNS病灶。对这53名患者进行的综合分析显示出使用恩曲替尼获得的有临床意义且持久的全身和颅内缓解[8]。全身缓解与基线脑转移的存在无关。有无CNS病灶的患者的客观缓解率分别为73.9 %和80 %。中位缓解持续时间分别为12.6和24.6个月,中位PFS分别为13.6和26.3个月。无CNS疾病的患者中有3名(10.0 %)达到CR。对于根据独立中央审查的颅内活性,显示20名具有基线脑转移的患者中有55 %发生缓解,其中20 %和35 %分别获得CR和PR。颅内缓解持续的中位时间为12.9个月。尚未达到中位OS。 汇总的安全性人群包括134名接受恩曲替尼的患者,TKI初治不是必需的。恩曲替尼在ROS1阳性条件下被证实是可耐受的,主要是低级别AE,这些AE通过剂量中断/减少显示出成功控制的可行性。最常见的治疗相关AE包括味觉障碍、头晕和便秘。仅在4.5 %的情况下由于AE必须中止治疗。
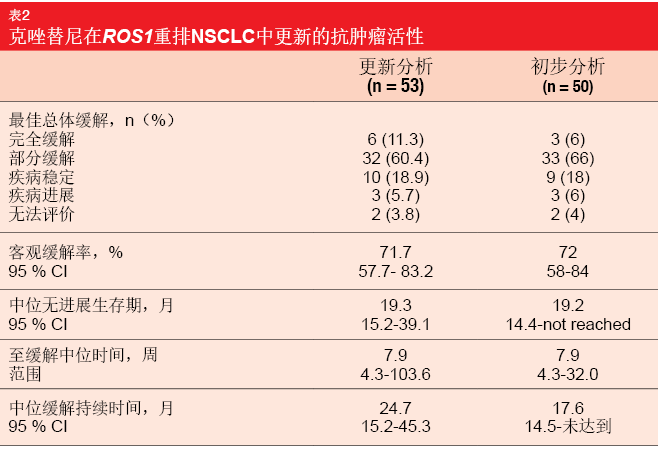
PROFILE 1001:OS的新基准
在2019年ELCC大会上,Shaw等人介绍了根据PROFILE 1001研究的ROS1扩展队列,克唑替尼在ROS1重排疾病中的更新结果[9]。在16个月的中位随访后,于2014年发表的PROFILE 1001试验的初步分析显示出显著的抗肿瘤活性[10]。克唑替尼250 mg BID导致ORR为72 %,中位缓解持续时间为17.6个月,中位PFS为19.2个月。尚未达到中位OS。基于这些数据,克唑替尼在许多国家被批准用于ROS1重排晚期NSCLC。 在针对OS的62.6个月的中位随访后,在共53名大多数在晚期条件下至少接受过一种先前治疗的患者中,PROFILE 1001扩展队列的中位OS为51.4个月。1年和4年的OS率分别为79 %和51 %。根据ROS1融合伴侣,生存期没有差异,但每种ROS1重排类型的患者数量很少,需要进一步研究。更新的ORR与初步分析时获得的结果一致,更新的PFS也是如此(表2)。但是,更新的缓解持续时间为24.7个月,超过了之前报告的结果。此外,与初步分析相比,更大比例的患者达到了CR,这可能是由于暴露时间更长。长期克唑替尼治疗未产生任何新的安全性信号。没有患者发生需要永久性治疗中止的治疗相关AE。 作者指出,该分析为ROS1重排晚期NSCLC中的OS提供了新的基准。考虑到出色的生存率,其可能是少数几种可被视为慢性疾病的肺癌之一。此外,该数据支持继续使用克唑替尼治疗患有这种肺癌分子亚型的患者。
ALTA-1L研究的首次中期分析
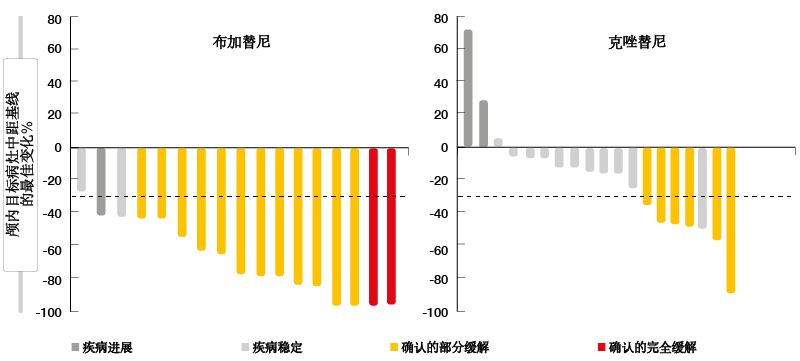
随机化III期ALTA-1L试验在ALK抑制剂初治的晚期ALK阳性NSCLC患者中测试了新一代ALK/ROS1抑制剂布加替尼(brigatinib)与第一代TKI克唑替尼。允许晚期条件下的一次先前全身治疗。在以90 mg导入7天后,以180 mg/天的剂量给予布加替尼(n = 137)。在对照组中,138名患者接受了克唑替尼 250 mg BID。Califano等人在2019年ELCC大会上介绍了首次中期分析[11]。 根据盲独立审查委员会的PFS被定义为主要终点,其非常有利于布加替尼(未达到与9.8个月;HR,0.49; p = 0.0007)。在一年时,分别有67 %与43 %的患者无进展。亚组分析证明了布加替尼在所有亚组中一致的PFS获益。与克唑替尼相比,布加替尼的ORR在数值上更高(71 %与60 %);实验组尚未达到中位缓解持续时间,而对照组为11.1个月。 在基线处具有可测量脑转移的患者中,确认的颅内缓解发生率为78 %与29 %(OR,10.42;p = 0.0028)。在基线处具有任何脑部病灶的患者中,确认的颅内ORR为67 %与17 %(OR,13.00; p <0.0001)。所有接受布加替尼治疗的患者都达到了可测量CNS转移的收缩,而这种收缩不适用于克唑替尼治疗的队列(图)。因此,ITT人群(HR,0.42; p = 0.0006)和基线处具有任何脑转移的患者(未达到与5.6个月;HR,0.27; p <0.0001)的颅内PFS显著改善。对于没有基线脑转移的患者,颅内PFS的结果尚不成熟。
图: ALTA-1L:具有可测量脑部疾病的患者中的颅内最佳目标病灶缓解
CNS进展显著延迟
根据竞争风险分析,在没有先前全身进展情况下,布加替尼引起至颅内CNS进展时间(CNS进展的原因特异性HR,0.30;p < 0.001)的显著改善,而在没有先前颅内CNS进展情况下的至全身进展时间(全身性进展的原因特异性HR,0.51;p = 0.017)同样如此。因此,与克唑替尼相比,布加替尼显著延迟了CNS进展和全身进展。 使用克唑替尼观察到的过量AE主要是胃肠道症状、转氨酶升高、心动过缓、水肿和视觉影响,而布加替尼相关的过量AE主要包括无症状的CPK、脂肪酶和淀粉酶增加。由于这些实验室异常,剂量减少主要由方案规定。两组均未发生胰腺炎的临床病例。治疗开始后2周内的早发性间质性肺病/肺炎似乎是ALK TKI中布加替尼所特有的,但发生率为3 %,较为罕见,且事件发生率低于后线试验[12]。基于这些数据,布加替尼显示为大有前景的ALK阳性晚期NSCLC一线治疗选择。
布加替尼的治疗持续时间
针对布加替尼的国际扩展使用计划(EAP)已于2016年7月开放,该计划纳入已用尽可用疗法或无法参与临床研究的ALK阳性的局部晚期或转移性NSCLC患者。在2016年7月至2018年11月,西欧、亚太和南美洲21个国家的604名患者加入EAP。他们在所有治疗线接受了布加替尼治疗。 在ELCC上介绍的患者结果分析旨在评价布加替尼在ALK重排NSCLC中的现实活性[13]。由于在EAP中没有定义临床结果终点,因此特别是在TKI中与PFS高度相关的至治疗中止时间被用作治疗耐受性和治疗功效的代表。 纳入分析的患者对≥ 1种先前ALK TKI具有耐药性或不耐受。在大多数情况下(67.2 %),布加替尼在三线或后线中给予。在ALK TKI中,在布加替尼之前最常使用色瑞替尼(ceritinib)、克唑替尼和艾乐替尼(alectinib)。尽管存在这种不同,但在所有治疗线中,至中止的中位时间均为将近一年(10.95个月)。6个月和12个月时继续使用的概率分别为67.1 %和48.6 %。当根据先前ALK TKI治疗的类型进行分析时,在艾乐替尼(n = 111;至布加替尼中止的中位时间,8.72个月)和色瑞替尼(n = 249;至中止的中位时间,10.33个月)后,观察到布加替尼的继续使用。在劳拉替尼(lorlatinib)后同样使用布加替尼,至中止的中位时间为7.5个月。随着先前ALK TKI治疗线的增加,继续使用布加替尼的概率和至布加替尼中止的中位时间均降低。 总计260名患者中止治疗。其中仅4名(0.7 %)报告因AE而中止。布加替尼治疗中止的主要原因是缺乏疗效(9.6 %)。总体而言,无论先前ALK抑制剂治疗如何,在现实条件下观察到的布加替尼治疗持续时间令人鼓舞,并且安全性特征证明是可控的。
参考文献
- Vaishnavi A et al., TRKing down an old oncogene in a new era of targeted therapy. Cancer Discov 2015; 5(1): 25-34
- Stransky N et al., The landscape of kinase fusions in cancer. Nat Commun 2014; 5: 4846
- Drilon A et al., Activity of larotrectinib in TRK fusion lung cancer. ELCC 2019, abstract 1110
- Paz-Ares L et al., Entrectinib in NTRK fusion-positive non-small cell lung cancer (NSCLC): integrated analysis of patients enrolled in STARTRK-2, STARTRK-1 and ALK-372-001. ELCC 2019, abstract 1130
- Patil T et al., The incidence of brain metastases in stage IV ROS1-rearranged non-small cell lung cancer and rate of central nervous system progression on crizotinib. J Thorac Oncol 2018; 13(11): 1717-1726
- Ardini E et al., Entrectinib, a Pan-TRK, ROS1, and ALK inhibitor with activity in multiple molecularly defined cancer indications. Mol Cancer Ther 2016; 15(4): 628-639
- Drilon A et al., Safety and antitumor activity of the multitargeted pan-TRK, ROS1, and ALK inhibitor entrectinib: combined results from two phase I trials (ALKA-372-001 and STARTRK-1). Cancer Discov 2017; 7(4): 400-409
- Barlesi F et al., Entrectinib in locally advanced or metastatic ROS1 fusion-positive non-small cell lung cancer (NSCLC): integrated analysis of STARTRK-2, STARTRK-1 and ALKA-372-001. ELCC 2019, abstract 1090
- Shaw AT et al., Crizotinib in advanced ROS1-rearranged non-small cell lung cancer (NSCLC): overall survival (OS) and updated safety from PROFILE 1001. ELCC 2019, abstract 1070
- Shaw AT et al., Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med 2014; 371(21): 1963-1971
- Califano R et al., Brigatinib vs crizotinib in the phase 3 ALTA-1L trial, ELCC 2019, abstract 1060
- Kim DW et al., Brigatinib in patients with crizotinib-refractory anaplastic lymphoma kinase-positive non-small-cell lung cancer: a randomized, multicenter phase II trial. J Clin Oncol 2017; 35(22): 2490-2498
- Lin HM et al., Treatment duration of brigatinib in patients enrolled in the international Expanded Access Program (EAP). ELCC 2019, abstract 1080
More posts
“当需要快速缓解时,化疗必不可少”
“当需要快速缓解时,化疗必不可少” Anne-Marie C. Dingemans, MD, PhD, 荷兰马斯特里赫特,马斯特里赫特大学医学中心肺病学部 由于化疗在NS
广泛期小细胞肿瘤:活性信号
广泛期小细胞肿瘤:活性信号 CheckMate 451:免疫疗法维持 大多数小细胞肺癌(SCLC)患者在广泛期(ED-SCLC)得以诊断。它们通常对一线铂类化疗反应良好;然
提高肺癌筛查的准确性
提高肺癌筛查的准确性 Nir Peled, MD PhD, 以色列贝尔谢巴遗产肿瘤学中心和拉里·诺顿博士研究所,索罗卡医疗中心和本·古里安大学 哪些用于肺癌早期检测的生物
NTRK-、ROS1-和ALK-阳性肺癌中令人鼓舞的发现
NTRK-、ROS1-和ALK-阳性肺癌中令人鼓舞的发现 TRK抑制:拉罗替尼(larotrectinib) 神经营养受体酪氨酸激酶(NTRK)基因融合发生在包括诸如婴儿纤
免疫疗法:分析阐明度伐鲁单抗和派姆单抗活性
免疫疗法:分析阐明度伐鲁单抗和派姆单抗活性 PACIFIC:后续免疫疗法后的OS III期随机化双盲国际PACIFIC试验在根治性铂类同步放化疗后未经历进展的III期无法切
对于EGFR靶向治疗的当前观点
对于EGFR靶向治疗的当前观点 评估阿法替尼(afatinib)的全球IIIb期研究 基于III期LUX-Lung 3和6试验,第二代不可逆ErbB家族阻断剂阿法替尼已被确