使用 EGFR TKI 疗法后的疾病进展:在埃罗替尼、吉非替尼和阿 法替尼之后还有哪些手段?
用于EGFR 突变阳性 NSCLC 患者的一线治疗方案包括第一代可逆 EGFR TKI抑制剂埃罗替尼和吉非替尼,以及第二代 ErbB 家族阻断剂阿法替尼。这些药物能够引起强烈的反应,但获得性耐药往往限制了成功的长期治疗。在大多数患者中,由于耐药性而最终仍会发生肿瘤进展。
T790M:头号罪魁祸首
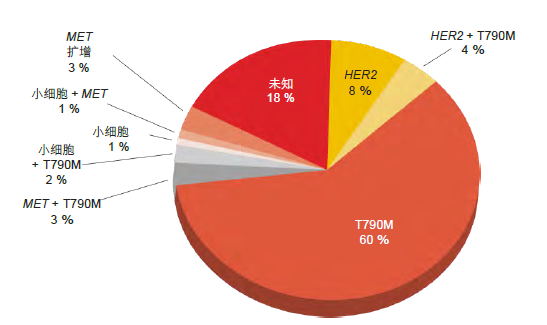
图 1: EGFR 突变阳性肿瘤中获得性耐药机制的相对频率
获得性耐药的最常见机制是在 EGFR基因的外显子 20 内发生的 T790M 突变(图 1)[1]。当出现这种突变时,通常会发生无痛缓慢肿瘤生长[2]。在ESMO 亚洲大会的一场研讨会上,来自美国波士顿 Dana Farber 癌症研究所 Lowe 胸部肿瘤中心的 Pasi A. Jänne博士解释称:“可能有必要进行反复成像来确定病情进展”。
T790M 通过一种不同寻常的耐药机制而产生作用,在此过程中它会改变 EGFR 受体对其天然基质 ATP 的亲和力。尽管像吉非替尼和埃罗替尼这类药物作为竞争性抑制剂,在结合位点处排挤 ATP 结合,但是在这种突变的存在下,受体表现出对 ATP 的更大亲和力。发表于 2005 年的描述 T790M突变的原始文献提出,需要开发共价EGFR 抑制剂,以作为压倒 T790M 竞争优势的潜在解决方案[3]。这引起了对共价 EGFR 抑制剂的评估。两项随机化 III 期临床试验在已对吉非替尼和埃罗替尼产生耐药性的病人身上对阿法替尼和达克米替尼(dacomitinib)开展了评价研究[4, 5]。“然而与安慰剂相比,它们在反应率、PFS 和 OS 方面的有益效果微不足道”,Jänne 博士称。
其他类型的畸变也会介导耐药性,例如 MET 扩增或小细胞转化。小细胞转化产生与 T790M 突变截然不同 的作用,会引起快速进展。这些肿瘤可能表现出小细胞肺癌(SCLC)的外观,并对 SCLC 治疗有反应。
一般管理原则
正如 Jänne 博士所解释,当在 EGFR TKI 治疗中出现病情进展时,需要回答的第一个问题是这样的进展对于患者个体是否有临床意义。根据实体瘤疗效评价标准(RECIST),肿瘤生长并不总是意味着需要改变策略,特别是在病人对治疗耐受良好的情况下。 “许多患者接受了进展后 TKI 治疗。” 根据 ASPIRATION 试验,这尤其适用于经历较长 PFS、较好的反应、并且机体表现状态较好的患者[6]。
受到关注的一个方面是,在维持全身性抗 EGFR 治疗的同时使用局部疗法,例如针对脑转移瘤、孤立性肺转移瘤或骨转移瘤进行立体定向放疗。Jänne 博士指出:“如果患者仅表现出单一部位的肿瘤生长,那么这可以作为终止治疗之外的一种替代方案”。Weickhardt 等人提供的数据显示,这样的联合方法具有潜在受益,特别是对于以中枢神经系统(CNS)转移作为第一进展部位的患者[7]。但 是,需要对患者进行仔细选择。治疗决策取决于进展模式和可供选择的局部疗法。最后,应当确定再次活检是否可行,以及是否考虑转为化疗。
在转为化疗之后继续进行 EGFR TKI 治疗的做法曾经在临床实践中非常普遍。然而,IMPRESS 试验产生了改变实践的结果[8]。在试验中,与单用化疗相比,伴随化疗继续施用吉非替尼并没有在 PFS 或反应方面提供任何受益。
一种透入大脑的 TKI:osimertinib
在最初发现肿瘤的同一位置或相似位置处经常观察到肿瘤进展。有时进展局限于 CNS,并伴有脑转移瘤或软脑膜病变的出现。Jänne 博士称:“很多当前的 EGFR 抑制剂难以渗透进入CNS,这在临床实践中造成了问题”。
对于这个问题的一个例外是第三代 EGF R T K I osi mer ti ni b (AZD9291),其被开发用于抑制T790M 突变,而非任何其他类型的耐药机制。这种药物可以有效地透入CNS。osimertinib 已在美国和欧洲被批准用于 T790M 突变阳性 NSCLC 的治疗。
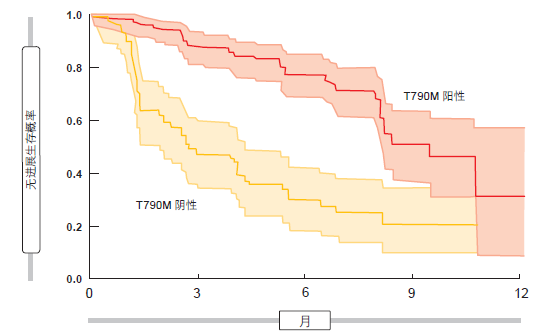
在由 Lee 等人进行的试验中,显著比例的软脑膜病变患者对osimertinib 治疗产生反应,并伴随着明显的临床改善[9]。在脑脊液中获得了 EGFR 突变体拷贝数的改变。一项 I期 研究证 明,osimertinib 在 携带T790M 突变的患者身上比在未携带这一突变的患者身上产生了更大的功效;Kaplan-Meier 图显示出 PFS 曲线在这两个群体之间出现了即时分离(图 2)[10]。AURA3 III 期试验目前正在对用于晚期或转移性 T790M 突变阳性 NSCLC 治疗的 osimertinib 与以铂类为基础的双药化疗进行比较测试。
图 2: osimertinib 在 T790M 突变阳性患者中比在 T790M 突变阴性群体中具有更大的 PFS 受益
BI 1482694
另一种第三代 EGFR 突变体特异性药物是 BI 1482694,它对包括 T790M 在内的突变 EGFR 异构体有效,而不会对野生型 EGFR 产生影响。一项针对韩国患者进行的开放标签的多中心 I/II期试验评价了 BI 1482694 的安全性和耐受性,及其在推荐 II 期剂量下的临床活性[11]。Lee 等人发表了在曾接受EGFR TKI 治疗的 76 名 T790M 阳性NSCLC 患者身上施用最大耐受剂量和每日 800 mg 推荐 II 期剂量的研究成果[12]。 在能够通过独立评估来评价反应的 69 名病人中,客观反应率为 62 %。治疗早期即观察到反应,在经确认的客观反应当中,有 84%是在第 6 周获得。在分析之时尚未达到反应期中位数。无论研究开始前的最后治疗是EGFR TKI 还是化疗,ORR 都相似。在91%的患者中获得了疾病控制。最常见的治疗相关 AE 包括轻到中度胃肠道症状(例如,腹泻、恶心)和皮肤毒性(例如,皮疹、瘙痒)。在每日 800 mg 剂量下,未观察到对 QTc 间隔或葡萄糖代谢的明显影响。
ELUXA 项目将在多种 EGFR 突变NSCLC 条件下评价 BI 1482694 的有效性和安全性。目前在 II 期 ELUXA 1 试验中,正在取得有关 T790M 阳性患者的研究成果。进一步的第三代 EGFR TKI,例如 rocelitinib 、ASP8273 和EGF816 等,也正在接受临床评估。
EGFR 抑制作用的前景
根据 Jänne 博士的看法,医生们终于 站在了这样一个位置,可以开始回答如何以最佳次序使用 EGFR 抑制剂的问题。即使考虑到迄今为止仅有有限数量的药物可供使用,但对于是以第一代或第二代 EGFR 抑制剂开始患者治疗并继而采用第三代抑制剂,还是从治疗一开始就使用第三代抑制剂,仍然存在选择。Jänne 博士解释称: “后者正在迅速成为一种更令人感兴趣的选择,尽管还需要更多数据来确定这是不是一种合适的方案”。来自用osimertinib 进行的 I 期临床试验的初始数据表明,一线结果可能优于使用第一代 EGFR 抑制剂所能预期的结果[13]。该项研究包含 EGFR TKI 初治个体群组;这些患者的客观反应率达到75 %,而他们的中位 PFS 截止分析时尚未达到。Jänne 博士强调:“虽然这只是很小一组人群,但结果的确令人鼓舞”。另外,正在进行中的、对osimertinib 与吉非替尼或埃罗替尼进行比较的 FLAURA 试验将会为我们提供关于使用这类药剂作为初始治疗的进一步洞察。
正如 Jänne 博士所指出,长期成功终将需要联合疗法。由于交叉毒性,联合用药研究对于较早开发的EGFR 抑制剂不可行,但这样的研究可 以对这些新药进行。目前有多项联合试验正在进行当中。常用策略包括MEK 与 MET 抑制联合治疗,以及免疫疗法联合治疗。“对于我们所有人而言,机遇在于弄清应当使用哪种联合疗法,并且决定是将其作为初始治疗方案、第一代药物之后的选择,还是连续 EGFR TKI 治疗失败后的首选疗法 ,” Jänne 博士总结道,“临床前试验将有望提供这一问题的答案。”
参考文献
- Yu HA et al., Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers. Clin Cancer Res 2013; 19: 2240-2247
- Sacher AG et al., Management of acquired resistance to epidermal growth factor receptor kinase inhibitors in patients with advanced non-small cell lung cancer. Cancer 2014; 120(15): 2289-2298
- Kobayashi S et al., EGFR mutation and resistance of non-small-cell lung cancer to gefitinib. N Engl J Med 2005; 352(8): 786-792
- Miller VA et al., Afatinib versus placebo for patients with advanced, metastatic non-small-cell lung cancer after failure of erlotinib, gefitinib, or both, and one or two lines of chemotherapy (LUX-Lung 1): a phase 2b/3 randomised trial. Lancet Oncol 2012; 13: 528-538
- Ellis PM et al., Dacomitinib compared with placebo in pretreated patients with advanced or metastatic non-small-cell lung cancer (NCIC CTG BR.26): a double-blind, randomised, phase 3 trial. Lancet Oncol 2014; 15(12): 1379-1388
- Park K et al., ASPIRATION: first-line erlotinib (E) until and beyond RECIST progression (PD) in Asian patients (pts) with EGFR mutation-positive (mut+) NSCLC. Ann Oncol 2014; 25(suppl_4): iv426-iv470
- Weickhardt AJ et al., Local ablative therapy of oligoprogressive disease prolongs disease control by tyrosine kinase inhibitors in oncogene-addicted non-small-cell lung cancer. J Thorac Oncol 2012; 7(12): 1807-1814
- Soria JC et al., Gefitinib plus chemotherapy versus placebo plus chemotherapy in EGFR-mutation-positive non-small-cell lung cancer after progression on first-line gefitinib (IMPRESS): a phase 3 randomised trial. Lancet Oncol 2015; 16(8): 990-998
- Lee DH et al., AACR-NCI-EORTC 2015, abstract PRO7
- Jänne PA et al., AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer. N Engl J Med 2015; 372(18): 1689-1699
- Park K et al., Updated safety and efficacy results from phase I/II study of HM61713 in patients (pts) with EGFR mutation positive non-small cell lung cancer (NSCLC) who failed previous EGFR-tyrosine kinase inhibitor (TKI). J Clin Oncol 2015; 33(suppl; abstr 8084)
- Lee J-S et al., Clinical activity and safety of the EGFR mutant-specific inhibitor, BI 1482694 (HM61713) in patients with T790M-positive NSCLC. ESMO Asia 2015, abstract 425PD
- Ramalingam SS et al., IASLC 2015
More posts
免疫疗法:毒性管理
免疫疗法:毒性管理 免疫检查点抑制剂的毒性从根本上源于它们是以一种生理学方式促进 T 细胞活性。“免疫系统的放大导致自体免疫性疾病,”Ross Soo 解释称(Ross S
“PD-L1 表达如噩梦般复杂”
“PD-L1 表达如噩梦般复杂” 免疫疗法在未经筛选的病人中能产生有利作用。然而,生物标志物的使用是非常值得欢迎的。这样做的理由之一是出于遏制医疗系统中资金紧张的考虑,通过
免疫疗法:大量预治疗之后令人瞩目的抗肿瘤活性
免疫疗法:大量预治疗之后令人瞩目的抗肿瘤活性 抗 PD-1 抗体派姆单抗( pembrolizumab )和纳武单抗(nivolumab)已被证明对肺癌具有活性。派姆单抗是
寡转移疾病患者的风险与机会
寡转移疾病患者的风险与机会 在全身治疗不断进步的背景下,对于患有有限数目血行转移瘤的 NSCLC 患者的潜在治愈期望与日俱增。Suresh Senan 博士(MRCP、FR
使用 EGFR TKI 疗法后的疾病进展:在埃罗替尼、吉非替尼和阿 法替尼之后还有哪些手段?
使用 EGFR TKI 疗法后的疾病进展:在埃罗替尼、吉非替尼和阿 法替尼之后还有哪些手段? 用于EGFR 突变阳性 NSCLC 患者的一线治疗方案包括第一代可逆 EGFR
EGFR 突变阳性非小细胞肺癌:扩大用于既定治疗方案的数据 池
EGFR 突变阳性非小细胞肺癌:扩大用于既定治疗方案的数据 池 LUX-Lung 3 和 6 的亚群分析 伴有激活的表皮生长因子受体(EGFR )突变的非小细胞肺癌(NSC