免疫疗法:大量预治疗之后令人瞩目的抗肿瘤活性
抗 PD-1 抗体派姆单抗( pembrolizumab )和纳武单抗(nivolumab)已被证明对肺癌具有活性。派姆单抗是一种抗 PD-1 的高亲和力人源化单克隆 IgG4κ 抗体,其能够阻止带有 PD-L1 和 PDL2 的受体发生相互作用。KEYNOTE-001 试验证明,派姆单抗对晚期 NSCLC 具有显著的抗肿瘤活性,其在 PD-L1 肿瘤比例评分(TPS)方面的结果得到提高,达 ≥50% [1]。TPS 反映了 PD-L1 在肿瘤上的表达。≥50%的界限是利用来自KEYNOTE-001 的独立训练和验证数据集确定的。
派姆单抗已在美国被批准用于特定晚期 PD-L1 阳性 NSCLC 患者的治疗,这些患者在进行了含铂化疗和针对 EGFR 或 ALK 基因组畸变的适当TKI 治疗后发生了病情进展。
KEYNOTE-010
随机化 II/III 期试验 KEYNOTE-010 提供了一些补充数据,这项试验中包括了患有 PD-L1 阳性晚期 NSCLC 并且 在至少一线化疗后发生疾病进展的患者[2]。试验中对两个剂量的派姆单抗(每 3 周 2 mg/kg,或每 3 周 10 mg/kg,持续 24 个月)与多西他赛(每 3 周 75 mg/m2,根据当地指南)进行了比较。所选患者必须为 PDL1阳性。TPS≥1 %是入选标准之一,并且 PD-L1 状态是一个分层因素(例如,TPS≥50 %与 1 %-49 %)。分别针对 TPS≥50 %组和 TPS≥1 %组评价了以下终点:PFS 和 OS(协同主要)、客观反应率(ORR)、反应持续时间以及安全性(次要)。
筛查的病人有 2699 人,其中1475人是 TPS≥1 %的 PD-L1 阳性患者。最初,档案活检和新组织样本都可以用于肿瘤分析,但是在一项修订后,除非认为活检的风险过高,否则必须使用新的肿瘤样本。总体上,基于档案样本,1034 名随机化患者中有 456 人参于了试验。每组中大约 20%的病人患有鳞状细胞癌。在使用 2mg/kg 派姆单抗、10mg/kg 派姆单抗和多西他赛进行治疗的患者中,分别有 8 %、9 %和 8 %被发现EGFR 突变。分析显示, 在各治疗组中,大约有 40 %和60 %的患者分别分布在 PD-L1 TPS≥50 %和TPS 为 1 %–49 %的范围内。有 20%至30%的患者接受研究治疗作为三线或更晚线治疗。
TPS≥1%患者的结果改善
在 TPS≥50 %的人群中,与多西他赛化疗相比,两种剂量的派姆单抗治疗都产生了非常显著的 OS 受益(剂量为2mg/kg 和 10mg/kg,HR 分别为 0.54和 0.50;p 值分别为 p=0.0002 和p<0.0001)。由派姆单抗获得的中位生存率比多西他赛高将近一倍。TPS≥ 1 %组的结果特别令人关注,因为其代表了大多数患者。这两种派姆单抗剂量再一次显示出相似的活性(图),而与多西他赛相比死亡风险分别降低了 29 %和 39 %(p 值分别为p=0.0008和 p<0.0001)。OS 受益在早期就显现出来。所有亚群(即,性别、年龄、 ECOG 机能状态、肿瘤取样[档案样本与新样本]、组织学、EGFR 状态)都从派姆单抗治疗中受益。派姆单抗的 这一优势还在两个 TPS 组中(≥50 %组与 1 %–49 %组)有所体现,并与治疗决策相关。
分析还显示,在 PFS 方面,派姆单抗治疗在全部两个 TPS 组中都有显著程度的优势。对于 TPS≥50 %试验组,与多西他赛相比,两种派姆单抗剂量的 HR 均为 0.59(p 值分别为p=0.0001 和 p <0.0001)。对于 TPS≥ 1 %试验组,HR 分别为 0.88 和 0.79 (p 值分别为 p=0.07 和 p =0.004)。反应率在 TPS≥50%试验组(两种剂量派姆单抗的反应率分别为 30% 和29%,与其相比多西他赛的反应率为8%;两项比较的 p 值均为 p< 0.0001)和 TPS≥1%试验组(两种剂量派姆单抗的反应率均为 18 %,与其相比多西他赛的反应率为 9%;两项比较的 p 值分别为 p= 0.0005 和p=0.0002)中都有非常显著的提高。此外,不论哪个TPS 试验组,相比多西他赛,使用两种派姆单抗剂量进行治疗时,所获得的反应持续时间也明显延长。
图: 在 TPS≥1%人群中两种剂量的派姆单抗与多西他赛的总生存率对比 (KEYNOTE-010)
派姆单抗:护理新标准
派姆单抗治疗的耐受性好,高级别毒性反应发生率明显低于多西他赛。在使用派姆单抗的患者中因 AE 而中止治疗的人数大约是使用多西他赛患者的一半。免疫相关事件的最高发生率为8 %。主要的免疫介导性 AE 为甲状腺功能减退和甲状腺功能亢进,并且此类 AE 大多级别较低。使用两种派姆单抗剂量治疗的患者中有 2 %至 3 %的人患上肺炎,虽然这种 AE 也在多西他赛治疗组中出现,但发生频度较低。同样地,在大多数病例中,肺炎为低级别。
总体而言,从 KEYNOTE-010 获得的数据验证了 PD-L1 阳性选择在晚期 NSCLC 中的使用。这些数据支持目前在美国获准用于晚期 NSCLC 患者的派姆单抗治疗方案,即每 3 周 2 mg/kg。此外,这些研究结果还支持将派姆单抗作为一个新的护理标准,用于在铂基化疗中出现疾病进展的晚期 NSCLC 患者。
纳武单抗(Nivolumab)在非
鳞状 NSCLC 中的应用:CheckMate 057
完全人源 IgG4 PD-1 免疫检查点抑制性抗体纳武单抗已在美国获得批准,用于对在以铂类为基础的双药化疗治疗中或治疗后以及抗 EGFR 或抗 ALK TKI 治疗后出现疾病进展的转移性NSCLC 患者进行治疗。在欧洲,该药物的批准使用范围扩大到在既往化疗期间或之后出现疾病进展的局部晚期或转移性鳞状细胞 NSCLC 患者。
随机化 III 期试验 CheckMate 057在经预先治疗的晚期非鳞状细胞NSCLC 患者患者中(不考虑 PD-L1 状态)对比研究了纳武单抗与多西他赛。多西他赛充当对比参照是因为它是这种条件下的标准二线治疗药物。在这种治疗下,可以预期产生 9.0 %至14.5 %的反应率,以及 8.0 至10.4 月的中位 OS。
在 CheckMate 057 中,患者被随机分配进行每 2 周 3 mg/kg 纳武单抗治疗或者每 3 周75 mg/m2多西他赛治疗。试验过程中允许既往维持治疗,也允许患有已知 EGFR 突变或 ALK 易位的患者接受既往 TKI 治疗。主要终点为 OS,次要终点包括 ORR、PFS、安全性、根据 PD-L1 表达的功效,以 及患者报告结果。有大约 80%的患者能够提供肿瘤组织用于 PD-L1 表达分析,而其中一半左右的肿瘤组织显示为 PD-L1 阳性。在 ESMO 亚洲大会上展示了 CheckMate 057 试验的18 个月分析,连同亚群分析和患者报告结果。
PD-L1 状态与受益之间的相关性
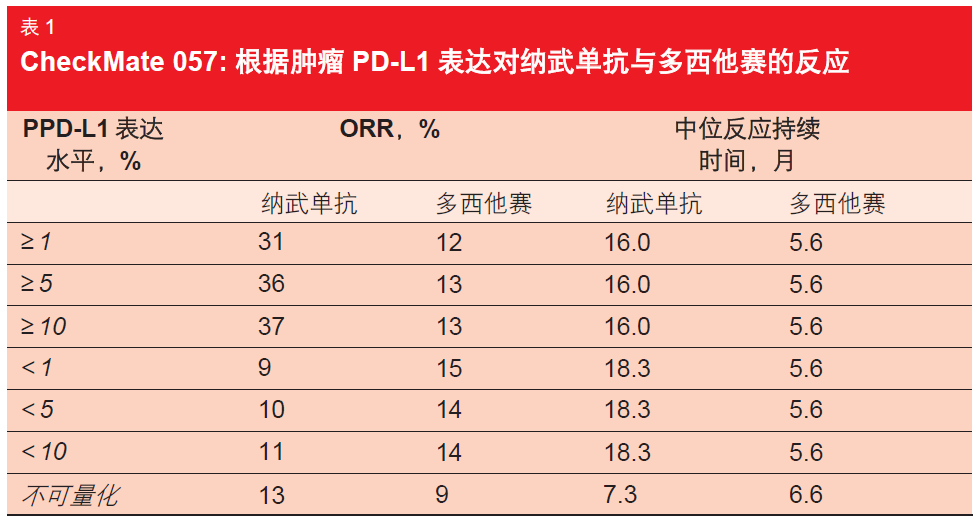
根据初步分析,纳武单抗能够显著提高 OS(使用纳武单抗与多西他赛的OS 分 别为 12.2 月和 9.4 月;p=0.0009),这使得死亡风险下降28 %[3]。尽管两种治疗药物的 Kaplan-Meier 曲线在开始时出现交叉,但分析清楚地表明免疫疗法在长期会产生一致的受益[4]。在第 18 个月,两种药物的 OS 率分别为 39 %和 23 %。此外,初步分析证明纳武单抗在 ORR(19 %与 12 %;p=0.0246)和反应持续时间(17.2 与 5.6 月)方面的改善作用。在几乎所有亚群中还观察到对纳武单抗的优异反应,这一受益在既往吸烟者和现时吸烟者人群中尤为突出(ORR:22 %与 11 %)。相反,在带有阳性 EGFR 突变状态的患者人群中,纳武单抗的 ORR 略低于多西他赛(11 %与 16 %)。
一项探索性分析确定了在 PD-L1表达状态与纳武单抗功效之间存在潜在相关性。实际上,尽管两个治疗组 在 PD-L1 阴性亚群中显示出相似的生存率,但是当患者为 PD-L1 阳性时,接受纳武单抗治疗比接受多西他赛治疗表现出更好的效果。此外,在 PD-L1 表达状态与 ORR 之间存在相关性,再一次对 PD-L1 阳性肿瘤患者显示出优势(表 1)。另一方面,反应持续时间未受到 PD-L1 状态的影响。
CheckMate 057 中的患者报告结果
通过使用涵盖最重要肺癌相关症状(例如,疲劳、呼吸困难、疼痛、咳血、咳嗽、厌食等)的预先规定肺癌症状量表调查问卷,研究人员对症状负担进行了评价。预定次要终点是第12 周的症状改善率。结局显示,两个治疗组之间的结果相似,但纳武单抗疗法似乎更优,并且能使症状随时间推移保持稳定。
在耐受性方面,分析显示施用纳武单抗导致的 AE 远少于对比组。这一优势对于 3/4 级治疗相关 AE、严重AE 和导致治疗中止的 AE 尤为显著。 然而,在一些患者身上出现了特定的免疫相关毒性反应,这些毒性反应在所有抗 PD-1 和抗 PD-L1 抗体的使用过程中都曾被描述过。总而言之,相比之下纳武单抗的安全特性优于多西他赛,并与以往的研究相一致。
作者得出的结论是,在CheckMate 057 中,纳武单抗继续在经预先治疗的晚期非鳞状 NSCLC 患者中表现出比多西他赛更优的 OS。受益幅度在 PD-L1 表达者中比在非表达者中更大,尽管在这两组人群中都存在一定的临床受益。
durvalumab 联合 tremelimumab
利用抗 CTLA-4 抗体和抗 PD-1 抗体的双重免疫检查点阻断是治疗黑色素瘤的一种既定选择。这两种方法通过不同但互补的机制来增强 T 细胞的抗肿瘤活性。该策略的显著效果包括特别明显的反应程度,这已知关联于改善的长期受益。在 CheckMate 012 试验中已经获 得了易 普 利姆玛(ipilimumab)加纳武单抗在抗肺癌 活性方面的前景;在该项试验中,晚期 NSCLC 患者在一线条件下接受这两种抗体的治疗[5]。这种联合用药产生了深而持久的反应。
可能有用的另一对药物是抗 PD-L1 抗体 durvalumab 和抗 CTLA-4 抗体 tremelimumab。一项非随机开放标签 Ib 期剂量递增和剂量扩大试验评价了这种组合在晚期 NSCLC 患者身上的安全性和抗肿瘤活性[6]。试验中对多种剂量组合进行了测试:durvalumab施用剂量为每 2 周或每 4 周一剂,总共分别为 26 或 13 剂,每剂药量为 3 mg/kg、10 mg/kg、15 mg/kg 或 20 mg/kg;而 tremelimumab 的施用剂量为每 4 周一剂,共 6 剂,之后每 12 周3 剂,每剂药量为 1 mg/kg、3 mg/kg或 10 mg/kg。这些治疗持续 1 年或直到出现疾病进展。通过免疫组织化学法对 PD-L1 表达进行了评估。
从 2015 年 6 月 1 日起,在美国五个中心已有 102 名患者接受剂量递增期治疗。其中大部分患者患有非鳞状细胞癌,并且多数为既往吸烟者或现时吸烟者。这些患者中超过一半的人已经接受过二线或三线治疗。
持久反应
在整个研究人群中 3/4 级 AE 率为42 %。免疫相关 AE 同预期一致,其中最常出现的是胃肠道毒性。在 32 %的患者中观察到腹泻,并有 11 %的患者出现等级≥3 的症状。皮疹和搔痒也有出现,但局限于 1 级和 2 级。增加的tremelimumab 剂量降低了治疗的耐受性。例如,肺炎在 1 mg/kg 的剂量下未曾出现,但是在 3 mg/kg 和 10 mg/kg 的剂量下则表现出相当高的发生率。发生在 tremelimumab 1 mg/kg人群中的大多数 AE 都可以使用标准治疗指南予以管理和逆转。
幸运的 是,1 mg/kg 的tremelimumab 剂量就足以实现显著的抗肿瘤 活性。 在施用 1 mg/kg tremelimumab 的群体中,总人群的ORR 为 28 %,二线患者的 ORR 为44 %。对该药物的反应与 PD-L1 表达无关,因此即便患者未表现出任何PD-L1 表达,也会发生反应。至数据截止时已有 66 %的患者获得持续反应,这显示出该治疗活性的持久性。
与 2015 年 ASCO 大会上展示的通
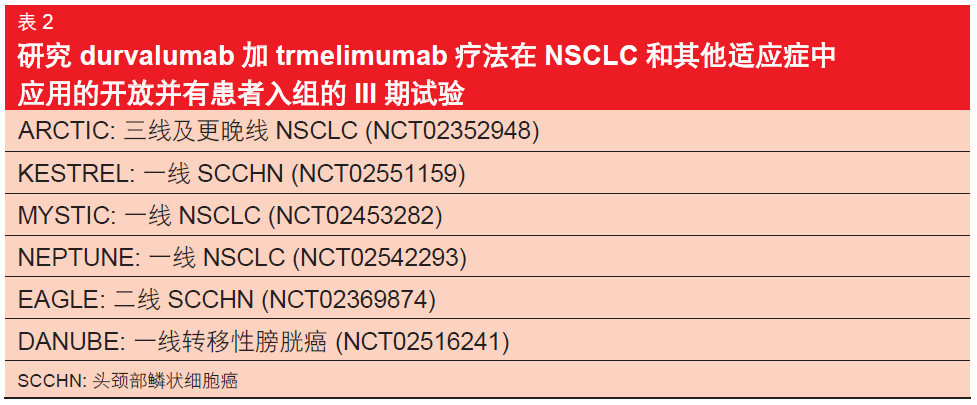
过单独使用 durvalumab 获得的单药治 疗数据相比[7 ], du r v al umab 加tremelimumab 联合疗法产生了显著提高的 ORR。每 4 周 20 mg/kg 的durvalumab 与每 4 周 1 mg/kg 的tremelimumab 的联合治疗方案被选中用于在 III 期条件下进行评价。该联合 疗法在 NSCLC 及其他适应症中的多项III 期试验已经开放并有患者入组(表2)。
参考文献
- Soria J-C et al., Efficacy and safety of pembrolizumab (Pembro; MK-3475) for patients (Pts) with previously treated advanced non–small-cell lung cancer (NSCLC) enrolled in KEYNOTE-001. ECC 2015, abstract 33LBA
- Herbst RS et al., KEYNOTE-010: Phase 2/3 study of pembrolizumab (MK-3475) vs docetaxel for PD-L1–positive NSCLC after platinum-based therapy. ESMO Asia 2015, abstract LBA3_PR
- Paz-Ares L et al., Phase III, randomized trial (CheckMate 057) of nivolumab (NIVO) versus docetaxel (DOC) in advanced non–squamous cell (non-SQ) non–small-cell lung cancer (NSCLC). J Clin Oncol 33; 2015 (suppl; abstr LBA109)
- Horn L et al., Phase 3, randomized trial (CheckMate 057) of nivolumab vs docetaxel in advanced non–squamous (non-SQ) non–small-cell lung cancer (NSCLC): subgroup analyses and patient-reported outcomes (PROs). ESMO Asia 2015, abstract 417O
- Rizvi NA et al., Safety and efficacy of first-line nivolumab (NIVO; anti-programmed death-1 [PD-1]) and ipilimumab in non–small-cell lung cancer (NSCLC). 16th World Conference on Lung Cancer, 2015, abstract 786
- Rizvi NA et al., Phase 1b study of the safety and antitumour activity of durvalumab (MEDI4736) plus tremelimumab in advanced NSCLC. ESMO Asia 2015, abstract 418O
- Rizvi NA et al., Safety and clinical activity of MEDI4736, an anti-programmed cell-death-ligand 1 (PD-L1) antibody, in patients with non–small-cell lung cancer (NSCLC). J Clin Oncol 33, 2015 (suppl; abstr 8032)
More posts
免疫疗法:毒性管理
免疫疗法:毒性管理 免疫检查点抑制剂的毒性从根本上源于它们是以一种生理学方式促进 T 细胞活性。“免疫系统的放大导致自体免疫性疾病,”Ross Soo 解释称(Ross S
“PD-L1 表达如噩梦般复杂”
“PD-L1 表达如噩梦般复杂” 免疫疗法在未经筛选的病人中能产生有利作用。然而,生物标志物的使用是非常值得欢迎的。这样做的理由之一是出于遏制医疗系统中资金紧张的考虑,通过
免疫疗法:大量预治疗之后令人瞩目的抗肿瘤活性
免疫疗法:大量预治疗之后令人瞩目的抗肿瘤活性 抗 PD-1 抗体派姆单抗( pembrolizumab )和纳武单抗(nivolumab)已被证明对肺癌具有活性。派姆单抗是
寡转移疾病患者的风险与机会
寡转移疾病患者的风险与机会 在全身治疗不断进步的背景下,对于患有有限数目血行转移瘤的 NSCLC 患者的潜在治愈期望与日俱增。Suresh Senan 博士(MRCP、FR
使用 EGFR TKI 疗法后的疾病进展:在埃罗替尼、吉非替尼和阿 法替尼之后还有哪些手段?
使用 EGFR TKI 疗法后的疾病进展:在埃罗替尼、吉非替尼和阿 法替尼之后还有哪些手段? 用于EGFR 突变阳性 NSCLC 患者的一线治疗方案包括第一代可逆 EGFR
EGFR 突变阳性非小细胞肺癌:扩大用于既定治疗方案的数据 池
EGFR 突变阳性非小细胞肺癌:扩大用于既定治疗方案的数据 池 LUX-Lung 3 和 6 的亚群分析 伴有激活的表皮生长因子受体(EGFR )突变的非小细胞肺癌(NSC