寡转移疾病患者的风险与机会
在全身治疗不断进步的背景下,对于患有有限数目血行转移瘤的 NSCLC 患者的潜在治愈期望与日俱增。Suresh Senan 博士(MRCP、FRCR 就职于荷兰阿姆斯特丹 VU 大学医学中心[1])解释称:“大多数研究将寡转移定义为一到三个或者一到五个病灶”[1]。根据临床情况,存在同时性(在原发性肿瘤诊断时检出的)和异时性(在对原发性肿瘤治疗后出现的)寡转移瘤。如 Senan 博士所指出,能够区分这这两者的时间间隔不是标准化的,但通常使用 6-12 个月的时间跨度。
术语“寡复发”描述受控原发性肿瘤条件下的寡转移。另一方面, “寡进展”是指有限数量的已知转移病灶的进展,同时所有其他转移都通过全身疗法得到控制。
预后因素的识别
切除疗法包括手术切除、立体定向放疗和射频消融。但是,关于这些治疗普遍缺乏证据,并且可能由于包括选择偏倚或恒定时间偏倚等几种类型的偏倚而造成数据不可靠。Senan 博士报告称:“对转移瘤进行积极治疗可提高生存率所能依据的唯一高度可信证 据是在脑转移瘤患者中获得的”。1990年公布的一项试验表明,对于患有单一脑病灶的患者,在全脑放疗(WBRT)基础上增加手术切除可将中位 OS 提高 15 至 40 周[2]。根据另外一项研究,在患有多达三个 CNS 转移瘤的患者中,在 WBRT 之外增加的放射外科手术提供了一定的 OS 受益(6.5 月相比单独采用 WBRT 的 4.9月)[3]。
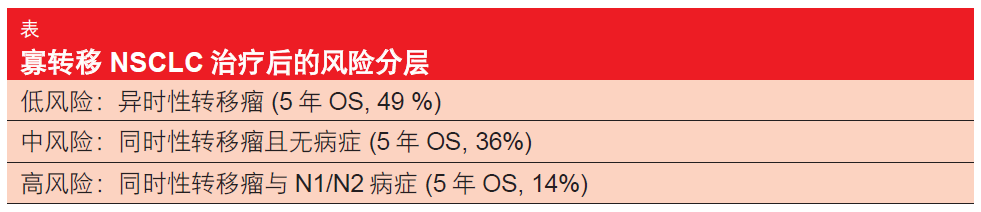
一项针对 757 名患有一到五个同时性或异时性转移瘤的 NSCLC 患者进行的荟萃分析对治疗之后获得良好预后的影响因素进行了研究[4]。Senan博士称:“这些患者总体上比较年轻,并且具有良好的机体表现状态”。重要的是,在排除了转移病变之后,三分之二的病人患有早期胸内病变(IA-IIB 期,而不是 III 期)。因此,他们很难代表平均 NSCLC 患者人群。中位 OS 有利地为 26 个月,5 年OS 率为 30 %。研究人员发现了提高OS 的以下预测因子:异时性转移瘤与 同时性转移瘤(p < 0.001),N 分期(p = 0.002),以及腺癌组织学(p = 0.036)。通过递归分区分析定义了三个风险组(表)。
辐照技术
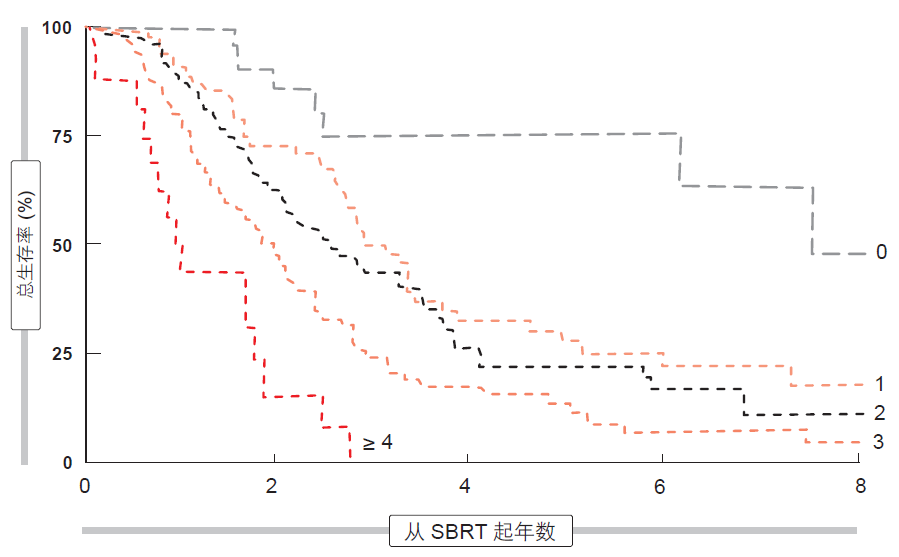
立体定向体部放疗(SBRT)是一种用于以高精确度向颅外目标递送高剂量体外放射治疗的技术。利用 SBRT 进行寡转移癌症治疗的最大患者群体包括来自丹麦的 321 名癌症患者[5]。有利预后因素为 0-1 的机体表现状态、孤立性转移瘤、< 30 mm 的转移病灶直径、异时性转移瘤以及 SBRT 前化疗。当存在四种或更多种不利因素时,SBRT 后的 OS 大幅下降(图)。
对于带有一至四个直径小于或等于 4cm 脑部病灶的患者,立体定向放射外科手术(SRS)是一种公认的治疗方式[6 ]。单独或者与手术切除或WBRT 联合运用 SRS 可以对脑转移瘤患者产生良好的局部控制。对于WBRT 的作用目前存在争议。来自在264 名患者中进行的三项 III 期试验的汇总分析表明,在 50 岁或更年轻患者中,可以忽略 WBRT 而不产生任何有害影响[7]。对于这组人群,单独进行SRS 治疗就已足够。类似地,对于场外脑转移瘤(远处脑功能衰竭)也存在年龄效应:年轻患者接受单独 SRS治疗未遭遇场外脑复发风险增加,而添加 WBRT 则降低了 50 岁以上患者的风险。“部分争议在于,是否有必要对老年人脑部进行辐照,”Senan 博士称,“我们很多人采取的办法是让这些病人每三个月做一次 MRI 复查,并在后来出现转移瘤时对其进行治疗。”
图: 不利预后因素数目对应的 SBRT 后生存率
带有 EGFR 或 ALK 畸变的患者
考虑到丰富的新治疗选择,一个需要回答的问题是,消融性放疗是否能补充靶向药物和免疫疗法。在经 TKI 治疗的患者中,在检出无症状转移性脑部病灶后,显然并不是迫切需要辐照治疗。Senan 博士解释称:“我们可以等待全身治疗开始发挥作用”。一旦病情进展来临,有合理的机会实现局部控制。在一项全球性 II 期试验中,对患有 ALK 重排的克唑替尼难治性NSCLC 及基线 CNS 转移瘤(可测量或不可测量)且之前未接受过放疗的患者施以艾乐替尼,这些患者表现出57 %的完全 CNS 反应率[8]。带有可测量基线病灶的患者获得了 57 %的 CNS ORR。根据 2014 年起的 ESMO 指南,可以利用局部治疗(例如外科手术或放疗)切除靶向治疗期间出现的寡转移进展,同时继续或重新开始 TKI 治疗[6]。在开始局部治疗之前,推荐对 疾病程度进行全面评估,包括 CNS 造影。
“目前,我们倾向于对没有高症状负荷的病人施加全身治疗,”Senan博士报告称,“如果他们的病情发生进展,则按需使用立体定向放疗。” 在继续进行全身治疗的同时,限于对疑似引起患者症状的特定病灶实施的局部治疗可以作为一种选择。
放射加免疫疗法:增强局部免疫系统
由于放射疗法已被证明既有免疫调节作用又有免疫抑制作用,因此在免疫疗法的背景下出现了另一个挑战。辐照诱使肿瘤细胞凋亡,释放肿瘤抗原,并且使钙网蛋白和 HMGB-1 等免疫原性细胞死亡受体表达,还会引起MHC-1 等免疫原性细胞表面标志物上调[9]。免疫细胞寻靶和抗原提呈得到改善。另一方面,PDL1 表达也有增加,并且皮肤中的朗格汉斯细胞游移到淋巴部位,从而导致调节性 T 细胞的上调[10]。
放射疗法引人注意的特殊性质之一在于异位效应这一相对少见的现象。这一术语是指远离受辐照肿瘤部位的、未受辐照的转移病灶出现的消退。这些反应据信是免疫介导的[11]。 “有关于此的想法是,将放疗与免疫疗法相结合可能会增大异位效应,” Senan 博士指出[12]。“因此可以尝试开始这种治疗,而反应率预计会得到增大。”但是,诸如最优顺序和放射剂量等一些问题仍不明确。
当前困境
迄今为止,仍十分缺乏放射治疗与新药的次序和联用的安全性数据。由于很多药物正快速得到批准,因此这个问题变得格外有意义。Senan 博士强调称:“我们现在对放射技术的选择 更加谨慎”。当发生并发症时,比如接受 TKI 治疗的患者出现肠穿孔,真正的原因将难以确定。另外,有时在跨学科团队中可能会出现相互矛盾的建议。“肺科医生可能要求患者继续进行全身治疗,而放射肿瘤科医生却可能会让这些患者停止全身治疗直到放疗结束。”
总而言之,由于高质量的证据仍有待产生,在使用多模式手段时需要小心谨慎。Senan 博士总结称:“在 潜在受益与意外发病和死亡风险之间必须作出平衡”。
参考文献
- Palma DA et al., The oligometastatic state – separating truth from wishful thinking. Nat Rev Clin Oncol 2014; 11(9): 549-557
- Patchell RA et al., A randomized trial of surgery in the treatment of single metastases to the brain. New Engl J Med 1990; 322(8): 494-500
- Andrews DW et al., Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase III results of the RTOG 9508 randomised trial. Lancet 2004; 363(9422): 1665-1672
- Ashworth AB et al., An individual patient data meta-analysis of outcomes and prognostic factors after treatment of oligometastatic non-small-cell lung cancer. Clin Lung Cancer 2014; 15(5): 346-355
- Fode MM & Høyer M, Survival and prognostic factors in 321 patients treated with stereotactic body radiotherapy for oligo-metastases. Radiother Oncol 2015; 114(2): 155-160
- Besse B et al., 2nd ESMO Consensus Conference on Lung Cancer: non–small-cell lung cancer first-line/ second and further lines of treatment in advanced disease. Ann Oncol 2014; 25(8): 1475-1484
- Sahgal A et al., Phase 3 trials of stereotactic radiosurgery with or without whole-brain radiation therapy for one to four brain metastases: individual patient data meta-analysis. Int J Radiat Oncol Biol Phys 2015; 91(4): 710-717
- Ou S-H et al., Alectinib in crizotinib-refractory ALK-rearranged non–small-cell lung cancer: a phase II global study. J Clin Oncol 2015; Nov 23. pii: JCO639443. [Epub ahead of print]
- Daly ME et al., Clinical trials integrating immunotherapy and radiation for non–small-cell lung cancer. J Thorac Oncol 2015; 10(12): 1685-1693
- Zitvogel L & Kroemer G, Subversion of anticancer immunosurveillance by radiotherapy. Nat Immunol 2015; 16(10): 1005-1007
- Grimaldi AM et al., Abscopal effects of radiotherapy on advanced melanoma patients who progressed after ipilimumab immunotherapy. Oncoimmunology 2014; 3: e28780
- Postow MA et al., Immunologic correlates of the abscopal effect in a patient with melanoma. N Engl J Med 2012; 366(10): 925-931
More posts
免疫疗法:毒性管理
免疫疗法:毒性管理 免疫检查点抑制剂的毒性从根本上源于它们是以一种生理学方式促进 T 细胞活性。“免疫系统的放大导致自体免疫性疾病,”Ross Soo 解释称(Ross S
“PD-L1 表达如噩梦般复杂”
“PD-L1 表达如噩梦般复杂” 免疫疗法在未经筛选的病人中能产生有利作用。然而,生物标志物的使用是非常值得欢迎的。这样做的理由之一是出于遏制医疗系统中资金紧张的考虑,通过
免疫疗法:大量预治疗之后令人瞩目的抗肿瘤活性
免疫疗法:大量预治疗之后令人瞩目的抗肿瘤活性 抗 PD-1 抗体派姆单抗( pembrolizumab )和纳武单抗(nivolumab)已被证明对肺癌具有活性。派姆单抗是
寡转移疾病患者的风险与机会
寡转移疾病患者的风险与机会 在全身治疗不断进步的背景下,对于患有有限数目血行转移瘤的 NSCLC 患者的潜在治愈期望与日俱增。Suresh Senan 博士(MRCP、FR
使用 EGFR TKI 疗法后的疾病进展:在埃罗替尼、吉非替尼和阿 法替尼之后还有哪些手段?
使用 EGFR TKI 疗法后的疾病进展:在埃罗替尼、吉非替尼和阿 法替尼之后还有哪些手段? 用于EGFR 突变阳性 NSCLC 患者的一线治疗方案包括第一代可逆 EGFR
EGFR 突变阳性非小细胞肺癌:扩大用于既定治疗方案的数据 池
EGFR 突变阳性非小细胞肺癌:扩大用于既定治疗方案的数据 池 LUX-Lung 3 和 6 的亚群分析 伴有激活的表皮生长因子受体(EGFR )突变的非小细胞肺癌(NSC