小细胞肺癌治疗成功的决定因素
预测特征在CASPIAN中……
随机化、对照、开放标签、III期CASPIAN试验评估了在广泛期小细胞肺癌(ES-SCLC)患者中使用度伐鲁单抗±替西木单抗(tremelimumab)加铂/依托泊苷(EP)对比仅使用EP作为一线治疗。与仅使用EP相比,度伐鲁单抗加EP显著改善OS(HR,0.73;P = 0.0047)[1]。这一获益在中位随访超过2年后得以维持(12.9与10.5个月;HR,0.75;p = 0.0032)[2]。在24个月时,22.2%与14.4%的患者存活。进行了探索性分析,以识别可能预测获得长期获益患者结果的临床特征,以及组织肿瘤突变负荷(tTMB)与疗效的关系[3]。PFS ≥ 12个月被用作初步阈值,以识别治疗患者中的潜在预测参数。
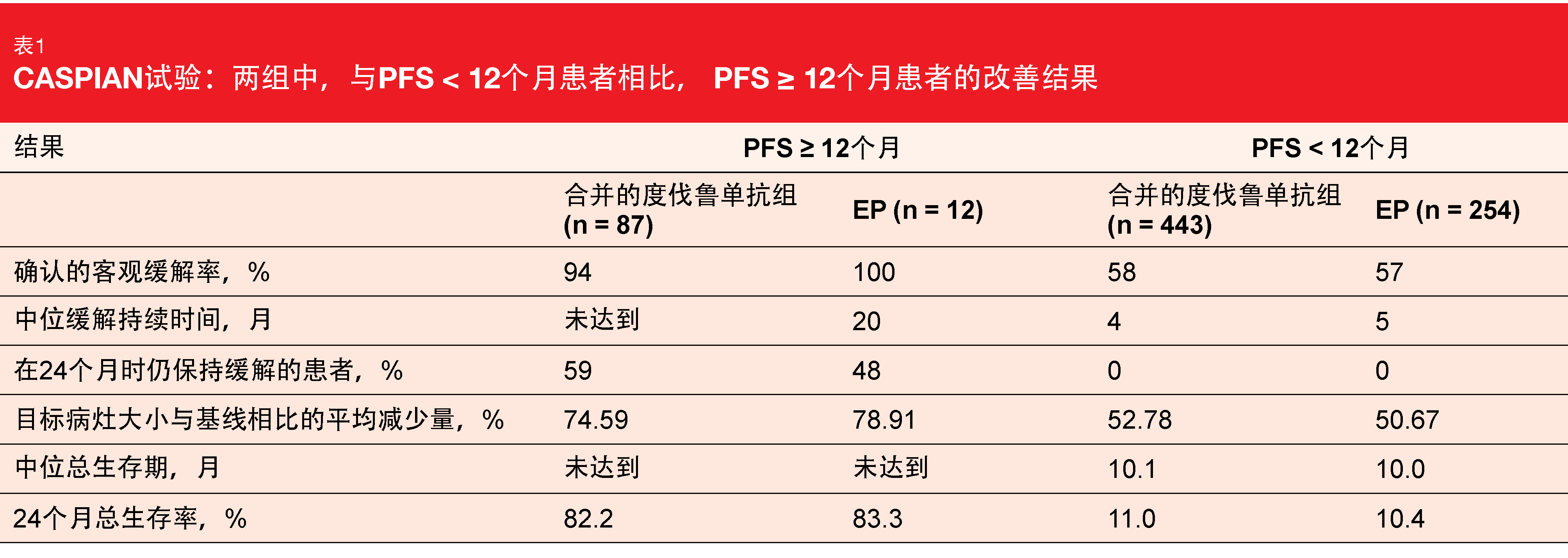
在度伐鲁单抗加EP组中,265名患者中有45名(17.0%)实现了PFS ≥ 12个月,在度伐鲁单抗加替西木单抗加EP组中,266名患者中有42名(15.8%)。对于两个免疫疗法组合并而言,实现PFS ≥ 12个月的患者比例(87/531,16.4%)是EP组(12/266,4.5%)的3倍以上。与PFS < 12个月的亚组相比,所有组别中PFS ≥ 12个月的患者的ORR、缓解持续时间、缓解深度和OS均有改善(表1)。2年OS率超过75%,这代表了优异的长期获益。
然而,没有独特的临床特征来识别那些获得长期获益的患者。在所有治疗组中,PFS ≥ 12个月的患者表现出较高的传统有利预后因素的发生率,如ECOG表现状态为0和没有脑或肝转移,尽管不良预后因素也存在于相当比例的患者中。PFS ≥ 12个月和< 12个月的组别在使用顺铂或总体化疗暴露方面没有差异。此外,tTMB没有显示出可以预测度伐鲁单抗±替西木单抗加EP与仅EP在任何截止点或作为连续变量的OS改善。尽管在PFS ≥ 12亚组中,度伐鲁单抗的暴露量更大且免疫介导的AE的发生率在数值上更高,但3/4级AE的发生率与PFS < 12亚组相似,严重AEs和导致停药的AE也相似。对度伐鲁单抗长期获益的预测因素的进一步调查正在进行中。
……以及在IMpower133中
在双盲、安慰剂对照的III期IMpower133试验中评估了阿特珠单抗加卡铂/依托泊苷用于ES-SCLC的一线治疗。与安慰剂加卡铂/依托泊苷相比,基于免疫疗法的方案带来了OS(12.3与10.3个月;HR,0.70;P = 0.007)和PFS(5.2与4.3个月;HR,0.77;P = 0.02)改善[4]。额外的随访显示,实验组OS持续获益,12、18和24个月时的生存率增加,确立了IMpower133方案为新的护理标准[5]。由于关于经历长期生存的患者特征的数据有限,Liu等人介绍了表征长期生存者(LTS)的探索性分析,该长期生存者定义为自随机化以来存活≥ 18个月的患者[6]。
IMpower133各研究组的比较显示,阿特珠单抗加化疗的LTS比例(182名患者中61名,33.5%)大于安慰剂加化疗(191名患者中39名,20.4%)。对于每个患者特征(即,性别、年龄、ECOG表现状态),LTS组接受过阿特珠单抗加化疗的患者多于单独化疗。同样的情况也适用于通常与更大的疾病负荷相关联的疾病特征(即,转移部位的数量、存在肝转移或脑转移、LDH水平升高、目标病灶最长直径之和较大)。就其中的每一项而言,LTS更有可能接受过阿特珠单抗而不是安慰剂。
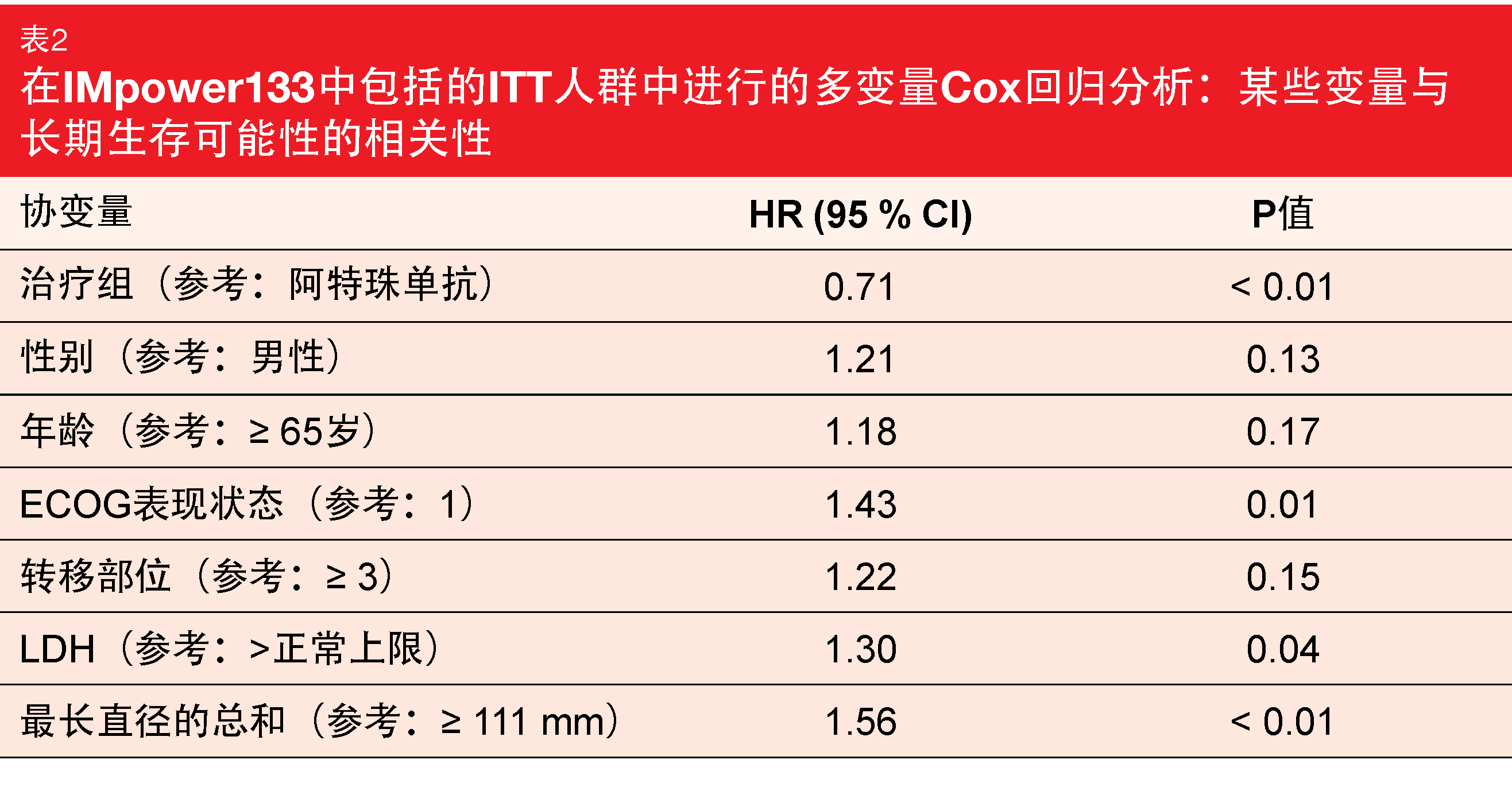
根据生物标志物分析,使用各种截止值的高血基TMB和PD-L1表达与长期生存的可能性无关。因此,TMB和PD-L1状态在患者选择中似乎都没有实用性。在多变量Cox回归分析中,仅更差的表现状态、LDH水平升高和最高的最长直径之和被证实为不良预后变量(表2)。在多变量模型中,调整其他协变量后,阿特珠单抗治疗对OS的影响更为明显,HR显著为0.71。正如作者所总结,这些探索性分析表明,无论评估的患者和疾病特征如何,ES-SCLC患者可以从添加阿特珠单抗加化疗中获得益处,证实阿特珠单抗加卡铂/依托泊苷作为未经治疗的ES-SCLC患者的护理标准。
STIMULI:巩固免疫疗法
对于局限期SCLC(LS- SCLC)患者,化放疗(CRT)后进行预防性脑照射(PCI)是标准的根治性策略。全球性、随机化II期ETOP/IFCT 4-12 STIMULI试验旨在证明纳武单抗加易普利姆玛(ipilimumab)作为巩固治疗在CRT和PCI后未进展的LS-SCLC(I-IIIB期)患者中的优效性[7]。诱导期包括纳武单抗 1 mg/kg和易普利姆玛3 mg/kg Q3W,共4个周期,随后维持纳武单抗 240 mg Q2W,最长12个月。对照组中的患者没有接受任何进一步治疗。共有153名患者被随机分配到纳武单抗加易普利姆玛(n = 78)或观察(n = 75)。由于管理原因,累积提前结束。此外,LS-SCLC病例的识别率出乎意料地低,且流失率高(即无法完成CRT和PCI的患者比例)。由于这些原因,在最初的设计中加入了共同主要终点后,最终将主要结果定义为PFS。
STIMULI试验没有达到其主要终点(中位PFS,巩固和观察分别为10.7与14.5个月;HR,1.02;P = 0.93)。实验组中至治疗停止的中位时间短至1.7个月,而在12个月时,仅有15.6%的患者仍在接受治疗。这潜在解释了交叉多次曲线的相似趋向。
某些亚组中的获益
根据亚组分析,ECOG表现状态为1的患者和每天接受两次分次放疗的患者似乎从纳武单抗加易普利姆玛中获得了PFS获益(HR,分别为0.67和0.63)。
分析时,实验组中尚未达到OS,而对照组的OS为31.6个月;这种差异并不显著(HR,1.06;P = 0.83)。同样,ECOG PS 1(HR,0.44)和每日两次放疗(0.41)的患者以及女性患者(HR,0.34)均有获益。
两个治疗组均表现出相同的进展模式。在纳武单抗加易普利姆玛组中,大多数治疗失败是由于毒性,而在对照组中,疾病进展构成了治疗失败的最常见原因。治疗相关的3级到5级AE发生率为51%与25%,其中大部分(49%)导致实验组中治疗中止。最常见的任何原因AE包括疲劳、厌食、腹泻、呕吐、肺炎、恶心和咳嗽。
作者在结论中指出,与毒性和治疗中止相关而导致的主动治疗时间较短,肯定影响了STIMULI试验的疗效结果。更长时间的随访将可以探索免疫疗法巩固对生存期可能产生的晚期效应,在目前短期的随访后,这种效应已经显现出来。同时,探索性转化工作也在进行中,以识别可以从巩固免疫疗法中获益的生物标志物定义的亚组。
参考文献
- Paz-Ares L et al., Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet 2019; 394: 1929-1939
- Paz-Ares L et al., Durvalumab ± tremelimumab + platinum-etoposide in first-line extensive-stage SCLC: updated results from the phase 3 CASPIAN study. J Clin Oncol 38: 2020 (suppl; abstr 9002)
- Goldman JW et al., Durvalumab ± tremelimumab + platinum-etoposide in 1L ES-SCLC: characterisation of long-term clinical benefit and tumour mutational burden in CASPIAN. ESMO 2020, LBA86
- Horn L et al., First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379(23): 2220-2229
- Reck M et al., IMpower133: updated overall survival analysis of first-line atezolizumab + carboplatin + etoposide in extensive-stage SCLC. Ann Oncol 2019; 30(suppl_5): v710-v717
- Liu SV et al., IMpower133: characterization of long-term survivors treated with first line chemotherapy ± atezolizumab in extensive-stage small cell lung cancer ESMO 2020, 1781MO
- Peters S et al., Consolidation nivolumab and ipilimumab vs observation in limited stage SCLC after chemo-radiotherapy – results from the randomized phase II ETOP/IFCT 4-12 STIMULI trial. ESMO 2020, LBA84
© 2020 Springer-Verlag GmbH, Impressum