恶性胸膜间皮瘤:在所有治疗线中的基于免疫疗法的方法
CheckMate 743的长期结果
随机化III期CheckMate 743试验评估了作为不可切除的恶性胸膜间皮瘤(MPM)患者的一线治疗的3 mg/kg纳武单抗Q2W加1 mg/kg伊匹单抗Q6W持续最多2年与顺铂或卡铂加培美曲塞Q3W持续6个周期的对比。超过300名患者被随机分配到各研究组。总生存期(OS)构成主要终点。实际上,双重检查点抑制显著延长了OS [1],并在许多国家被批准作为不可切除MPM的一线治疗。
Peters等人在ESMO 2021上报告了CheckMate 743的3年期最新结果[2]。除了临床评估外,研究人员还使用4基因炎症特征评分、肿瘤突变负荷(TMB)和肺免疫预后指数(LIPI)进行了探索性生物标志物分析。4基因炎症特征评分包括CD8A、STAT1、LAG3和CD274(PD-L1)基因,并且是通过肿瘤样品的RNA测序建立,而LIPI评分基于外周血中的LDH水平和中性粒细胞与淋巴细胞的比率。
根据3年期最新结果,与化疗相比,纳武单抗加伊匹单抗继续提供持久的益处。所有随机化患者的OS为18.1个月与14.1个月,对应于风险降低27%(HR,0.73)。3年时,23%与15%的患者存活。与化疗相比,所有亚组都受益于免疫疗法。无进展生存期(PFS)保持不变(6.8与7.2个月;HR,0.92),但在24个月(PFS率,18%与7%)和36个月(14%与1%)时的获益延迟变得明显。尽管患者在分析时停止治疗一年,实验组的中位缓解持续时间仍更长(11.6个月与6.7个月)。在36个月时,免疫疗法组中28%的缓解者有持续缓解(而对照组为0%)。
治疗停药后无不利影响
探索性生物标志物分析表明,高4基因炎症特征评分与免疫疗法治疗的生存率提高之间存在相关性。在实验组中,高分和低分的中位OS分别为21.8个月和16.8个月(HR,0.57),并且这些患者中有35%和15%在36个月时存活。然而在化疗组中,生存率不因4基因炎症特征评分而变化。LIPI评分和TMB三分位数均未显示与OS相关。在另外12个月的随访后,安全性与之前的报告一致。治疗相关AE(TRAE)的总体发生率没有变化。
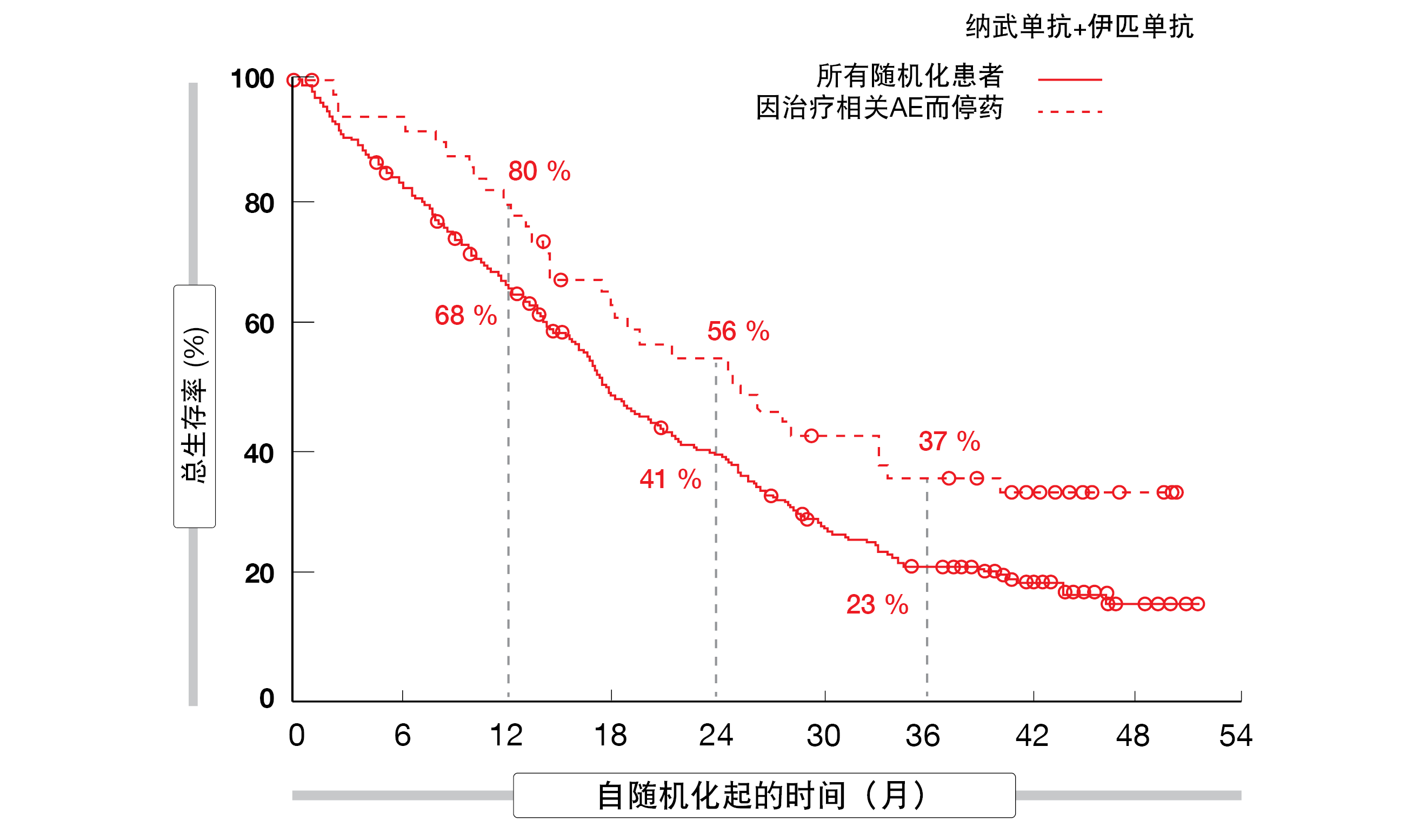
事后分析显示,在因TRAE停止治疗的患者中,停用纳武单抗加伊匹单抗的所有组分没有不利影响(图1)。停药后,34%的患者持续缓解≥3年,37%的患者在36个月时仍然存活。作者在总结中指出,CheckMate 743的这些数据证实,无论组织学如何,纳武单抗加伊匹单抗都是不可切除MPM的标准护理。
图1: CheckMate 743:与实验组中的总随机化人群相比,停用一线纳武单抗加伊匹单抗的患者的总生存率
帕博利珠单抗(pembrolizumab)加尼达尼布(nintedanib)用于r/r疾病
I期PEMBIB试验研究了帕博利珠单抗和三重血管激酶抑制剂尼达尼布的联合策略,用于治疗铂类化疗难治或治疗后复发的不可切除MPM患者。200 mg帕博利珠单抗Q3W给药,而150 mg尼达尼布每日服用两次,并进行7天的单药疗法导入。基于血液和肿瘤样品进行辅助分析。Danlos等人在ESMO 2021上报告了30名患者的结果[3]。大多数患者之前接受过一个全身性抗癌治疗线(77%),而分别有17%和6.7%的患者接受过2个和≥ 3个的全身抗癌治疗线。
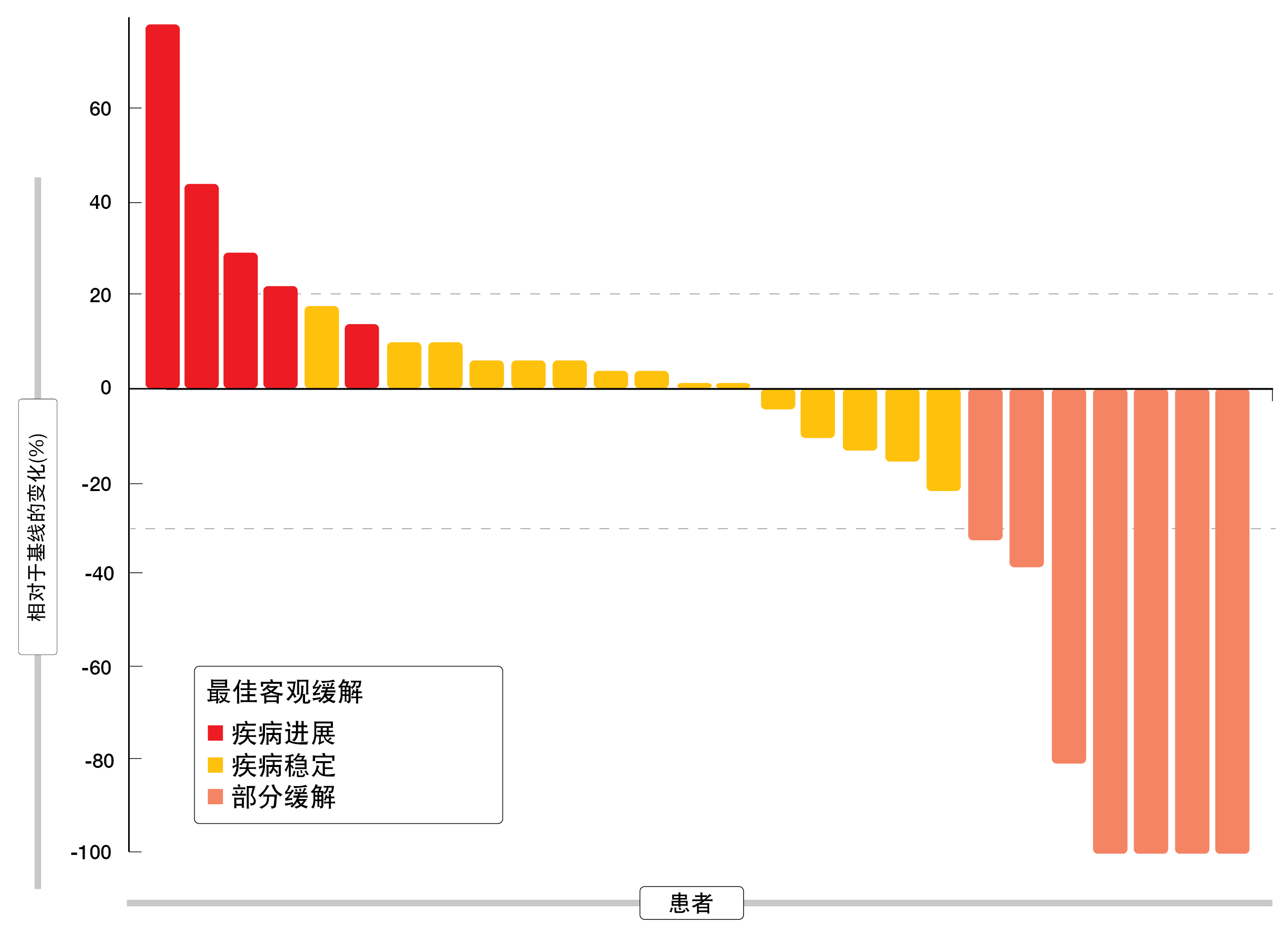
联合治疗产生了68.4%的12周疾病控制率(图2)。中位PFS为6.2个月。AE被证明是通常可控的,最常见的是腹泻、疲劳和呼吸困难。根据细胞因子测量结果,帕博利珠单抗加尼达尼布显示出相似的药效学效应。基线时肿瘤细胞和肿瘤浸润CD8+ T淋巴细胞的PD-L1表达似乎可以预测抗血管生成和抗PD-1疗效,因为它们在受益于治疗的患者中更为普遍。此外,较高的IL-6浓度显示出与原发性治疗耐药性相关,并与整体体细胞拷贝数改变(SCNA)评分相关。作者得出结论,由于致癌突变的积累,SCNA会导致IL-6介导的免疫抑制以及对抗血管生成和抗PD1疗法的耐药性。
图2: 采用帕博利珠单抗加尼达尼布在先前铂类化疗难治或治疗后复发的患者中观察到的缓解
阿特珠单抗的新辅助使用
S1619研究的设计基于以下假设:在新辅助化疗中加入PD-L1抑制剂,然后在手术切除和辅助放疗后进行维持免疫疗法可能会提高生存结果[4]。可切除MPM的化疗初治患者接受了1,200 mg阿特珠单抗Q3W,外加4个周期的75 mg/m2顺铂和500 mg/m2培美曲塞。在没有进展的情况下进行了手术,即胸膜外全肺切除术(EPP)或胸膜切除术和剥除术(P/D)。随后是一年的任选放疗和1,200 mg阿特珠单抗Q3W维持治疗。主要终点是该方法在24名可评估患者中的安全性、耐受性和可行性。
在28名符合条件的患者中,21名完成了新辅助治疗。18名疾病稳定或部分缓解的患者接受了手术;分别对17名患者和1名患者进行了P/D和EPP。15人接受了阿特珠单抗维持治疗。在分析时,三名患者仍在接受这种治疗。在三联方案或阿特珠单抗维持疗法的背景下,没有出现新的安全性信号,也没有报告延迟的治疗相关的>3级AE。其他功效数据将在未来的大会上更新。
参考文献
- Baas P et al., First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. Lancet 2021; 397: 375-386
- Peters S et al., First-line nivolumab + ipilimumab versus chemotherapy in patients with unresectable malignant pleural mesothelioma: 3-year update from CheckMate 743. ESMO 2021, LBA65
- Danlos FX et al., Pembrolizumab and nintedanib for patients with advanced pleural mesothelioma. ESMO 2021, 1732M0
- Tsao A et al., S1619 A trial of neoadjuvant cisplatin-pemetrexed with atezolizumab in combination and maintenance for resectable pleural mesothelioma. WCLC 2021, OA13.01
© 2022 Springer-Verlag GmbH, Impressum