卵巢癌:将PARP抑制更进一步
尼拉帕利(niraparib)的个性化用量
根据NOVA试验的结果,尼拉帕利已被批准作为铂敏感性复发性卵巢癌(OC)患者的维持治疗。NOVA中使用的起始剂量为每天口服300 mg。回顾性分析表明,基于基线体重和血小板计数的个性化起始剂量可能会改善尼拉帕利的安全特性,而不会影响疗效[2]。该方法通过NORA研究在铂敏感性复发性OC的中国患者中进行了测试,这些患者具有高级别浆液性或高级别主要浆液性的组织学或有种系BRCA突变[3]。这些妇女至少接受了2线含铂疗法,并且对最后一种治疗有部分或完全缓解。将她们随机分配为接受尼拉帕利(n = 177)或安慰剂(n = 88),直至疾病进展。基线体重≥77 kg且血小板计数≥150,000/μl的11名患者接受尼拉帕利的初始剂量为每天300 mg,而155名体重<77 kg且血小板计数<150,000/μl的患者每天接受200 mg治疗。由盲态独立中心审查确定的PFS构成主要结果。NORA是首个在中国OC患者中评估PARP抑制剂的全功率III期随机化对照研究。
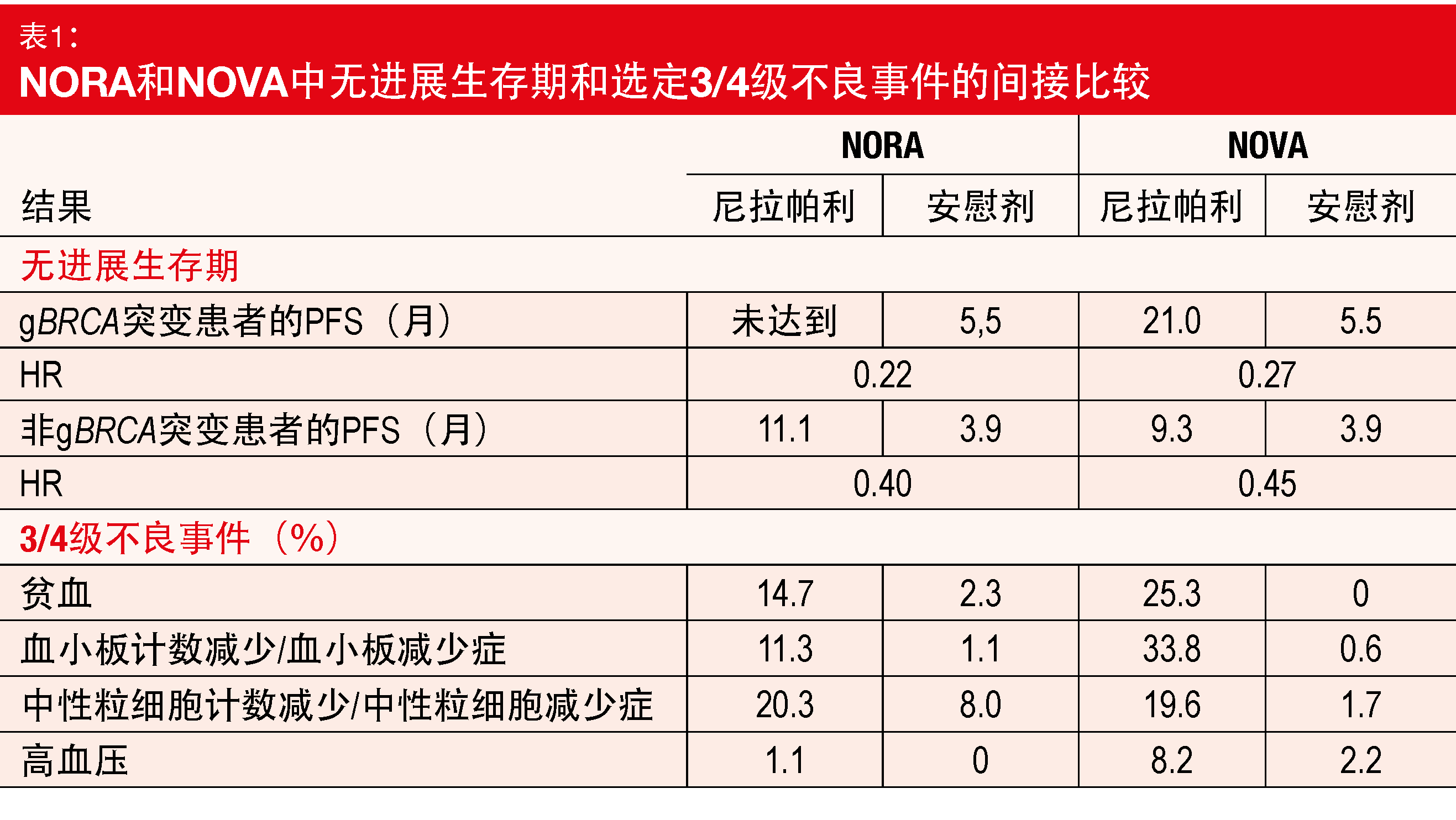
该试验达到了其主要终点。在ITT人群的实验组中,PFS显著延长,死亡率和进展风险降低了68%(18.3与5.4个月;HR,0.32;p < 0.0001)。具有和不具有种系BRCA突变的患者均获得显著的PFS益处(二者p < 0.0001;表1)。此外,尼拉帕利组的患者在无化疗间隔期(18.5与9.7个月;HR,0.34;p < 0.0001)和至首次后续治疗时间方面(16.7与7.7个月;HR, 0.35;p < 0.0001)表现更好。在分析时,OS尚不成熟。
在NORA中观察到的PFS益处与NOVA试验中报告的一致,而安全特性确实得到了改善(表1)。对血液学毒性更是如此。总体而言,作者指出,以个性化起始剂量使用的尼拉帕利有效且安全,应被视为OC患者维持治疗的标准临床实践。
MEDIOLA:奥拉帕尼(olaparib)加度伐鲁单抗(durvalumab)±贝伐单抗
VEGF抑制剂和奥拉帕尼的组合已显示出在铂敏感性复发性OC患者中与单独使用奥拉帕尼相比以及在新诊断的维持条件下与单独VEGF抑制相比增加PFS [4,5]。开放标签的II期篮子试验MEDIOLA研究奥拉帕尼加度伐鲁单抗的初步结果表明,该组合耐受性良好并且对生殖系BRCA突变型铂敏感性复发性OC患者有活性[6]。后续招募了另外两个队列,以在最多进行2条化疗线后的BRCA野生型铂敏感性复发性OC患者中测试奥拉帕尼加度伐鲁单抗(n = 32)以及奥拉帕尼加度伐鲁单抗和贝伐单抗(n = 31)。主要终点定义为24周时的疾病控制率(DCR)和安全性/耐受性。Drew等人在ESMO大会上介绍了发现[7]。
根据该分析,奥拉帕尼、度伐鲁单抗和贝伐单抗的无化疗三联组合显示出有希望的疗效。在第24周时,DCR高达77.4%,中位PFS达14.7个月。在双联组合队列中,24周DCR和PFS分别为28.1%和5.5%。三联队列和双联队列的客观缓解率分别为87.1%和34.4%。探索性分析表明,使用三联方案获得的ORR不依赖于基因组不稳定状态(GIS)。根据定义,在杂合性丢失评分≥14、具有体细胞BRCA突变或13个同源重组修复基因之一中具有突变的患者中,GIS为阳性。该分析表明,无论GIS如何,整个三联队列中的缓解率始终很高,这表明高ORR不受基因组不稳定状态的差异驱动。总体而言,双联和三联方案的安全特性与预期的单一药物安全特性相符。奥拉帕尼、度伐鲁单抗和贝伐单抗的组合目前正在III期DUO-O研究中作为一线维持方案的一部分进行测试。
新药帕米帕利的关键II期结果
研究性的、有效的、选择性的口服PARP1/2抑制剂帕米帕利已在首次人体BGB-290-AU-002研究中证明了对OC患者的抗肿瘤活性,该研究还确立了每天两次口服60 mg作为推荐的II期剂量(RP2D)[8]。BGB-290-102,一项开放标签、多中心的I/II期研究,正在评估帕米帕利在中国晚期实体瘤成年患者中的安全性和抗肿瘤活性,这些患者接受过标准疗法但疾病仍然进展,或没有可用的标准疗法。Wu等人报告了针对患有BRCA1/2突变阳性铂敏感性(PSOC;n = 90)或铂耐药性(PROC;n = 23)疾病的OC患者的试验的RP2D扩展的初步结果[9]。根据独立审查委员会的ORR被定义为主要终点。
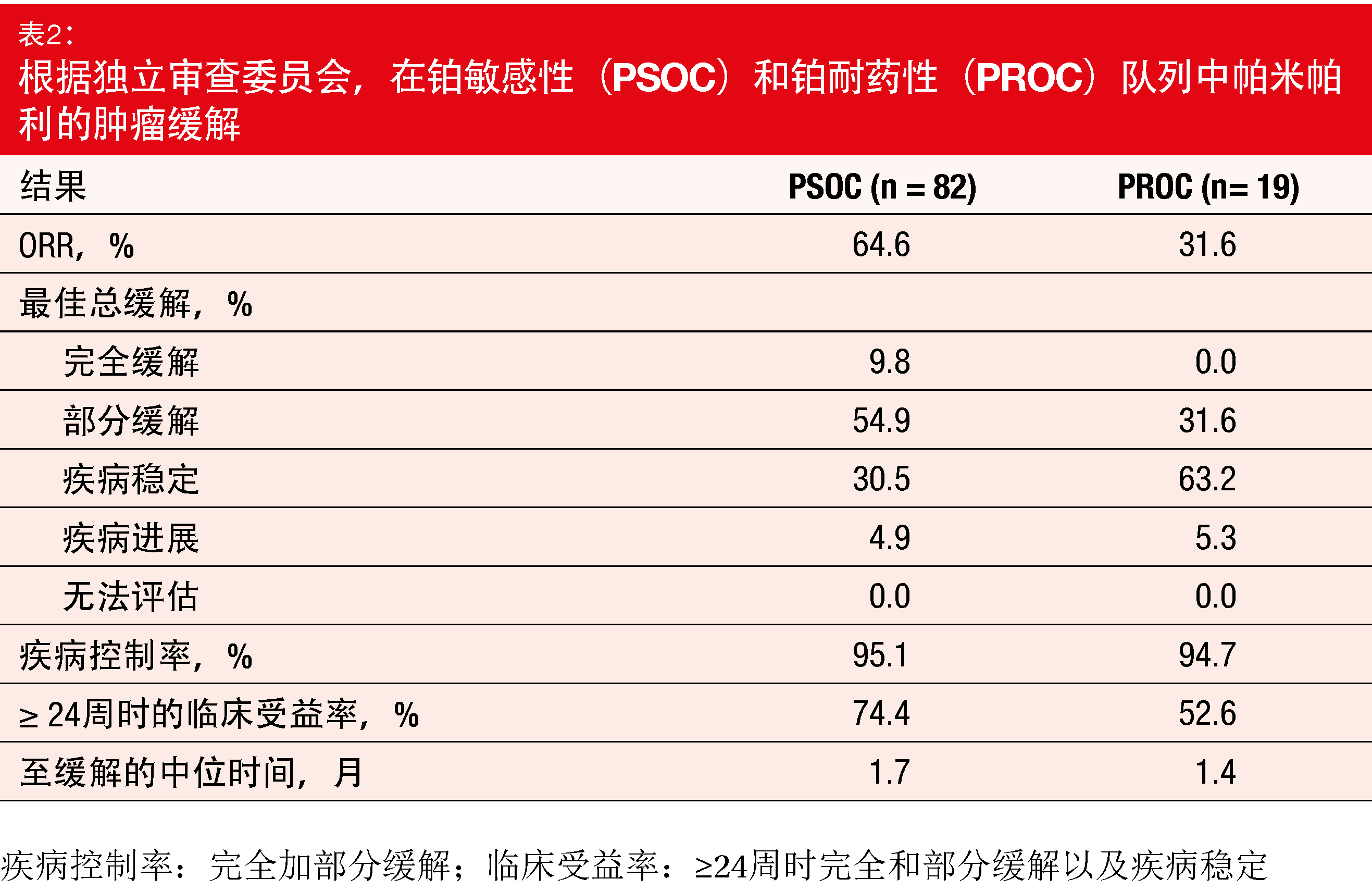
帕米帕利引起了临床上有意义且持久的缓解。PSOC队列中的大多数患者发生缓解(ORR,64.6%),其中9.8%达到了完全缓解(表2)。中位缓解持续时间为14.5个月,中位PFS为15.2个月。在PROC组中,ORR为31.6%。在PSOC和PROC队列中,分别有95.1%和94.7%的患者获得了疾病控制。在两组中,大多数患者的目标病灶均较基线减小。CA-125缓解率分别为79.7%和38.1%。
帕米帕利60 mg每天两次的耐受性总体良好,并显示出可接受的安全特性。与其他PARP抑制剂相似,血液毒性是观察到的最显著的安全性事件,不过已证明是可以控制的。使用主动修订计划和严密监控,优化了这些AE的管理。没有报告骨髓增生异常综合征,也没有发生潜在与血液毒性有关的重大并发症(例如,≥3级出血、发烧、感染)。总体安全特性在PSOC和PROC队列中总体上是一致的。
参考文献
- Mirza MR et al., Niraparib maintenance therapy in platinum-sensitive, recurrent ovarian cancer. N Engl J Med 2016; 375(22): 2154-2164
- Berek JS et al., Safety and dose modification for patients receiving niraparib. Ann Oncol 2018; 29(8): 1784-1792
- Wu X et al., Individualized starting dose of niraparib in patients with platinum-sensitive recurrent ovarian cancer (NORA): a randomized, double-blind, placebo-controlled, phase III trial. ESMO 2020, LBA29
- Liu et al., Combination cediranib and olaparib versus olaparib alone for women with recurrent platinum-sensitive ovarian cancer: a randomised phase 2 study. Lancet Oncol 2014; 15(11): 1207-1214
- Ray-Coquard I et al., Olaparib plus bevacizumab as first-line maintenance in ovarian cancer. N Engl J Med 2019; 381: 2416-2428
- Drew Y et al., An open-label, phase II basket study of olaparib and durvalumab (MEDIOLA): Results in germline BRCA-mutated platinum-sensitive relapsed ovarian cancer. Gynecol Oncol 2018; 149 Suppl 1: 246-247
- Drew Y et al., Phase II study of olaparib plus durvalumab and bevacizumab (MEDIOLA): initial results in patients with non-germline BRCA-mutated platinum sensitive relapsed ovarian cancer. ESMO 2020, 814MO
- Lickliter J et al., Dose escalation/expansion study to investigate the safety, pharmacokinetics, food effect, and antitumor activity of BGB-290 in patients with advanced solid tumors. Ann Oncol 2017; 28(suppl 5): v123
- Wu X et al., Phase 2 study of pamiparib in Chinese patients with advanced ovarian Cancer. ESMO 2020, 820P
© 2020 Springer-Verlag GmbH, Impressum
More posts
序言
序言 Ronan Kelly, MD, MBA 美国德克萨斯州达拉斯 贝勒大学医学中心Charles A. Sammons癌症中心主任 亲爱的同事们, 2020年线上ES