免疫疗法:新兴的治疗范例
15至20年前分子靶向药物的引入标志着一个新时代的开始。今天,免疫检查点抑制剂也已开启另一治疗模式。由于化疗和靶向药物直接作用在肿瘤上,这意味着耐药性最终会出现,而免疫疗法针对免疫系统,使一定比例的患者能够生存更长时间。在治疗开始后2年仍存活的晚期非小细胞肺癌(NSCLC)患者有些生存超过5年的。因此,晚期癌症治疗的新范例已经出现。
当前使用的三类免疫检查点抑制剂为:抗CTLA-4抗体(例如,易普利姆玛(ipilimumab),tremelimumab)、抗PD-1抗体(例如,纳武单抗(nivolumab)、派姆单抗(pembrolizumab))以及抗PD-L1抗体(例如,atezolizumab、durvalumab、avelumab)。
一线治疗的优势
在KEYNOTE-010研究中,抗PD-1抗体派姆单抗优于多西他赛(docetaxel)化疗,在化疗进展后患者中[1],至少50%的肿瘤细胞表达PD-L1的亚组(肿瘤比例得分[TPS] ≥ 50%)得到了最大获益。其中,派姆单抗治疗使总生存率(OS)和无进展生存期(PFS)有显著改善。
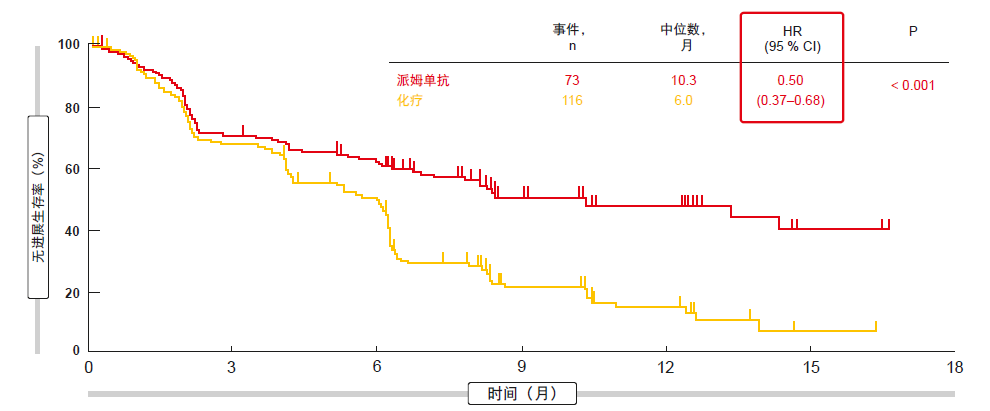
在一线条件下,KEYNOTE-024试验在305名PD-L1 TPS ≥ 50 %的患者中评估了每3周200 mg派姆单抗治疗两年与铂类双药化疗4-6个周期的比较[2]。在疾病进展的情况下,允许从对照组交叉到试验组;此时,患者继续接受试验组中派姆单抗的治疗方案。
分析显示,有利于派姆单抗的显著PFS差异(10.3与6.0个月;HR,0.50;p < 0.001;图1)。尽管存在交叉,但试验组患者的OS明显优于对照组患者(两组均未达到;HR,0.60;p = 0.005)。根据KEYNOTE-024的更新结果,尽管有效交叉率为60%,但OS曲线仍保持较高程度的分离[3]。所有这些都表明应从一开始,而非在化疗后给予免疫疗法。
图1: 在KEYNOTE-024中,派姆单抗与化疗无进展生存率
除了PD-L1表达之外的生物标志物
Gettinger等人研究了在预先治疗条件下,纳武单抗I期CA209-003研究中存活5年的16名患者的特点[4]。治疗2年后已终止使用纳武单抗。显然,初始应答预测了长期生存,因为大多数患者(75 %)在研究开始后不久就达到了部分缓解(PR)。
然而,缺乏应答是免疫疗法背景下的一个主要问题。即使在存在高PD-L1表达的情况下,也有约三分之一的患者对治疗没有应答。肿瘤在大多数情况下生长迅速,并且预后较差。在这种情况下,PD-L1表达不能作为生物标志物,原因在于其由肿瘤细胞与免疫系统之间的相互作用而产生,因此缺乏稳定性。
一项日本研究发现T细胞上归巢分子CD62L的表达是一种潜在的生物标志物[5]。研究人员根据以下假设评估了这一选择:某些患者中不同的预先存在的抗肿瘤免疫力可能导致对抗PD-1治疗的不同应答。在接受纳武单抗治疗的50名连续就诊的NSCLC患者中,达到PR或稳定疾病(SD)的患者显示比疾病进展的患者具有明显更多的下调CD62L(即CD62Llow)的CD4阳性T细胞(p = 4.1 x 10-7)。CD4阳性T细胞中CD62Llow的百分比在预测进展方面提供了92.9 %的灵敏度和96.7 %的特异性。此外,SD患者的调节性T细胞亚群明显少于PR人群(p = 0.0067),这意味着可以区别预测SD与PR。一项调查这些发现的前瞻性研究正在日本进行。
联合治疗
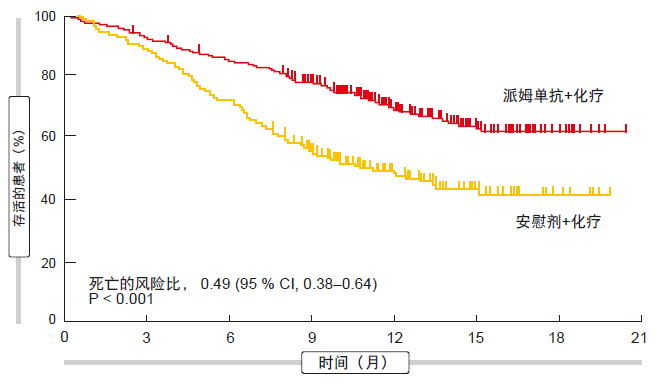
KEYNOTE-189试验在非鳞状NSCLC中评估了一线派姆单抗联合培美曲塞(pemetrexed)和顺铂(cisplatin)或卡铂(carboplatin)治疗4个周期[6]。对照组患者接受安慰剂代替派姆单抗以及试验组中的其他药物。方案没有根据PD-L1表达状态对富集进行规定,尽管这是一个分层因素。
与单独化疗相比,在标准化疗之外添加派姆单抗可显著改善PFS(HR,0.52;p<0.001)和OS(HR,0.49;p < 0.001;图2)。在12个月时,有69.2 %与49.4 %的患者存活。PFS曲线和OS曲线在治疗开始后即分开。PFS和OS获益在PD-L1表达≥ 50%的亚组中最为明显,较低PD-L1表达水平的患者同样在基于派姆单抗的方案中情况较好。
正在进行的KEYNOTE-407研究遵循KEYNOTE-189的步骤,在鳞状组织学肿瘤患者中对比了使用或不使用派姆单抗的一线化疗。在2018年ASCO大会上介绍了第二次中期分析的结果[7]。对于KEYNOTE-189,联合使用派姆单抗在PFS(6.4与4.8个月;HR,0.56;p < 0.0001)和OS(15.9与11.3个月;HR,0.64;p = 0.0008)方面均优于单独化疗。在该试验中,无论PD-L1表达如何,试验组获得的结果同样优于对照组的结果。
总体而言,无论组织学和PD-L1表达状态如何,免疫疗法联合化疗似乎都改善了临床结果。这些发现相比免疫检查点抑制剂单药治疗获得的结果是有利的,意味着一旦获得批准,大多数晚期NSCLC患者将会接受联合方案治疗。但是,必须牢记,这需要庞大的医疗费用。对于PD-L1表达较高的一些患者,单药治疗可能已经足够,尽管医生当然通常会更倾向于从患者安全性来考虑安全行事。
图2: KEYNOTE-189:接受派姆单抗加标准化疗治疗患者的总生存率
局部晚期NSCLC与新辅助条件
免疫疗法不但在转移性疾病中表现良好,而且在局部晚期条件下也具有优势。在PACIFIC研究中,在铂类放化疗后未发生进展的III期局部晚期不可切除NSCLC患者接受durvalumab或安慰剂治疗[8]。事实上,与安慰剂相比,durvalumab治疗显著改善PFS(16.8与5.6个月;HR,0.52;p < 0.001)和至远处转移或死亡时间(23.2与14.6个月;HR,0.52;p < 0.001)。
新辅助治疗代表着又更进一步接近最前线治疗。这里,一项探索研究在未经治疗的可手术切除的早期(I期、II期或IIIA期)NSCLC成人中评估了纳武单抗的两种术前剂量[9]。在首次给药后约4周进行手术。纳武单抗的新辅助给药似乎是可行的,具有可接受的副作用特征。这种给药并未延迟手术,并且在20名切除肿瘤患者中的9名(45 %)中引起主要病理反应。PD-L1阳性和PD-L1阴性肿瘤均发生应答。
具有预测能力的不良反应
免疫相关不良事件(irAE)不一定是坏消息。除了简单体现副作用外,它们还可能是患者免疫应答重新激活的标志。Haratani等人证明,与没有irAE的患者相比,具有irAE的患者的PFS(9.2与4.8个月;p = 0.04)和OS(未达到与11.1个月;p = 0.01)结果改善[10]。
当然,irAE可能会危及生命,需要适当的管理。为此已经制定了详细的指南[11]。
参考文献
- Herbst RS et al., Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387(10027): 1540-50
- Reck M et al., Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med 2016; 375(19): 1823-1833
- Brahmer JR et al., Progression after the next line of therapy (PFS2) and updated OS among patients with advanced NSCLC and PD-L1 TPS >=50% enrolled in KEYNOTE-024. J Clin Oncol 35, 2017 (suppl; abstr 9000)
- Gettinger S et al., Five-year follow-up of nivolumab in previously treated advanced non-small-cell lung cancer: results from the CA209-003 Study. J Clin Oncol 2018; 36(17): 1675-1684
- Kagamu H et al., CD4+ T cells in PBMC to predict the outcome of anti-PD-1 therapy. J Clin Oncol 35, 2017 (suppl; abstr 11525)
- Gandhi L et al., Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N Engl J Med 2018; 378: 2078-2092
- Paz-Ares LG et al., Phase 3 study of carboplatin-paclitaxel/nab-paclitaxel (chemo) with or without pembrolizumab (pembro) for patients (pts) with metastatic squamous (sq) non-small cell lung cancer (NSCLC). J Clin Oncol 36, 2018 (suppl; abstr 105)
- Antonio SJ et al., Durvalumab after chemoradiotherapy in stage III non–small-cell lung cancer. N Engl J Med 2017; 377: 1919-1929
- Forde PM et al., Neoadjuvant PD-1 blockade in resectable lung cancer. N Engl J Med 2018; 378: 1976-1986
- Haratani K et al., Association of immune-related adverse events with nivolumab efficacy in non-small-cell lung cancer. JAMA Oncol 2018; 4(3): 374-378
- Haanen JBAG et al., Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28 (Supplement 4): iv119-iv142