Inmunoterapia: nuevos anticuerpos anti-PD-L1 y diversas pautas de combinación
Análisis de subgrupos del estudio OAK
En comparación con los anticuerpos anti-PD-1, la ventaja de los anticuerpos dirigidos contra PD-L1 radica en que pueden inhibir las interacciones PD-1/PD-L1 dejando intacta la vía de PD-1/PD-L2, con lo que se conserva potencialmente la homeostasis inmunitaria periférica. El estudio OAK fue el primer ensayo de fase III aleatorizado en el que se evaluó un fármaco anti-PD-Ll en el CPNM avanzado. Pacientes con CPNM localmente avanzado o metastásico recibieron atezolizumab, 1200 mg cada tres semanas, o docetaxel. Antes del ensayo, ya habían sido tratados con una o dos líneas de quimioterapia, incluida al menos una pauta a base de platino. La inclusión de la población se hizo con independencia del estado relativo al PD-L1, pero con estratificación en función de la expresión de PD-L1. El estudio OAK tenía dos criterios de valoración principales: SG en la población IT y SG en los pacientes con expresión de PD-L1 en ≥ 1% de las células tumorales o células inmunitarias infiltrantes. No se permitió el cambio de tratamiento, un hecho relevante para la interpretación de los datos de SG.
El análisis principal se presentó en el Congreso de la ESMO de 2016. En este caso, el estudio OAK cumplió sus dos criterios de valoración principales [1]. En la población IT, el tratamiento con atezolizumab produjo una reducción relativa de la mortalidad del 27% en comparación con el docetaxel (mediana de SG, 13,8 frente a 9,6 meses; RRI, 0,73; p = 0,0003). Además, el atezolizumab mejoró la supervivencia con todos los grados de expresión de PD-L1; el mayor beneficio se observó en los pacientes con la expresión más alta de PD-L1. Sin embargo, el atezolizumab también mejoró la supervivencia en los pacientes cuyos tumores no expresaban PD-L1.
Los análisis de subgrupos realizados en el estudio OAK para evaluar la eficacia del atezolizumab en varios subgrupos de interés clínico revelaron una eficacia amplia de este tratamiento [2]. Se observaron beneficios en SG con independencia del grado de expresión de PD-L1, determinada mediante inmunohistoquímica (IHQ) o expresión génica, y de la histología (no epidermoide frente a epidermoide) con todos los grados de expresión de PD-L1 y en todos los grupos de edad. También se produjo una mejoría de la SG en los pacientes no fumadores y en aquellos con metástasis cerebrales en el momento basal. Por otro lado, el docetaxel fue más eficaz que el atezolizumab en el subgrupo de pacientes con mutación en EGFR, mientras que aquellos con EGFR natural evolucionaron mejor con el atezolizumab. Esta ausencia de una mayor eficacia del atezolizumab respecto al docetaxel en la población con EGFR mutado ya se ha observado con otros fármacos que actúan sobre esta vía [3].
BIRCH: eficacia prometedora del atezolizumab en primera línea
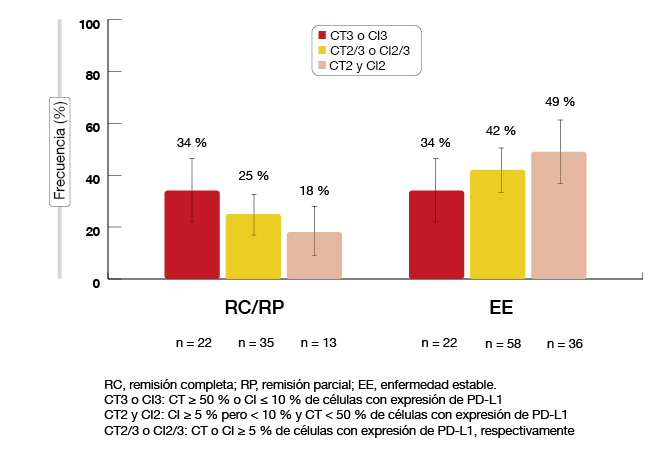
En el estudio de fase II BIRCH se evaluó el uso de atezolizumab en monoterapia en pacientes con CPNM localmente avanzado o metastásico seleccionados según la expresión de PD-Ll. Este ensayo contó con tres grupos para investigar el uso de atezolizumab en una dosis de 1200 mg cada tres semanas como primera, segunda y tercera o posterior línea de tratamiento. La expresión de PD-L1 en células tumorales (CT2 o CT3) y células inmunitarias infiltrantes de tumores (CI2 o CI3) se determinó mediante IHQ. Ya se ha cumplido el criterio de valoración principal de la eficacia, que relacionó las TRO con controles históricos. Garassino y cols. presentaron los datos de un análisis exploratorio en el que se evaluó la parte de primera línea del ensayo [4]. Esta cohorte estuvo formada por 138 pacientes. En este grupo, el 47% mostró la expresión tumoral más alta de PD-L1 (CT3 o CI3). El 53% de los pacientes tenía CT2 y CI2.
El tratamiento de primera línea con atezolizumab mostró una eficacia prometedora en monoterapia. En el 25% y 42% de los pacientes de la población global se obtuvieron respuestas objetivas y enfermedad estable (EE), respectivamente (Figura 1). En la cohorte con CT3 y CI3, la TRO y la tasa de EE fueron del 34% en ambos casos. En la cohorte con CT2 y CI2, dichas tasas fueron del 18% y 49%, respectivamente. La duración de la respuesta fue de 16,5 meses en la población global, con una mediana de duración de la respuesta de 12,3 meses en la población con CT2 y CI2; aún no se ha determinado en la cohorte con CT3 o CI3. El beneficio en TRO del atezolizumab se extendió a los pacientes con EGFR y KRAS mutados y naturales, aunque las cifras respectivas de pacientes son pequeñas. Estos resultados indican que la monoterapia con atezolizumab muestra una eficacia duradera en el contexto de primera línea.
Figura 1: Tasas de respuesta con atezolizumab de primera línea en el estudio BIRCH, según la expresión de PD-L1
La mediana de SSP fue de 7,3 meses en la población global, con resultados semejantes con los diferentes grados de expresión de PD-L1. Tras una mediana de seguimiento de 22,5 meses, la mediana de SG fue de 23,5 meses. De nuevo, las tendencias de SG fueron equiparables en todos los subgrupos de expresión de PD-L1, aunque las estimaciones de la mediana de SG aún no son definitivas. La proporción de pacientes que seguían vivos al cabo de un año en la población global fue del 66,4%. El estado de mutación de EGFR y KRAS no afectó a estos resultados. El perfil de seguridad fue parecido al de otros estudios de atezolizumab en el CPNM y el atezolizumab fue bien tolerado. En ensayos de fase III en curso, como el IMpower110, se está evaluando el uso de atezolizumab en comparación con quimioterapia en el contexto de primera línea en pacientes seleccionados por el PD-L1.
Actividad del durvalumab después de la segunda línea en el estudio ATLANTIC
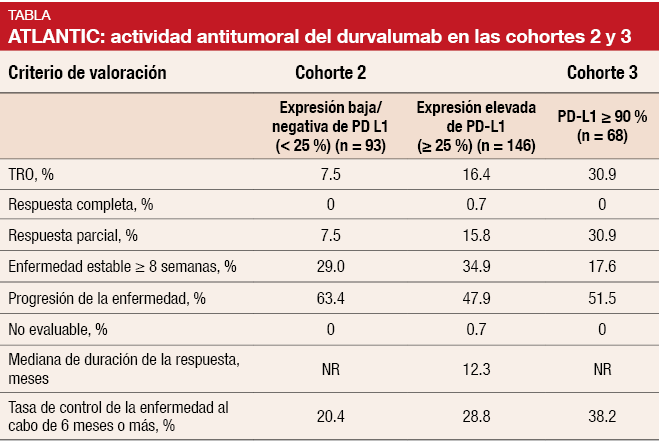
Al igual que el atezolizumab, el durvalumab queda encuadrado en la categoría de anticuerpos anti-PD-L1. El durvalumab se evaluó en el ensayo de fase II, abierto y con un solo grupo ATLANTIC en una dosis de 10 mg/kg cada dos semanas durante un máximo de 12 meses [5]. Los pacientes que participaron en el ensayo habían recibido, como mínimo, dos tratamientos sistémicos previos, incluida una pauta de quimioterapia a base de platino. Inicialmente, el protocolo se diseñó para incluir a todos los pacientes que se presentaran de manera consecutiva pero, después de una enmienda, la selección de pacientes quedó limitada a aquellos con tumores que mostraran una expresión elevada de PD-L1. La población constó de tres cohortes. En la cohorte 1 (n = 111) se incluyeron pacientes con mutación en EGFR/alteración de ALK y expresión elevada de PD-L1 (≥ 25% de las células tumorales). Los pacientes de las cohortes 2 y 3 presentaban EGFR/ALK naturales. En la cohorte 2 (n = 265) prevaleció un grado de expresión de PD-L1 ≥ 25% en las células tumorales y una expresión baja/negativa de PD-L1 (< 25%). En la cohorte 3 (n = 68) se incluyeron pacientes con un grado de expresión de PD-L1 ≥ 90%. Las cohortes fueron independientes y el reclutamiento de pacientes en las cohortes 2 y 3 se hizo de forma secuencial.
En esta población con CPNM metastásico tratada intensamente con anterioridad, el tratamiento con durvalumab mostró actividad y produjo respuestas duraderas. Una expresión más intensa de PD-L1 pareció asociarse a mayores tasas de respuesta. En la cohorte 2, la TRO de los pacientes con una expresión baja/negativa y alta de PD-L1 fue del 7,5% y 16,4%, respectivamente (Tabla). En la cohorte 3, la TRO aumentó al 30,9%, Las tasas de control de la enfermedad al cabo de 6 meses o más fueron del 20,4%, 28,8% y 38,2%, respectivamente. La mediana de duración de la respuesta no se había alcanzado aún en los pacientes con una expresión baja/negativa de la cohorte 2 ni en la cohorte 3 y fue de 12,3 meses en aquellos con una expresión elevada de la cohorte 2. El beneficio en TRO resultó evidente en todos los subgrupos; hay que señalar que fue independiente de la línea de tratamiento y la presencia de metástasis en el SNC.
La mediana de SG en los grupos con una expresión baja/negativa y elevada de PD-L1 de la cohorte 2 fue de 9,3 y 10,9 meses, respectivamente. Estos resultados se correspondieron con unas tasas de SG al cabo de un año del 34,5% y 47,7%, respectivamente. En la cohorte 3 no se había alcanzado aún la mediana de SG y el 50,8% de los pacientes seguían vivos al cabo de un año. La mayoría de los acontecimientos adversos se clasificaron como de grado bajo y los acontecimientos adversos relacionados con la inmunidad fueron controlables. Los autores llegaron a la conclusión de que estos resultados son coherentes con los obtenidos con otros tratamientos anti-PD-1/PD-L1 en el CPNM metastásico. Hay ensayos de fase III en curso para aclarar la utilidad del durvalumab en monoterapia o en combinación con el anticuerpo anti-CTLA-4 tremelimumab.
Abordaje cuádruple: quimioterapia más inmunoterapia combinada
El uso de durvalumab en combinación con tremelimumab, un anticuerpo anti-CTLA-4, se investigó en el estudio de aumento escalonado de la dosis IND.226, que se centró en un tratamiento cuádruple, con combinación de quimioterapia con dos fármacos inmunooncológicos. En este estudio se está tratando de potenciar los efectos beneficiosos de la quimioterapia y la inmunoterapia añadiendo no solo un inhibidor del PD-L1, sino también un inhibidor del CTLA-4. En el estudio IND.226 participan pacientes con tumores sólidos y se utilizan varias quimioterapias de base. Veintisiete pacientes de la cohorte total han sido diagnosticados de CPNM no epidermoide. Se trata de pacientes no seleccionados por el PD-L1. Se está administrando durvalumab, 15 mg/kg cada tres semanas, y tremelilumab, 1 mg/kg (dosis repetidas, cada 6 semanas) o 3 mg/kg (3 dosis, cada 6 semanas), junto con pemetrexed y cisplatino.
En lo que respecta a la seguridad, que fue el criterio de valoración principal de este ensayo, no se observó toxicidad adicional significativa aparte de la que cabía esperar con la quimioterapia y el tratamiento inhibidor de puntos de control inmunológico con un anticuerpo anti-CTLA-4 y un anti-PD-L1 [6]. Al tratarse de un estudio de seguridad de fase I, no se exigió que todos los pacientes tuvieran enfermedad mensurable. Hasta la fecha, 16 de los 26 pacientes (61,5%) han presentado respuestas parciales. Se ha logrado una enfermedad estable en siete casos. El tratamiento se encuentra en curso en muchos de estos pacientes.
En general, se ha demostrado que el durvalumab y el tremelimumab pueden combinarse de forma segura con dosis plenas de quimioterapia con pemetrexed/cisplatino. Se realizarán futuros análisis de subgrupos de PD-L1. En un estudio de seguimiento de fase II aleatorizado se comparará una quimioterapia doble a base de platino más durvalumab/tremelimumab con durvalumab/tremelimumab solos en el contexto de primera línea.
JAVELIN: uso de avelumab en diversos tumores sólidos
El avelumab es otro anticuerpo anti-PD-L1 que se está evaluando en el estudio de tumores sólidos JAVELIN, un ensayo de fase I, internacional, de aumento escalonado y ampliación de la dosis con varias cohortes. En este estudio participan pacientes con diversas neoplasias malignas, que comprenden cánceres torácicos y tumores de piel, cabeza y cuello, aparato genitourinario y tubo digestivo. Entre todas las cohortes, más de 1700 pacientes están recibiendo avelumab, 10 mg/kg cada dos semanas, en la fase de ampliación de la dosis. Se han incluido dos cohortes con CPNM en estadio IV o recurrente; en este caso, los pacientes reciben avelumab en el contexto de primera (n = 156) o segunda (n = 184) línea.
En la WCLC se comunicaron los resultados relativos a seguridad y actividad clínica del avelumab en la cohorte de primera línea [7]. Estos pacientes no han sido seleccionados según la expresión de PD-L1 y no presentan mutaciones activadoras de EGFR ni translocaciones de ALK. La expresión de PD-L1 es positiva en el 56,4% y negativa en el 14,7%. Se ha comprobado que el avelumab es bien tolerado. El 10% de los pacientes presentó acontecimientos adversos potencialmente relacionados con la inmunidad, pero tan solo uno tuvo un acontecimiento de grado 3. No se produjo neumonitis de grado 3/4 y solo se observó neumonitis de grado 1/2 en cuatro pacientes (2,6%).
Este análisis inicial reveló una actividad antitumoral duradera de la monoterapia con avelumab. Se produjeron respuestas completas y parciales en el 22,5% de los pacientes. El 43% presentó una enfermedad estable, lo que deparó una tasa de control de la enfermedad del 65,4%. La mayoría de los pacientes mostró una contracción tumoral (Figura 2). En la fecha de corte de los datos, el 68,6% de las respuestas seguían en curso. En lo que respecta a la SSP, el análisis deparó una mediana de 17,6 semanas, con una tasa de SSP a las 24 semanas del 37,2%,
En un seguimiento adicional se determinarán con más detalle los beneficios clínicos del tratamiento con avelumab. Hay en curso un análisis de la expresión de PD-L1 como biomarcador predictivo relacionado con el avelumab. En la actualidad, en un ensayo de fase III está comparándose la monoterapia con avelumab con una quimioterapia doble a base de platino en pacientes con CPNM no tratados y seleccionados por el PD-Ll.
Figura 2: Gráfica en cascada del estudio JAVELIN que representa la contracción tumoral obtenida con el avelumab
Resultados a largo plazo del estudio CheckMate 012
En el estudio CheckMate 012 se evaluó el anticuerpo anti-PD-1 nivolumab en monoterapia en comparación con dos pautas de la combinación de nivolumab e ipilimumab, un inhibidor del punto de control inmunológico CTLA-4. Este tratamiento se administró como estrategia de primera línea a pacientes con CPNM en estadio IIIB/IV de cualquier histología. El grupo de nivolumab en monoterapia (n = 52) recibió 3 mg/kg de nivolumab cada dos semanas. En los dos grupos de tratamiento combinado se administró nivolumab e ipilimumab en dosis de 3 mg/kg cada dos semanas y 1 mg/kg, respectivamente, con administración del ipilimumab cada 12 semanas (n = 38) en un grupo y cada seis semanas (n = 39) en el otro. Se evaluó la expresión de PD-L1. En torno al 70% de los pacientes de cada grupo tenía una expresión de PD-L1 ≥ 1%. Los criterios de valoración principales del estudio CheckMate 012 fueron la seguridad y la tolerabilidad. Gettinger y cols. presentaron los resultados a largo plazo del estudio CheckMate 012 en la WCLC [8].
Tras un seguimiento adicional de seis meses en las cohortes de tratamiento combinado, las tasas de acontecimientos adversos relacionados con el tratamiento y el perfil de seguridad se mantuvieron similares a los resultados comunicados anteriormente. No se produjeron muertes relacionadas con el tratamiento. Tanto la monoterapia con nivolumab como las combinaciones mostraron actividad y la administración combinada deparó mayores TRO, una SSP más prolongada y unas tasas numéricamente mayores de SG al cabo de un año. A los dos años, la TRO fue del 23% con nivolumab y del 43% con nivolumab más ipilimumab. Una mayor expresión de PD-L1 incrementó la eficacia de ambos tratamientos en monoterapia y en combinación. En los pacientes con una expresión de PD-L1 ≥ 50%, la TRO fue del 50% con nivolumab en monoterapia y del 92% con las pautas de combinación. Asimismo, la SSP y la SG fueron máximas en los grupos con una expresión de PD-L1 ≥ 50%, aunque incluso los pacientes sin expresión de PD-L1 (< 1%) obtuvieron beneficios del tratamiento. En los pacientes con una expresión de PD-L1 ≥ 1%, la mediana de SSP fue de 3,5 meses con nivolumab en monoterapia y de 10,4 y 13,2 meses con nivolumab más ipilimumab cada 12 y 6 semanas, respectivamente. Las proporciones de pacientes vivos al cabo de un año fueron del 69%, 91% y 83%, respectivamente.
El tratamiento con nivolumab, 3 mg/kg cada dos semanas, más ipilimumab, 1 mg/kg cada seis semanas, se está evaluando en otros estudios. Entre ellos destacan el ensayo de fase III CheckMate 227, en el que está comparándose esta pauta con nivolumab en monoterapia, quimioterapia y una pauta de nivolumab más quimioterapia. En este caso, el tipo de comparación depende del grado de expresión de PD-L1, según la cual se han definido dos grupos (≥ 1% y < 1%).
Pembrolizumab más quimioterapia: estudio KEYNOTE-O21 G
El uso combinado del anticuerpo anti-PD-1 pembrolizumab y quimioterapia como estrategia de primera línea en el tratamiento del CPNM no epidermoide en estadio IIIB/IV se evaluó en el estudio de fase II, abierto y aleatorizado KEYNOTE-021 G. En el grupo experimental se administró pembrolizumab en una dosis de 200 mg cada tres semanas durante dos años, junto con carboplatino y pemetrexed. Los pacientes del grupo de control recibieron carboplatino y pemetrexed únicamente durante cuatro ciclos. Se permitió el tratamiento de mantenimiento con pemetrexed. El criterio de valoración principal fue la TRO. Unos 60 pacientes recibieron tratamiento en cada grupo, mientras que 20 del grupo de control pasaron al grupo de pembrolizumab cuando se confirmó la progresión y 12 recibieron tratamiento anti-PD-(L)1 al margen del cambio de tratamiento.
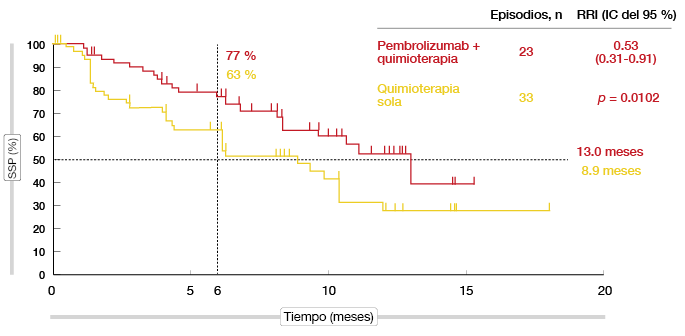
La TRO confirmadas fue casi el doble con la adición de pembrolizumab (55% frente al 29%; p = 0,0016) [9]. Según el análisis de la SSP, la combinación prácticamente redujo a la mitad el riesgo de progresión o muerte, de modo que la mediana de SSP fue superior a un año (13,0 frente a 8,9 meses; RRI, 0,53; p = 0,0102; Figura 3). La SG fue similar en los dos grupos (92% a los 6 meses con ambos tratamientos; 75% y 72% al cabo de un año). El tratamiento con pembrolizumab más quimioterapia mostró una tolerabilidad elevada y un perfil de seguridad controlable. Según indicaron los investigadores, el pembrolizumab en combinación con carboplatino y pemetrexed podría constituir una opción terapéutica eficaz para los pacientes con CPNM no epidermoide que no han recibido quimioterapia con anterioridad.
Figura 3: Beneficio en SSP debido a la adición de pembrolizumab a quimioterapia
Estudio de armonización sobre el análisis inmunohistoquímico de PD-L1 en Francia
La expresión de PD-Ll evaluada mediante inmunohistoquímica (IHQ) representa, actualmente, el principal biomarcador predictivo disponible del beneficio de los anticuerpos anti-PD-1/PD-Ll. En ensayos clínicos se han utilizado análisis aplicados en las plataformas Dako (22C3, 28-8) y Ventana (SP142, SP263) como pruebas diagnósticas. En Francia se necesita urgentemente una armonización de estos análisis y el perfeccionamiento de pruebas desarrolladas en el laboratorio por varios motivos. Las plataformas Dako y Ventana no están disponibles en todos los laboratorios de anatomía patológica y los análisis siguen siendo caros, mientras que el reembolso de los análisis de PD-Ll es insuficiente, hasta la fecha, en Francia. Al mismo tiempo, el análisis de PD-Ll ha de ser de fácil disponibilidad para los pacientes en el contexto de primera línea, y la realización de múltiples pruebas con diferentes análisis no resulta viable en muestras pequeñas de CPNM.
En consecuencia, en un estudio multicéntrico francés se evaluó el rendimiento analítico de los análisis de PD-Ll Dako 28-8 y 22C3 y Ventana SP263 en diversos centros, con el fin de determinar si las pruebas desarrolladas en el laboratorio pueden alcanzar un rendimiento analítico próximo al de los análisis de PD-Ll en un conjunto de casos de CPNM [10]. Se confirmó que los análisis 28-8, 22C3 y SP263 realizados en varios centros mostraron una concordancia elevada. De las 27 pruebas desarrolladas en el laboratorio, en siete centros, con las plataformas Dako, Ventana y Leica, 14 (51,8%) mostraron concordancia en comparación con los análisis de referencia de tinción de células tumorales. Se observó una concordancia baja con la tinción de células inmunitarias al utilizar una escala de cuatro categorías con umbrales del 1%, 5% y 10%. El clon SP263 logró la mayor tasa de concordancia de entre todas las plataformas.
Este estudio también pone de relieve que se requiere precaución con respecto a la validación y el uso ulterior de pruebas desarrolladas en el laboratorio. Algunas pruebas desarrolladas en el laboratorio se validarán en cohortes de mayor tamaño y utilizando programas externos de evaluación de la calidad en Francia. Estos resultados proporcionarán la base para emitir recomendaciones nacionales acerca del análisis de PD-Ll en el CPNM.
BIBLIOGRAFÍA
- Barlesi F et al., Primary analysis from OAK, a randomized phase III study comparing atezolizumab with docetaxel in 2L/3L NSCLC. ESMO 2016, abstract LBA44_PR
- Gadgeel SM et al., OAK, a randomized ph III study of atezolizumab vs docetaxel in patients with advanced NSCLC: results from subgroup analyses. WCLC 2016, PL04a.02
- Borghaei H & Brahmer J, Nivolumab in nonsquamous non-small-cell lung cancer. N Engl J Med 2016; 374(5): 493-494
- Garassino MC et al., Atezolizumab as 1L therapy for advanced NSCLC in PD-L1–selected patients: updated ORR, PFS and OS data from the BIRCH study. WCLC 2016, OA03.02
- Garassino MC et al., Durvalumab in ≥3rd-line locally advanced or metastatic, EGFR/ALK wild-type NSCLC: results from the phase 2 ATLANTIC study. WCLC 2016, PL04a.03
- Juergens RA et al., Pemetrexed/cisplatin + durvalumab ± tremelimumab in patients with advanced non-squamous NSCLC: A CCTG phase Ib study – IND.226 Cohort 1. WCLC 2016, MA09.03
- Verschraegen C et al., JAVELIN Solid Tumor: safety and clinical activity of avelumab (anti-PD-L1) as first-line treatment in patients with advanced NSCLC. WCLC 2016, OA03.03
- Gettinger SN et al., First-line nivolumab monotherapy and nivolumab plus ipilimumab in patients with advanced NSCLC: long-term outcomes from CheckMate 012. WCLC 2016, OA03.01
- Langer CJ et al., Pembrolizumab + carboplatin and pemetrexed as 1st-line therapy for advanced non-small cell lung cancer: KEYNOTE-021 Cohort G. WCLC 2016, MA09.02
- Adam J et al., Multicentric French harmonization study of PD-L1 IHC testing in non-small cell lung cancer. WCLC 2016, PL04a.04