免疫疗法:联合方案和有关突变意义的新数据
46.3个月后的KEYNOTE-189更新结果
OS和PFS的显著改善使得在KEYNOTE-189试验中评估的方案作为IV期非鳞状NSCLC的标准一线方法得以实施,其对EGFR/ALK畸变不敏感[1]。相对于安慰剂加铂/培美曲塞继以安慰剂加培美曲塞(n = 206),测试了至多4个周期的派姆单抗加铂/培美曲塞继以至多31个周期的派姆单抗加培美曲塞(n = 410)。对于OS和PFS,以免疫疗法为基础的策略实现了约50%的风险降低(HR分别为0.49和0.52)。经过46.3个月的中位随访后,Gray等人介绍了整个研究人群(意向治疗,ITT)以及完成35个周期(即2年的派姆单抗)的患者(n = 56)的最新疗效和安全性结果[2]。
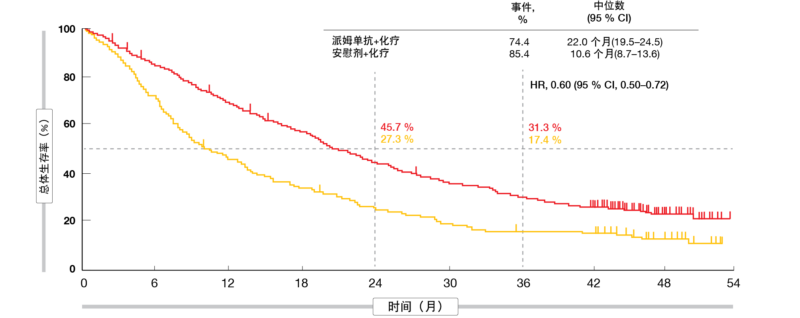
与安慰剂加化疗相比,派姆单抗加铂/培美曲塞继续提供OS和PFS益处,同时显示出可控的安全特性。在ITT人群中,中位OS为22.0与10.6个月,实验组中的3年OS率几乎翻倍(31.3%与17.4%;HR,0.60;图1)。中位PFS为9.0与4.9个月(HR,0.50)。 在36个月时,无进展的患者为11.8%与1.3%。不论PD-L1基线表达如何,OS和PFS获益均出现。PFS2的定义为从随 机分组到经研究者评估为疾病进展而导 致停止二线治疗、开始三线治疗或死亡 的时间,分别为17.0与9.0个月(HR,0.52)。ORR为48.3%与19.9%, 缓解持续的中位时间为12.6与7.1个月。
在完成35个周期的派姆单抗治疗的患者组中,从完成该治疗起的2年OS率为79.6%。客观缓解率为87.5%,其中完全缓解率为10.7%。数据截止时有45名患者(80.4%)仍然存活;其中有28名未显示疾病进展的迹象。
图1: 派姆单抗加化疗与安慰剂加化疗的持续总体生存益处:KEYNOTE-189
派姆单抗加易普利姆玛(ipilimumab):KEYNOTE-598
在KEYNOTE-598研究中,派姆单抗加易普利姆玛作为患有IV期NSCLC、 PD-L1 TPS≥50%且无可靶向EGFR/ALK畸变的患者的一线疗法的结果不 佳[3]。基于PD-1抑制剂纳武单抗(nivolumab)和CTLA-4抑制剂易普利姆玛的双重免疫疗法是晚期黑色素瘤和肾细胞癌的治疗标准[4,5],KEYNOTE-598对这一方法进行了测试。迄今为止,抗PD-1单药治疗与双重PD-1和CTLA-4抑制作为NSCLC一线治疗的适当有力的对照比较从未进行。KEYNOTE-598研究纳入了每组284名患者;实验组的患者接受至多35个剂量的派姆单抗加至多18个剂量的易普利姆玛,而对照组的患者则接受派姆单抗加安慰剂治疗。
然而,与单独的派姆单抗相比,将易普利姆玛加入派姆单抗并不能改善疗效。在OS(21.4与21.9个月;HR,1.08;p = 0.74)、PFS(8.2与8.4个月;HR,1.06;p = 0.72)、 ORR(两组中均为45.4%)和缓解持续时间(16.1与17.3个月)方面均未观察到差异。基于数据监控委员会的建议,因徒劳无功而终止了KEYNOTE-598。而且,与单独的派姆单抗相比,派姆单抗和易普利姆玛的组合产生更大的毒性。正如作者总结的那样,对于未携带EGFR/ALK畸变的TPS≥50%的NSCLC患者,派姆单抗单药治疗仍是一线治疗标准。
KRAS和TP53突变:预测IO疗效
KRAS和TP53基因的遗传畸变在NSCLC中很常见。通过对包括共1,129名患者的8个队列进行荟萃队列分析,Li等人在预测EGFR/ALK野生型非鳞状NSCLC中的免疫检查点抑制效力方面,研究了这两个基因突变之间的相互关系[6]。
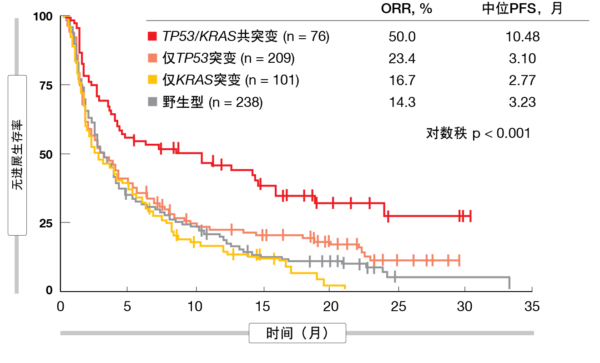
据显示,在具有KRAS突变的患者中,TP53突变与较高的ORR和PFS相关,但在KRAS野生型人群中无此相关性。相反,在TP53突变型患者中,KRAS突变与较好的ORR和PFS相关,而在TP53野生型患者中无此相关性。TP53-KRAS共突变预示免疫治疗的PFS更长,而单独TP53或KRAS突变则没有(图2)。在接受化疗的患者中,TP53-KRAS共突变的存在对PFS没有影响。事实证明,无论肿瘤突变负荷、PD-L1表达、重要的临床病理特征以及与免疫治疗相关的突变事件如何,该共突变均能预示阿特珠单抗的益处高于多西他赛。
作者在其结论中强调了KRAS和TP53突变在预测免疫检查点抑制的益处方面的相互依赖性。考虑到这一点,建议未来研究免疫疗法预测因子的研究人员专注于不同生物标志物之间的相互影响。
图2: 经免疫疗法治疗患者中的无进展生存率:TP53/KRAS共突变与TP53和KRAS单突变以及野生型
在EGFR突变型疾病中纳武单抗/易普利姆玛没有益处
在EGFR突变型NSCLC患者中,单药治疗PD-1抑制已被证明与临床疗效低相关[7, 8]。Lai等人进行了一项开放标签的随机化II期研究,用于在一条标准EGFR TKI治疗线且≤1线化疗失败的晚期EGFR突变型NSCLC患者中测试联合免疫检查点抑制[9]。A组接受了纳武单抗单药治疗(n = 15),而B组则使用纳武单抗加易普利姆玛治疗(n = 16)。 允许经治疗的转移或稳定的转移。疾病进展后,A组的患者可以交叉到B组。包括外显子组测序和血浆细胞因子分析等在内的生物标志物评估都是该过程的一部分。
联合免疫检查点抑制并没有带来临床益处。研究在这31名患者之后因无效而提前终止。在整个队列中观察到的ORR为3.2%,其中一名患者在联合组中获得部分缓解,而在单药治疗组中则没有任何缓解。各有6名患者的疾病稳定(分别为40.0%和37.5%)。各组的PFS相似(分别为中位数1.31和1.22个月)。五名患者获得了临床益处,形式为6个月时持续的部分缓解/疾病稳定,或部分缓解的最佳缓解。所有这些患者都具有EGFR外显子19缺失,其中一个具有T790M突变。PD-L1状态与对免疫检查点抑制的反应之间不存在关联。疾病进展且从单药治疗交叉到联合疗法的三名患者都没有获益。免疫疗法的使用并没有增加安全性问题。与CheckMate 227试验中观察到的免疫相关AE的发生率相似[10]。
根据生物标志物分析,即使在获得临床益处的患者中,肿瘤突变负荷通常也很低。同样,在基因表达谱测试(GEP)评分与对免疫疗法的反应之间也没有显示明显的关联。但是,获得临床益处的患者要么在基线时 “免疫热”,要么在治疗中变“热”。另外,随着时间的流逝,他们倾向于具有较少数量的髓样来源的抑制细胞。作者指出,颅内控制的缺乏可能是导致本研究结果差的一个主要因素。因此,在为EGFR突变型NSCLC患者选择免疫治疗时,应着重考虑颅内失败的情况。组合方法可能是一种解决方案,但需要进一步的研究。
纳武单抗加MET抑制
在一项研究中评估了使用MET抑制剂卡帕替尼(capmatinib)和PD-1抑制剂纳武单抗进行同时治疗,其基本原理是MET通路的失调可能调节免疫细胞功能,从而导致抗癌免疫反应的抑制[11]。在小鼠模型中,卡帕替尼已显示出增强免疫疗法的功效,而与肿瘤细胞固有的MET依赖性无关[12]。在WCLC上报告的一项多中心、全球、开放标签的II期临床试验纳入了晚期/转移性、EGFR野生型、PD-(L)1抑制剂初治的NSCLC患者,并记录了标准治疗后的疾病进展[13]。
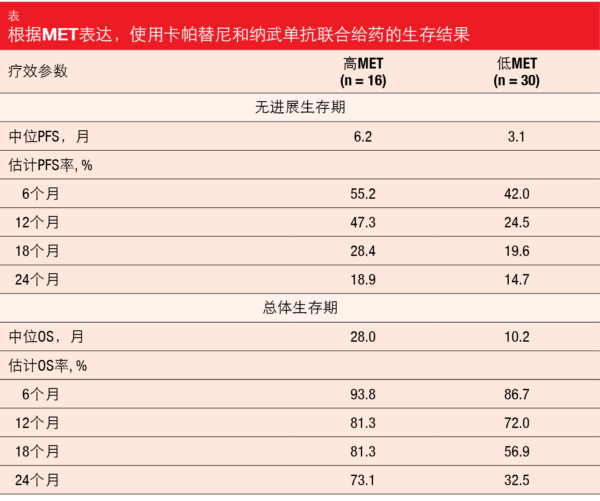
将每日两次卡帕替尼400 mg与每两周一次纳武单抗3 mg/kg一起给药。根据MET的表达对患者进行分层,有16人符合高MET标准(即,≥50%的肿瘤细胞中的MET IHC 3+而不考虑基因拷贝数[GCN],或≥50%的肿瘤细胞中的IHC 2+且GCN≥5,或METex14阳性疾病),30名患者符合低MET标准(即,METex14阴性或未知状态并且有以下情况之一:≥50%的肿瘤细胞中MET IHC 2+且GCN <5 ;< 50%的肿瘤细胞中的IHC 2+而考虑GCN;IHC 0或1+而考虑GCN)。6个月时的PFS被定义为主要终点。Felip等人在分别对高MET和低MET队列中位随访22.9和30.4个月后给出了结果[13]。
这份首次报告显示了卡帕替尼加纳武单抗在高MET和低MET患者中的临床活性。ORR分别为25.0%和16.7%, 疾病控制率分别为81.3%和40.0%。中位缓解持续时间分别为22.89和24.99个月。高MET和低MET患者均出现肿瘤缩小。中位PFS分别为6.2个月和3.1个月,6个月PFS率分别为55.2%和42.0%(表)。分别在28.0和10.2个月后达到中位OS。在12个月时,有73.1%和32.5%的患者存活。作者指出,在这项样本量有限的研究中,在卡帕替尼加纳武单抗的终点数值上,高MET组优于低MET组,置信区间重叠为95%。
该组合显示出易于管控的安全特性。在3/4级治疗相关AE中,最常见的是淀粉酶升高(15.2%)和脂肪酶升高(10.9%),其次是呕吐(8.7%)、恶心、乏力和周围水肿(各为6.5%)。在两个队列中,分别有39.1%和19.6%的患者因治疗相关的AE而导致停用研究药物。分别有80.4%和60.9%的患者需要计量调整或中断,而分别有93.5%和58.7%的患者由于AE而需要其他治疗。
抗血管生成组合伴侣
在一项针对初治且无驱动基因畸变的IIIB/IV期NSCLC患者的I期研究中,评估了抗PD-1抗体信迪利单抗(sintilimab)和多靶点抗血管生成TKI安罗替尼(anlotinib)的无化疗组合。初步分析表明,无论PD-L1表达如何,ORR都令人鼓舞[14]。在WCLC 2020上,Han等人报告了主要终点的最终分析,显示出持久的疗效和良好的耐受性[15]。总体而言,72.7%的患者(n = 22)有反应,其中100%实现了疾病控制。尚未达到中位缓解持续时间。中位PFS为15个月,而OS数据仍不成熟。在12个月时,有95.5%的患者存活,71.4%的患者无进展。
不论肿瘤突变负荷、PD-L1表达或组织学如何,都产生了缓解并且没有进展。经过更长的随访,信迪利单抗加安洛替尼没有引起任何意想不到的毒性。作者指出,无论组织学亚型或PD-L1状态如何,这种新颖的组合均可为更广泛的NSCLC患者提供潜在的疗效。目前正在进行一项随机化II期试验以进一步研究信迪利单抗加安罗替尼(NCT04124731)。
长期幸存者的长期AE
Hsu等人介绍了对免疫疗法幸存者,即,在开始PD-(L)1治疗后超过1年仍然生存的III/IV期NSCLC患者的回顾性分析[16]。总共确定了在2009年11月至2020年2月之间接受治疗的317名患者。在这一组中,有114名患者(36%) 生存超过1年。其中大约一半年龄≥65岁,> 80%的患者目前吸烟或曾经吸烟。腺癌作为最常见的组织学出现在66%的患者中。61%的患者的PD-L1状态不明;21%的患者的PD-L1表达超过50%。接受的中位剂量数为13(范围为1-121)。分别有三分之二和三分之一的患者接受了单药治疗和联合疗法。
免疫相关AE(irAE)发生在59名长期幸存者(52%)中,其中最常见的是肺部事件(肺炎)和皮肤病学事件(皮炎、瘙痒、牛皮癣),其次是内分泌AE(甲状腺功能低下、甲状腺炎、垂体炎、1型糖尿病、疲劳)、风湿性AE(炎性关节炎、干燥综合征、口腔干燥、干眼症、肋软骨炎)和胃肠道AE(结肠炎、腹泻、肝炎、胰腺炎)。在59名受影响的患者中,有39名仅有单一irAE,20名发展出多于一种irAE。最常见的多系统irAE包括肺炎伴随皮炎(n = 4)、肺炎伴随炎性关节炎(n = 3)以及肺炎伴随干燥综合征(n = 2)。出现单系统和多系统irAE的中位时间分别为22周和9周。作者指出,有31名(27%)的长期幸存者需要在一年后对irAE进行持续管理。总体而言,接受免疫检查点抑制治疗的NSCLC幸存者代表了具有独特长期需求的群组。
参考文献
- Gandhi L et al., Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N Engl J Med 2018; 387(22): 2078-2092
- Gray JE et al., Pembrolizumab + pemetrexed-platinum for metastatic NSCLC: 4-year follow-up from KEYNOTE-189. WCLC 2020, PF13.02
- Boyer M et al., Pembrolizumab plus ipilimumab vs pembrolizumab plus placebo as 1L therapy for metastatic NSCLC of PD-L1 TPS ≥ 50 %: KEYNOTE-598. WCLC 2020, PS01.09
- Larkin J et al., Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373(1): 23-34
- Motzer RJ et al., Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018; 378: 1277-1290
- Li X et al., Interdependence of KRAS and TP53 mutations in predicting ICI efficacy in EGFR/ALKWT non-squamous NSCLC: results from 1,129 patient-level data. WCLC 2020, OA07.06
- Lisberg A et al., A phase II study of pembrolizumab in EGFR-mutant, PD-L1+, tyrosine kinase inhibitor naïve patients with advanced NSCLC. J Thorac Oncol 2018; 13(8): 1138-1145
- Gainor J et al., EGFR mutations and ALK rearrangements are associated with low response rates to PD-1 pathway blockade in non-small cell lung cancer: a retrospective analysis. Clin Cancer Res 2016; 22(18): 4585-4593
- Lai GGY et al., Randomised phase 2 study of nivolumab versus nivolumab and ipilimumab combination in EGFRmutant NSCLC. WCLC 2020, OA01.06
- Hellmann MD et al., Nivolumab plus ipilimumab in advanced non-small-cell lung cancer. N Engl J Med 2019; 381(21): 2020-2031
- Papaccio F et al., HGF/MET and the immune system: relevance for cancer immunotherapy. Int J Mol Sci 2018; 19(11): 3595
- Glodde N et al., Reactive neutrophil responses dependent on the receptor tyrosine kinase c-MET limit cancer immunotherapy. Immunity 2017; 47(4): 789-802.e9
- Felip E et al., Efficacy and safety of capmatinib plus nivolumab in pretreated patients with EGFR wild-type non-small cell lung cancer. WCLC 2020, FP76.03
- Han BH et al., Efficacy and safety of sintilimab with anlotinib as first-line therapy for advanced non-small cell lung cancer. WCLC 2019, JCSE01.11
- Han B et al., Sintilimab in combination with anlotinib as first-line therapy for advanced NSCLC: final analysis of primary endpoints. WCLC 2020, OA07.09
- Hsu M et al., Survivors from anti-PD-(L)1 immunotherapy in NSCLC: clinical features, survival outcomes and long-term toxicities. WCLC 2020, MA07.05
© 2020 Springer-Verlag GmbH, Impressum