EGFR突变条件下的特定治疗方法
外显子20插入: mobocertinib的I/II期数据
在约5%至12%的EGFR突变型NSCLC肿瘤中,即在所有NSCLC病例的2%中,可发现EGFR外显子20插入突变[1, 2]。它们代表了位列L858R和外显子19缺失之后的第三常见的EGFR突变[1, 3]。然而,EGFR TKI无法用于治疗带有外显子20插入的肺癌,由于在TKI结合位点存在空间位阻,患者对这些药物不敏感[4]。迄今为止,尚无批准用于这些患者的特异性靶向疗法。第一代和第二代EGFR TKI或化疗可提供约10%至15%的客观缓解率,中位PFS为3至5个月[5-10]。
Mobocertinib(TAK-788)是靶向EGFR外显子20框内插入突变的同类首个强效口服TKI。根据I/II期研究的初步结果,mobocertinib在美国和中国被授予突破疗法称号,用于治疗带有外显子20插入且化疗失败的NSCLC患者[11]。在WCLC 2020上,Zhou等人报告了采用mobocertinib在带有EGFR外显子20插入突变的转移性NSCLC患者中获得的发现,这些患者来自I/II期研究中纳入的经铂治疗组(PPP队列)和延伸队列(EXCLAIM)[12]。PPP和EXCLAIM队列分别包括114名和96名患者。
长效改善
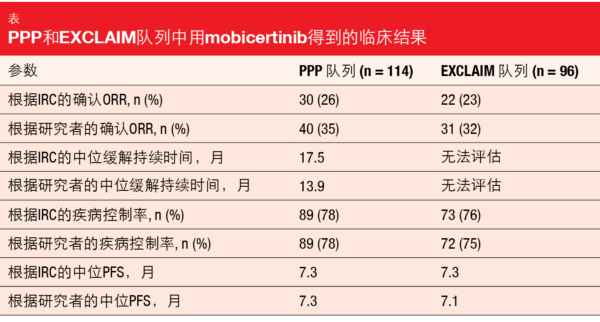
在两组中,mobocertinib的治疗均显示出有意义的益处。在PPP队列中,根据独立评审委员会(IRC)的ORR为26%, 中位缓解持续时间为17.5个月(表)。中位PFS为7.3个月。对于EXCLAIM队列,ORR和中位PFS分别为23%和7.3个月,而尚未达到中位缓解持续时间。尽管两组的IRC评估和研究者评估之间存在数值差异,但相似的疾病控制率和PFS表明,通过两种评估得到的临床获益程度相同。
在PPP和EXCLAIM队列中,分别在78%和84%的患者中观察到缓解持续时间> 6个月。在数据截止时,整个人群中超过50%的缓解仍在持续。与基线相比,目标病变直径总和的减少分别为82%和80%。在所有预先指定的亚组中(即,亚洲人与非亚洲人、曾用免疫疗法或EGFR TKI治疗、基线时存在脑转移),mobocertinib的确认缓解相似。
安全性与EGFR TKI的已知特征相一致。腹泻和皮疹是最常见的治疗相关AE。在PPP和EXCLAIM队列中观察到3/4级腹泻的比率分别为21%和16%。 恶心和腹泻是导致治疗中断的最常见AE。总体而言,两个队列中由于AE引起的治疗中止率分别为17%和10%。需要减少剂量者分别占25%和21%。在EXCLAIM队列中,一名先前用铂治疗的患者因心力衰竭发生了1例与治疗相关的死亡。
该分析包括对症状评分的评估。在EXCLAIM队列中,mobocertinib从第2周期开始带来了核心肺癌症状的临床上有意义的改善(即EORTC QLQ-LC13症状评分降低≥10分),并且该改善在整个治疗期间一直保持。呼吸困难(占患者的54.4%)、咳嗽(占44.4%)和胸痛(占37.8%)明显改变。
阿米万单抗(amivantamab)的稳健疗效
在美国和中国已获得针对外显子20插入阳性NSCLC的突破性疗法称号的另一种药物是双特异性抗体阿米万单抗,其靶向激活和耐药性EGFR突变以及MET突变和扩增[13, 14]。CHRYSALIS试验确定了对于体重<80 kg和≥80 kg的患者,阿米万单抗的推荐II期剂量分别为1,050 mg和1,400 mg。在研究的剂量扩展部分中,该方案的安全性和功效在患有转移/不可切除NSCLC、带有EGFR外显子20插入突变且在铂类化疗后进展的患者中进行了测试。Sabari等人介绍了在临床截止时至少接受过三项疾病评估的功效人群(n = 81)和以推荐II期剂量治疗的安全性人群(n = 114)中的发现[15]。在功效人群中,先前治疗线的中位数为2。25%的患者先前用EGFR-TKI治疗,46%的患者接受了免疫疗法。
根据盲IRC,阿米万单抗表现出稳健的疗效,ORR为40%。临床受益率 (即≥2次评估的完全或部分缓解或疾病稳定)为74%。中位缓解持续时间为11.1个月。在数据截止时,47%的患者仍在接受治疗。中位PFS和OS分别为8.3和22.8个月。在所有亚组中以及在EGFR外显子20的不同插入区域(即,螺旋区域、近环、远环)上观察到该治疗的抗肿瘤活性。总体而言,对于外显子20插入突变型NSCLC患者,阿米万单抗的疗效优于目前可用的治疗选择[16]。
而且,该双特异性抗体显示出可耐受的安全特性,与在EGFR和MET途径抑制的条件下观察到的已知特征相一致。皮疹和输注相关反应是最常见的TEAE。但是只有2%的患者因为皮疹而中止治疗,并且几乎所有的输注相关反应都见于首次给药时,并且几乎不会影响继续治疗的能力。≥3级的治疗相关AE的发生率为16%,4%导致停药。基于这些结果,目前正在评估阿米万单抗与其他药物类别的联合使用。
PCR测试的失败率为50%
随着用于治疗外显子20插入阳性NSCLC患者的新药物的开发,分子异质性的外显子20插入突变的可靠鉴定变得越来越重要。最常用的测试方法是聚合酶链反应(PCR)和新一代测序(NGS)。但是,正如Bauml等人所示,许多病例往往未在PCR检测中被发现[17]。研究人员评估了PCR和NGS测试在美国NSCLC患者中全面鉴定EGFR外显子20插入变体的能力。为此,分析了两个真实世界的数据库,即AACR项目基因组学证据瘤形成信息交换数据库和FoundationInsights数据库。
来自两个数据库的结果均表明,PCR遗漏了约一半被NGS鉴定为外显子20插入的患者。根据NGS(40- 102),存在各种各样独特的外显子20变体,这表明在学术或市售NGS平台能够通过捕获全部变体范围来提高其检测率。
HER3定向的ADC帕特鲁单抗德鲁替康(patritumab deruxtecan)
包括>80%的EGFR突变型NSCLC在内的大多数肺癌都表达HER3,这代表了一个有希望的治疗靶点。HER3的过表达与较差的临床结果有关[18-20]。迄今为止,尚未有任何针对HER3的疗法获批。已经设计了新型研究性HER3定向抗体药物缀合物帕特鲁单抗德鲁替康,其包含与拓扑异构酶I抑制剂有效载荷共价连接的抗HER3 IgG1单克隆抗体。目前正在患有EGFR突变型转移性/不可切除性NSCLC的患者中进行的一项全球性、多中心、开放标签的I期研究中对其进行评估。
该试验的剂量递增部分纳入了在奥西替尼治疗后进展的患者或在厄洛替尼(erlotinib)、吉非替尼(gefitinib)或阿法替尼(afatinib)治疗后进展的T790M阴性患者。此处推荐的扩展剂量确定为静脉内5.6 mg/kg,每3周一次。该研究的剂量扩展部分中的患者分为3个队列;Yu等人在WCLC 2020上介绍的分析中包括队列1患者的数据[21]。该组先前接受过≥1个EGFR TKI和≥1个铂类化疗方案的治疗。
截至2020年4月30日,来自该研究的两个部分的57名患者接受了5.6 mg/kg 的帕特鲁单抗德鲁替康治疗,其中的56名可评估缓解。针对晚期或转移性疾病的先前疗法的中位数为4。47%的患者有CNS转移史。
早期获益与耐药性畸变无关
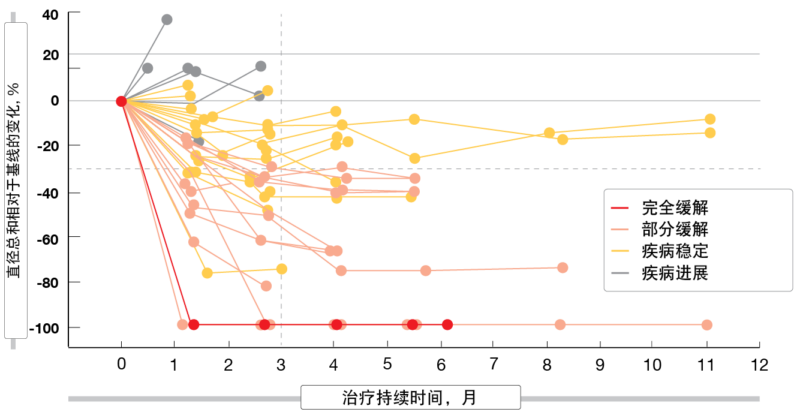
在中位随访5个月后,5.6 mg/kg帕特鲁单抗德鲁替康在患有EGFR突变型NSCLC且具有多种TKI耐药机制的经过大量先前治疗的人群中显示出具有临床意义的抗肿瘤活性。这些机制包括EGFR C797S突变、MET扩增、HER2突变、BRAF融合和PIK3CA突变。总体而言,25%的患者产生缓解且70%获得疾病控制,不过有3例局部缓解尚未确认,且6名患者在分析时仅接受了一次肿瘤评估。一名患者(2%)获得了完全缓解。肿瘤大小的减少在3个月内发生(图1)。中位缓解持续时间为6.9个月。
帕特鲁单抗德鲁替康显示出可控的安全性,其中血小板减少和中性粒细胞减少是最常见的≥3 级TEAE。9%的TEAE导致治疗中断。IRC判定三个间质性肺疾病事件(5.3%)与治疗有关。没有发生5级不良事件。正如作者在总结中指出的那样,这些观察结果整体上支持在没有可用靶向选择的患者人群中对帕特鲁单抗德鲁替康进行进一步临床研究。研究单药帕特鲁单抗德鲁替康的II期HERTHENA-Lung01研究正在招募EGFR TKI和铂类化疗失败后的患者(NCT04619004)。
图1: 帕特鲁单抗德鲁替康:肿瘤大小随时间的变化(n = 49)
前线美法替尼(mefatinib)令人印象深刻的活性
与突变的EGFR不可逆结合的第二代EGFR TKI美法替尼可抑制EGFR和HER2过表达的EGFR突变型和KRAS突变型肺癌以及其他HER2和EGFR过表达的癌症类型。进行了一项涉及106名EGFR突变型IIIB/IV期NSCLC患者的随机化、开放标签的II期研究,以评估口服一线美法替尼60 mg和80 mg每日一次的疗效和安全性[22]。分析得出,实质ORR在总人群中为 84.9%;对于60 mg和80 mg剂量分别为80.4%和89.1%。总体疾病控制率为97.2%。总人群中,中位PFS和OS分别为16.3个月和26.6个月。美法替尼的耐受性良好。各级别的AE主要包括腹泻(94.3%)和皮疹(86.8%)。在≥3级的事件中,最常见的AE为腹泻(19.8%)、皮疹(17%)、口腔溃疡(4.7%)和口腔炎(4.7%)。
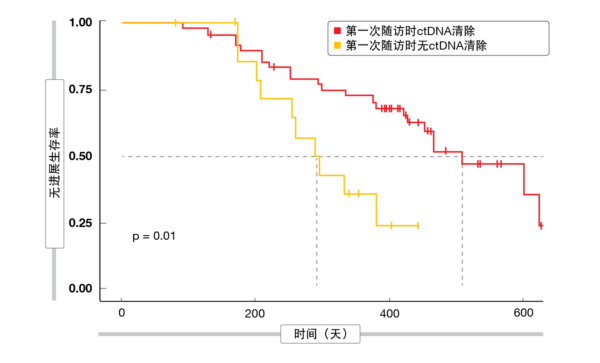
该试验包括一项生物标志物研究,旨在探索获得性美法替尼耐药性的预测性生物标志物和潜在分子机制。将循环肿瘤DNA(ctDNA)清除定义为一组168个肺癌相关基因中不存在任何突变。在开始美法替尼疗法后的首个6周随访中经历ctDNA清除的患者的PFS(p = 0.01;图2)和OS (p = 0.005)明显长于突变阳性个体。 数据截止时,有38名患者经历了疾病进展。其中,获得美法替尼耐药性的最普遍机制是EGFR T790M突变(42.1%)。三名带有EGFR T790M的患者还获得了并发的旁路耐药机制,分别是BRAFV600E突变(n = 2)和MET扩增(n = 1)。在18个病例(48%) 中未发现已知的耐药机制。
图2: 在美法替尼治疗的第一次随访时的ctDNA清除与无进展生存率之间的关系
ORCHARD
第三代EGFR TKI奥西替尼的一线治疗为EGFR突变型NSCLC患者提供了良好的治疗效果。但是,大多数患者会发展出耐药性。根据特定分子耐药机制的后续疗法可以使得针对标准细胞毒性化疗的个性化替代方案成为可能。迄今为止确定的最常见的对一线奥西替尼的获得性耐药机制包括SCLC转化(15%)、MET扩增(7-15%)、 EGFR C797X突变(7-11%)和继发性EGFR改变(11-12%)(图3)[23, 24]。
正在进行的II期平台ORCHARD研究正在一线奥西替尼治疗后进展且可 操作突变已被鉴定的EGFR突变型晚期NSCLC患者中评估生物标志物靶向治疗[25]。而且,该研究正在评估针对无可操作突变的患者的新型治疗策略。招募于2019年6月开始,预计研究将于2023年11月完成。
图3: 在经一线奥西替尼治疗的患者中鉴定的最常见的获得性耐药机制
RET融合:奥西替尼加塞尔帕替尼(selpercatinib)
在对一线奥西替尼发展出耐药性的患者中,约有5%存在获得性致癌性RET融合[26]。Rotow等人在经奥西替尼治疗而获得RET融合的EGFR突变型NSCLC患者中系统地表征了对奥西替尼加选择性RET抑制剂塞尔帕替尼的临床反应[27]。在所有塞尔帕替尼同情性访问计划中收集了11名患者的数据。
在该组中,奥西替尼加塞尔帕替尼被证明具有活性,ORR为50%,疾病控制率为80%。仅一名患者发展为进行性疾病。对于缓解者,中位治疗持续时间为11个月。联合疗法总体耐受良好。不良反应与两种药物的已知特征一致。一名患者因2级肺炎而终止治疗。各有一名患者需要减少塞尔帕替尼和奥西替尼的剂量。3级治疗相关AE包括高血压、QTc延长、中性粒细胞减少和白细胞减少。除严重AE之外,正式的AE报告是自愿的。
对奥西替尼加塞尔帕替尼的获得性耐药性的结果各不相同,反映了在对TKI单药治疗的获得性耐药性的条件下观察到的结果。畸变包括第二位点耐药性突变EGFR C797S和RET G810S。目前,ORCHARD研究正在具有获得性RET融合的EGFR阳性NSCLC患者中前瞻性地评估奥西替尼加塞尔帕替尼[25]。
阿法替尼用于EGFR G724S阳性疾病
EGFR外显子18 G724S是介导对第三代EGFR TKI治疗耐药性的罕见突变,但该突变对包括阿法替尼在内的第二代EGFR TKI保持敏感[28, 29]。Zhao等人在G724S阳性NSCLC患者中研究了阿法替尼,其数据来自包含42,316名肺癌个体的数据库[30]。23名患者进入了生存分析。此外,对52名患者中EGFR和其他基因的并发突变进行了分析。结果表明75%的患者同时携带EGFR外显子19缺失,其中最常见的是罕见的变体E746_S752 delinsV(55%)。15%的患者携带伴随的外显子20点突变。作者得出结论,作为耐药性突变的EGFR G724S在E746_S752delinsV的背景下优先出现,而与EGFR外显子20突变同时出现的G724S更有可能是主要突变。
所有接受阿法替尼治疗的带有G724S突变的患者(n = 8)均实现疾病稳定,疾病控制率达到100%。与非阿法替尼疗法相比(n = 15),PFS明显更长(4.5与1.7个月;HR,0.33; p = 0.04)。在接受奥西替尼后进展的患者亚组中,与非阿法替尼疗法(n = 8)相比,阿法替尼(n = 5)也诱导了更长的PFS(6.2与1.0个月;HR,0.04;p = 0.006)。作者认为,阿法替尼单药治疗是带有EGFR G724S突变的NSCLC患者的潜在治疗选择。EGFR T790M突变在两名经奥美替尼治疗的患者中作为对阿法替尼的主要耐药机制而重新出现,在一名经一线阿法替尼治疗的患者中出现MET扩增介导的耐药性。
一线和二线EGFR TKI与奥西替尼
FLAURA研究显示,在EGFR突变型晚期NSCLC患者中奥西替尼作为一线治疗与第一代EGFR TKI相比具有PFS和OS优势[31]。一项基于美国的多中心回顾性评审评估了2014年至2019年间在一线条件下接受第一代/第二代EGFR TKI或奥西替尼治疗的患者的预后[32]。总体包括172名患者;其中有52名(30.2%)接受了奥西替尼,120名(69.8%)接受了阿法替尼(n = 25; 14.5%)、吉非替尼(n = 1;0.6%)或厄洛替尼(n = 94;54.7%)。
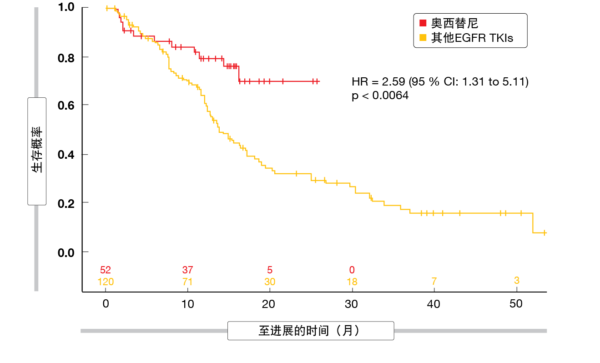
为了进行分析,将人群一分为二(奥西替尼与所有其他EGFR TKI)。除接受其他EGFR TKI的队列中总胆红素水平较高外,两组的所有基线特征均相当。在12和18个月时,与其他EGFR TKI相比,奥西替尼产生了改善的PFS(HR,2.59;p <0.0064;图4), 而各组之间的OS没有显著差异(HR,0.95;p <0.9128)。正如作者指出的那样,需要进一步的研究和更长的随访来巩固奥西替尼在现实世界中的OS益处。
图4: EGFR突变型NSCLC中奥西替尼与其他EGFR TKI作为一线药剂所获得的真实世界无进展生存率
参考文献
- Riess JW et al., Diverse EGFR exon 20 insertions and co-occurring molecular alterations identified by comprehensive genomic profiling of NSCLC. J Thorac Oncol 2018; 13(10): 1560-1568
- Fang W et al., EGFR exon 20 insertion mutations and response to osimertinib in non-small-cell lung cancer. BMC Cancer 2019; 19(1): 595
- Vyse S, Huang PH, Targeting EGFR exon 20 insertion mutations in non-small cell lung cancer. Signal Transduct Target Ther 2019; 4: 5
- Robichaux JP et al., Mechanisms and clinical activity of an EGFR and HER2 exon 20-selective kinase inhibitor in non-small cell lung cancer. Nat Med 2018: 24(5): 638-646
- Yasuda H et al., Structural, biochemical, and clinical characterization of epidermal growth factor receptor (EGFR) exon 20 insertion mutations in lung cancer. Sci Transl Med 2013; 5(216): 216ra177
- Beau-Faller M et al., Rare EGFR exon 18 and exon 20 mutations in non-small-cell lung cancer on 10 117 patients: a multicentre observational study by the French ERMETIC-IFCT network. Ann Oncol 2014; 25(1): 126-131
- Yang JCH et al., Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol 2015; 16(7): 830-838
- Udagawa H et al., Clinical outcome of non-small cell lung cancer with EGFR/HER2 exon 20 insertions identified in the LC-SCRUM Japan. J Thorac Oncol 2019; 14(10 suppl): S224 [abstract OA07.03]
- Hanna N et al., Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol 2004; 22(9): 1589-1597
- Kim ES et al., Gefitinib versus docetaxel in previously treated non-small-cell lung cancer (INTEREST): a randomised phase III trial. Lancet 2008; 372(9652): 1809-1818
- Neal J et al., Safety, PK, and preliminary antitumor activity of the oral EGFR/HER2 exon 20 inhibitor TAK-788 in NSCLC. J Thorac Oncol 2018; 13(10): S599
- Zhou C et al., Mobocertinib in NSCLC with EGFR exon 20 insertions: results from EXCLAIM and platinum pretreated patient populations. WCLC 2020, OA04.03
- Haura EB et al., JNJ-61186372 (JNJ-372), an EGFR-cMet bispecific antibody, in EGFR-driven advanced non-small cell lung cancer (NSCLC). J Clin Oncol 37, 2019 (suppl; abstr 9009)
- Park K et al., Amivantamab (JNJ-61186372), an anti-EGFR-MET bispecific antibody, in patients with EGFR exon 20 insertion (exon20ins)-mutated non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9512)
- Sabari JK et al., Amivantamab in post-platinum EGFR exon 20 insertion mutant non-small cell lung cancer. WCLC 2020, OA04.04
- Girard N et al., Comparative clinical outcomes for patients with NSCLC harboring EGFR exon 20 insertion mutations and common EGFR mutations. WCLC 2020, MA04.07
- Bauml JM et al., Underdiagnosis of EGFR exon 20 insertion mutation variants: estimates from NGS-based real-world datasets. WCLCL 2020, FP07.12
- Tan CS et al., Third generation EGFR TKIs: current data and future directions. Mol Cancer 2018; 17(1): 29
- Scharpenseel H et al., EGFR and HER3 expression in circulating tumor cells and tumor tissue from non-small cell lung cancer patients. Sci Rep 2019: 9(1): 7406
- Yi ES et al., High c-erbB-3 protein expression is associated with shorter survival in advanced non-small cell lung carcinomas. Mod Pathol 1997: 10(2): 142-148
- Yu HA et al., Efficacy and safety of the novel HER3 directed antibody drug conjugate patritumab deruxtecan (HER3-DXd; US-1402) in EGFR-mutated NSCLC. WCLC 2020, OA03.04
- Wang P et al., Phase II study of the efficacy of the EGFR inhibitor mefatinib in patients with advanced EGFR-mutant NSCLC. WCLC 2020, P76.28
- Ramalingam SS et al., Osimertinib as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer. J Clin Oncol 2018; 36(9): 841-849
- Schoenfeld AJ et al., Tumor analyses reveal squamous transformation and pff-target alterations as early resistance mechanisms to first-line osimertinib in EGFR-mutant lung cancer. Clin Cancer Res 2020; 26(11): 2654-2663
- Cho BC et al., ORCHARD: A biomarker-directed phase 2 platform study in patients with advanced EGFRm NSCLC progressing on first-line osimertinib. WCLC 2020 P76.27
- Leonetti A et al., Resistance mechanisms to osimertinib in EGFR-mutated non-small cell lung cancer. Br J Cancer 2019; 121(9):725-737
- Rotow J et al., Combination osimertinib plus selpercatinib for EGFR-mutant non-small cell lung cancer with acquired RET fusions. WCLC 2020, FP14.07
- Fang W et al., Emergence of EGFR G724S After Progression on Osimertinib Responded to Afatinib Monotherapy. J Thorac Oncol 2020; 15(3): e36-e37
- Oztan A et al., Emergence of EGFR G724S mutation in EGFR-mutant lung adenocarcinoma post progression on osimertinib. Lung Cancer 2017; 111: 84-87
- Zhao H et al., Afatinib as a potential therapeutic option for non-small cell lung cancer patients with EGFR G724S. WCLC 2020, P76.38
- Ramalingam SS et al., Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. N Engl J Med 2020; 382:41-50
- Lee CS et al., A comparison of sequential EGFR-TKI therapy versus first-line osimertinib in NSCLC: a multi-center, retrospective study. WCLC 2020, P76.09
© 2020 Springer-Verlag GmbH, Impressum