经由抗血管发生来增强免疫支持机制
使用抗血管生成剂的治疗有潜力管控接受免疫检查点抑制剂后进展的患者,因为已经证明过量的VEGF产生可通过调节免疫细胞功能和减少免疫细胞通路来创造免疫抑制性肿瘤微环境[1-3]。 这可能有助于检查点抑制剂的耐药性,并因此使抗血管生成疗法可用于该肿瘤。
VARGADO:化学免疫疗法后的尼达尼布(nintedanib)
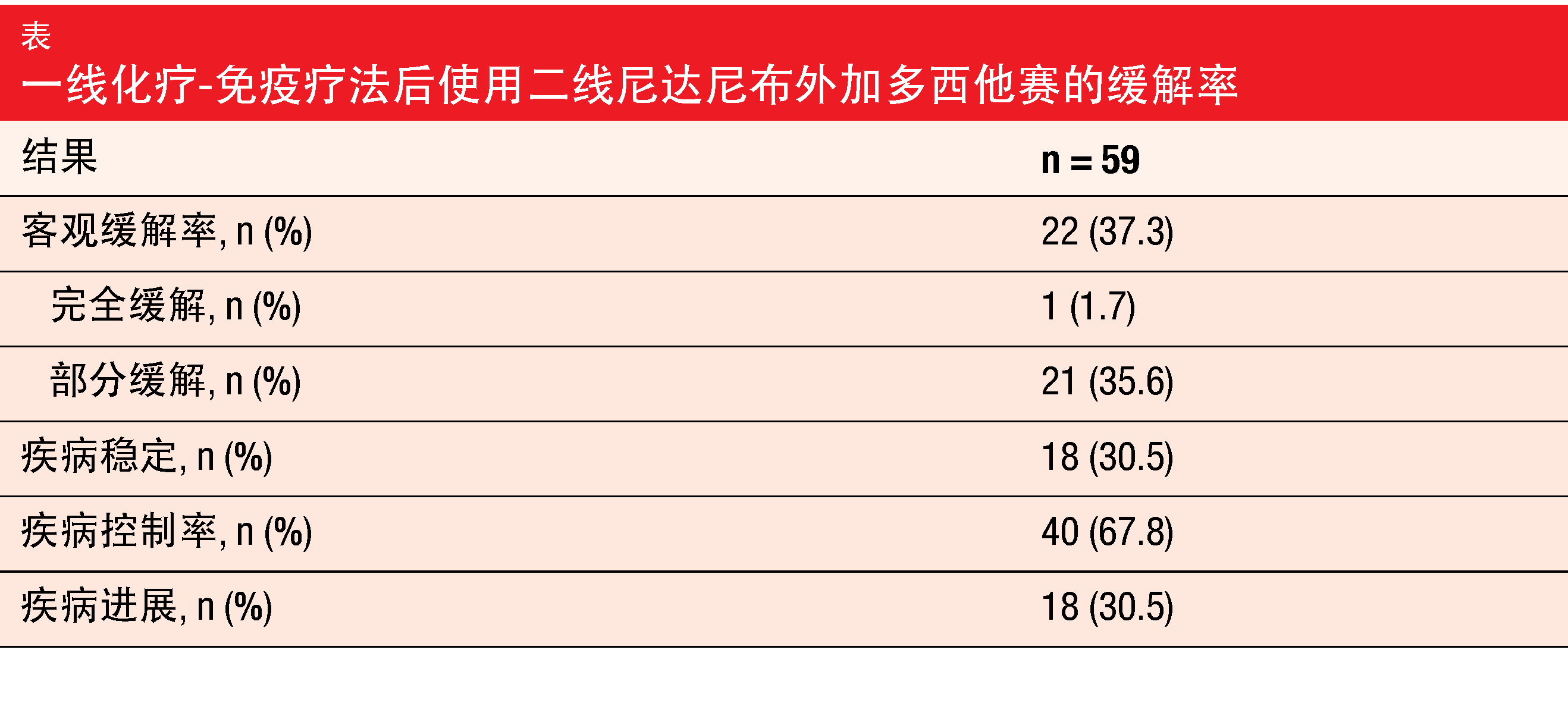
涉及抑制VEGF、PDGF和FGF的抗血管生成治疗被认为可增强血管正常化并改善细胞对肿瘤的可及性,从而有利于在所谓的血管免疫原性开关中扭转免疫支持性肿瘤微环境 [2]。多西他赛与靶向VEGFR 1-3、PDGFRα/β、FGFR 1-3和RET的口服三联血管激酶抑制剂尼达尼布联用已在许多国家被批准用于治疗一线化疗后的局部晚期、转移性或局部复发性肺腺癌。在正在进行的、前瞻性、非干预性VARGADO研究中,在真实世界条件下(例如化疗和免疫疗法后进展)评估了尼达尼布外加多西他赛,以帮助为临床决策提供信息。在ASCO 2021上,Grohé等人报告了该研究队列C的初始疗效数据,该队列在经一线化学免疫治疗而进展后接受了二线尼达尼布外加多西他赛[4]。分析包括在该队列中接受治疗的前100名患者。在三分之二的病例中,自开始一线治疗起的时间短于9个月。根据批准的标签给予尼达尼布外加多西他赛。
中位随访5.3个月后,中位PFS为4.4个月,总体缓解率为37.3%,疾病控制率为67.8%(表)。总体存活数据仍不成熟。药物相关的AE主要包括腹泻、恶心和疲劳。≥3级的治疗期间出现的AE的发生率为47%。31%的患者至少一次减少了尼达尼布的剂量,16%的患者至少一次减少了多西他赛的剂量。研究人员定义的药物相关的治疗期间出现的AE导致研究药物停药的情况的发生率为16%。没有出现新的安全性信号或意外毒性。
作者在其结论中指出,来自VARGADO研究队列C的初始数据首次证明,在经一线化学免疫疗法而进展后,二线尼达尼布外加多西他赛具有有临床意义的疗效和可管控的安全特性。该队列的招募和随访正在进行中。
VEGF/Ang2和PD-1组合抑制
另一种方法是抗血管生成和免疫治疗药物的组合,例如靶向VEGF和Ang2的双特异性纳米抗体® BI 836880与抗PD-1抗体ezabenlimab。BI 836880拮抗VEGF和Ang2的免疫抑制作用,从而重编程肿瘤微环境[2, 5-7]。添加PD-1抑制剂可驱动T细胞介导的肿瘤细胞死亡。这两种药物在I期研究中均已证明作为单一疗法具有安全性和初步抗肿瘤活性[8, 9]。
一项正在进行的Ib期研究旨在评估该组合在晚期或转移性实体瘤患者中的安全性和抗肿瘤活性。在剂量递增部分中,推荐剂量定义为720 mg BI 836880外加240 mg ezabenlimab,静脉内施用,每3周一次。该研究的队列扩展部分包括患有转移性NSCLC、SCLC、胶质母细胞瘤、转移性黑色素瘤和肝细胞癌的七个队列。队列A和B包括分别用免疫检查点抑制剂和化疗外加检查点抑制剂预先治疗的NSCLC患者(均为n=40)。队列C包含有或没有采用免疫疗法的经化疗SCLC患者(n=30)。总共215名患者被纳入ASCO 2021上所介绍的分析中[10]。
该组合在总群体中产生了13%的总体缓解率,队列A和C中分别有4和5名患者经历部分缓解。总共61%的患者疾病稳定。55%的患者出现了全级别的治疗相关AE,其中最常见的是虚弱(22%)、高血压(19%)和腹泻(14%)。观察到16%的患者有免疫相关AE。作者得出结论,BI 836880加ezabenlimab在一系列肿瘤类型中显示出初步的抗肿瘤活性和可管控的安全特性。
参考文献
- Popat S et al., Anti-angiogenic agents in the age of resistance to immune checkpoint inhibitors: Do they have a role in non-oncogene-addicted non-small cell lung cancer? Lung Cancer 2020; 144: 76-84
- Fukumura D et al., Enhancing cancer immunotherapy using antiangiogenics: opportunities and challenges. Nat Rev Clin Oncol 2018; 15(5): 325-340
- van der Woude LL et al., Migrating into the tumor: a roadmap for T cells. Trends Cancer 2017; 3(11): 797-808
- Grohé C et al., Second-line nintedanib + docetaxel for patients with lung adenocarcinoma after failure on first-line immune checkpoint inhibitor combination therapy: initial efficacy and safety results from VARGADO Cohort C. J Clin Oncol 39, 2021 (suppl 15; abstr 9033)
- Hofmann I et al., Dual targeting of angiogenesis pathways: combined blockade of VEGF and Ang2 signaling. 8th Euro Global Summit on Cancer Therapy 2015
- Gerald D et al., Angiopoietin-2: an attractive target for improved antiangiogenic tumor therapy. Cancer Res 2013; 73(6): 1649-1657
- Huang H et al., Targeting the ANGPT-TIE2 pathway in malignancy. Nat Rev Cancer 2010; 10(8): 575-585
- Le Tourneau C et al., First-in-human phase I trial of BI 836880, a VEGF/angiopoietin-2-blocking nanobody, given every 3 weeks in patients with advanced/metastatic solid tumors. J Clin Oncol 2018; 36(15_suppl): 12024
- Johnson ML et al., Phase I trial of the programmed death receptor 1 (PD-1) inhibitor, BI 754091, in patients (pts) with advanced solid tumors. J Clin Oncol 36, 2018 (suppl 5S; abstr 212)
- Girard N et al., Phase Ib study of BI 836880 (VEGF/Ang2 nanobody®) plus ezabenlimab (BI 754091; anti-PD-1 antibody) in patients with solid tumors. J Clin Oncol 39, 2021 (suppl 15; abstr 2579)
© 2021 Springer-Verlag GmbH, Impressum
More posts
为SCLC患者开辟新路径
采用铂-依托泊苷骨架的同步放化疗构成了局限期小细胞肺癌(LS-SCLC)的标准护理。在这里,顺铂传统上是首选的铂剂。 然而,在这种条件下,缺乏与毒性较低的卡铂的疗效比较数据。为了填补这一空白,Azar等人基于国家VA癌症立方体数据库(National VA Cancer Cube database)进行了一项回顾性研究[1]。纳入了用含铂类多药化疗的同步放化疗治疗的经病理证实为LS-SCLC的患者。总体而言,分析包括1,756人。
经由抗血管发生来增强免疫支持机制
使用抗血管生成剂的治疗有潜力管控接受免疫检查点抑制剂后进展的患者,因为已经证明过量的VEGF产生可通过调节免疫细胞功能和减少免疫细胞通路来创造免疫抑制性肿瘤微环境。 这可能有助于检查点抑制剂的耐药性,并因此使抗血管生成疗法可用于该肿瘤。 涉及抑制VEGF、PDGF和FGF的抗血管生成治疗被认为可增强血管正常化并改善细胞对肿瘤的可及性,从而有利于在所谓的血管免疫原性开关中扭转免疫支持性肿瘤微环境 。
检查点抑制在致癌基因驱动的肺癌中表现如何?
回顾性分析显示,免疫检查点抑制剂(CPI)在带有可操作致癌驱动突变的患者中的活性有限。 在类似情况下,随机对照的IMpower150和IMpower130研究表明,在携带EGFR和ALK畸变的患者中,将CPI添加到铂双药中没有生存期益处。 Kelly等人报告的回顾性研究描述了在致癌基因驱动的NSCLC的情况下,化疗外加CPI与单独化疗的PFS和其他终点[5]。纳入的患者至少有一个驱动突变(EGFR、ALK、ROS1、MET、RET、KRAS、HER2、NTRK)。在2018年1月至2019年12月期间,他们在NCI指定的加州大学癌症中心 (University of California Cancer Centers) 接受了含或不含检查点抑制的铂类双药方案。
免疫疗法:从预测因子到抗生素
基于随机化III期CheckMate9LA研究,纳武单抗外加伊匹单抗(ipilimumab)和两个化疗周期的一线治疗方案已在许多国家被批准用于无EGFR或ALK畸变的转移性NSCLC的适应症。 CheckMate 9LA包括每组约360名患有IV期或复发性疾病的患者,并且证明,与四个周期的标准化疗相比,基于免疫疗法的方案的OS、PFS和ORR显著改善。Reck等人报告了最短2年的随访后的最新疗效和安全性结果,以及因不良事件而中断治疗的患者的结果。
KRAS、MET、ROS1、HER2:当前观点
大约13%的肺腺癌患者携带KRASG12C突变。 尽管存在需求在经包括免疫检查点抑制剂在内的一线治疗而进展的该群体中改善结果,迄今为止,还没有靶向这种致癌驱动因子的药物获得许可。在单组II期CodeBreaK100试验中,同类首个、不可逆、选择性的KRASG12C抑制剂索托拉西已证明对经预先治疗的KRASG12C突变型局部晚期或转移性NSCLC患者具有持久的临床益处。在这项研究中,126名患者每日口服960 mg索托拉西。
EGFR突变型疾病:针对敏感突变和耐药性介导突变的策略
EGFR酪氨酸激酶抑制剂(TKI)是EGFR突变型NSCLC患者的既定一线选择,但从长远来看不可避免地会产生耐药性。 在EGFR TKI耐药性的背景下,已经鉴别了多种基因组改变。HER3在83%的NSCLC肿瘤中表达,不会在EGFR突变型疾病中赋予对EGFR TKI疗法耐药性。因此,靶向HER3的抗体-药物偶联物帕曲妥单抗-德卢替康(HER3-Dxd)是EGFR TKI治疗失败后潜在有效的后续选择。