Análisis mutacional: en vías de perfeccionamiento de los estándares
LCMC II
El Lung Cancer Mutation Consortium (LCMC) es un consorcio de varias insti- tuciones para el estudio de las mutacio- nes conductoras del adenocarcinoma de pulmón. La pluralidad de centros cola- boradores permite identificar cifras rela- tivamente elevadas de pacientes con al- teraciones infrecuentes y raras, facilita el análisis de sus características clínicas y sienta las bases para la realización de ensayos de tratamientos dirigidos.
El LCMC II, que es la segunda ronda del LCMC, comenzó en 2012 [1]. La pri- mera ronda, el LCMC I, se inició en 2009 y demostró que la elaboración de perfi- les genómicos puede rendir frutos, como actividad de una pluralidad de instituciones, en beneficio de los pa- cientes. En el LCMC II participaron 16 centros y se analizaron 14 alteraciones génicas. Al final del proyecto, todos los centros habían finalizado la transición a la secuenciación de próxima generación para la identificación de mutaciones, que era una de las metas del LCMC II.
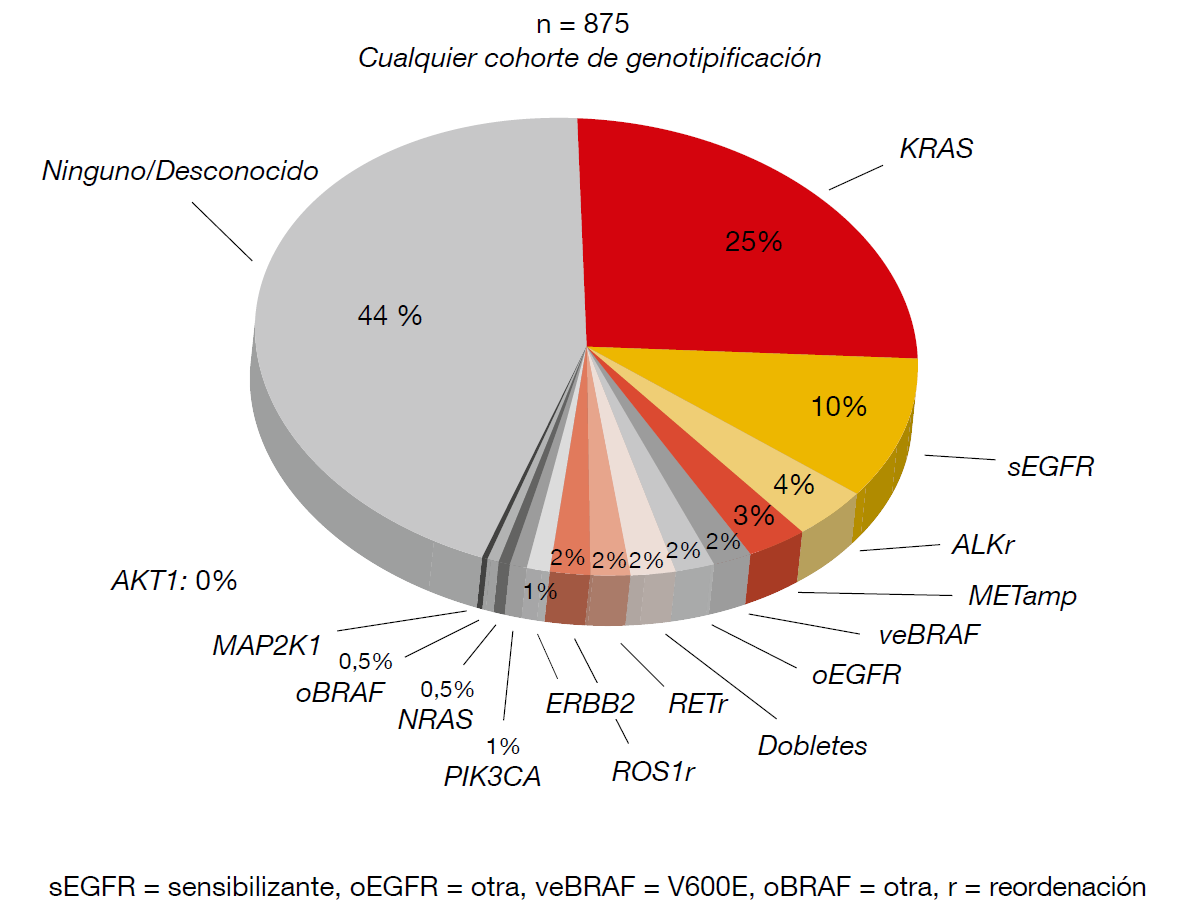
Los genes estudiados en el LCMC II fueron mutaciones puntuales en AKT1, BRAF, EGFR, HER2, KRAS, MAP2K1 (MEK), PIK3CA y NRAS, así como reor- denaciones en ALK, RET y ROS1, y otras alteraciones, como METamp, PTENexp y METexp. Participaron en el proyecto pacientes con adenocarcinoma de pul- món en estadio IV. Los resultados de los análisis génicos se transfirieron a la base de datos virtual del LCMC y a los médicos tratantes, que pudieron usar- los para seleccionar tratamientos de referencia o para recomendar ensayos clínicos con agentes concretos o trata- mientos no previstos en las fichas técni- cas. Los resultados así obtenidos con los pacientes volvieron a transferirse des- pués a la base de datos del LCMC. Se realizaron genotipos en 875 pacientes; 242 tenían alteraciones conductoras. Finalmente, se administró tratamiento dirigido a 131 pacientes.
Mejor supervivencia con el análisis genómico ampliado
La figura muestra la distribución de las mutaciones definidas en el LCMC II. No se incluyen la pérdida de PTEN y la ex- presión de MET; se daban en el 15 % y el 59 % de los casos, respectivamente. Como ya se ha descrito previamente, fue infrecuente la superposición de al- teraciones (4,1 % del total de casos).
Se observaron en el LCMC II muchas de las asociaciones ya conocidas con distintos pronósticos, como los benefi- cios resultantes del tratamiento con in- hibidores de tirosina cinasa del EGFR en la población con mutaciones en el EGFR. Además, como era de esperar, se correlacionaron entre sí el tabaquismo y determinadas alteraciones génicas. Si se considera la totalidad de mutaciones conductoras, el tratamiento dirigido lo- gró mejorar la supervivencia. En con- junto, no influyeron en los efectos del tratamiento dirigido las mutaciones concomitantes en TP53, PTEN y/o PI- K3CA. En cambio, se identificaron algu- nos moduladores. En el grupo de pa- cientes EGFR positivos a los que se trató con inhibidores de tirosina cinasa, la presencia de TP53 tuvo efectos modula- dores sobre los beneficios del trata- miento dirigido. La probabilidad de su- pervivencia fue mayor cuando no había mutación. Se demostró que las muta- ciones en KRAS implican un peor pronóstico en personas que nunca han sido fumadores.
Los autores concluyeron que las pruebas moleculares ampliadas y los tratamientos dirigidos asociados confieren beneficios de supervivencia, si bien es importante el aspecto relativo a los sistemas de análisis que se empleen. Puede haber amplias variaciones entre las tasas de mutaciones según que se utilicen unos u otros sistemas de análisis. Por ejemplo, lo más probable es que se produzca una infraobservación del estado de la mutación en TP53, lo que limita la capacidad para identificar a los pacientes afectados y desarrollar opciones de tratamiento. Según evolucionen los análisis y tratamientos, cabe esperar nuevas mejoras.
Figura: Frecuencia de las mutaciones observadas en el LCMC II en 875 pacientes con adenocarcinoma
de pulmón.
Las células tumorales circulantes reflejan la realidad
La secuenciación de próxima generación (SPG) del ADN tumoral circulante (ADNtc) permite establecer un perfil no invasivo de los tumores sólidos. Hasta la fecha, los estudios de biopsias líquidas se han visto limitados a cohortes de mo- desto tamaño y a estudios de casos. Ahora, el análisis genómico a gran es- cala ha establecido que los patrones de alteraciones genéticas que se detectan con biopsias líquidas pueden reflejar con bastante precisión cambios que se identifican en las biopsias tumorales tradicionales [2]. Se obtuvieron mues- tras de sangre de más de 15.000 pacien- tes con cánceres avanzados de 50 tipos distintos. El 37 % de los pacientes tenían cáncer de pulmón. Los perfiles genómi- cos somáticos se realizaron con una prueba SPG muy exacta y de amplia cobertura del ADNtc dirigida a 70 genes. Es uno de los mayores estudios de genó- mica del cáncer jamás realizados.
Salvo en el caso de las mutaciones de resistencia, como la mutación T790M del EGFR, las frecuencias específicas de los distintos tipos de cáncer y los patro- nes de exclusividad mutua entre las principales alteraciones conductoras (evaluadas en el ADNtc) remedan en gran medida los patrones de alteracio- nes tisulares. Si el ADNtc era positivo para las anomalías clave en EGFR, BRAF, KRAS, ALK, RET y ROS1, se hallaron las mismas mutaciones en el tejido en el 94 al 100 % de los casos. La mayoría de las alteraciones del ADNtc se detectaron a niveles muy bajos. La mitad se obser- varon a frecuencias inferiores al 0,4 % del ADN total circulante. La precisión de la biopsia líquida siguió siendo alta in- cluso a esos bajos niveles. En general, el análisis del ADNtc reveló posibles op- ciones de tratamiento dirigido en casi dos tercios de los pacientes evaluados.
En el subgrupo del CPNM se detecta- ron 51 casos de aberraciones conducto- ras mediante la SPG del ADNtc, además de los ya detectados con la genotipifi- cación tisular. El rendimiento de los bio- marcadores aumentó, por consiguiente, en un 42 %. En general, este análisis ilustra que la detección plasmática de mutaciones puede mejorar o comple- mentar el análisis tisular.
El ADNtc como marcador pronóstico
Lin y cols. expusieron la hipótesis de que las alteraciones específicas de tu- mores del ADNtc cuantifican la hetero- geneidad tumoral y pueden servir de método no invasivo para determinar el pronóstico y la recurrencia en pacientes con CPNM en estadio III irresecable que se tratan con intención curativa mediante radioquimioterapia [3]. La heterogeneidad tumoral se correla- ciona con resistencia terapéutica y mal pronóstico. Los investigadores evalua- ron el ADNtc en 156 pacientes con CPNM irresecable en tratamiento con radioterapia (XRT) o quimiorradiotera- pia. Se extrajo sangre antes, durante y después del tratamiento. Se usó una prueba de SPG para detectar variantes de nucleótidos aislados en 70 genes y amplificaciones en 16 genes, además de ciertas fusiones e indels.
Según el análisis intermedio, se ha- llaron en los puntos temporales estable- cidos cuatro patrones principales de alteraciones del ADNtc: alteraciones es- pecíficas persistentes durante la XRT (n = 9), ausencia de alteraciones en la muestra post-XRT (n = 14), niveles mayores que en el momento basal (n = 10) y alteraciones fluctuantes durante el tratamiento (n = 11). No se observaron asociaciones significativas entre la SLP/ SG y estos patrones de alteraciones del ADNtc. Lo mismo puede decirse de la SLP/SG y los cambios porcentuales de los niveles de ADNtc entre antes y des- pués de la XRT. Los resultados, no obs- tante, están limitados por el tamaño de la muestra.
En todo caso, la presencia de muta- ciones específicas parece estar correla- cionada con el pronóstico. La reapari- ción de las mutaciones conductoras tras el tratamiento se asoció a una SLP me- nor. Las mutaciones en APC/ARID1A presentes en la muestra de sangre post- XRT se correlacionaron con una SLP menor después de ajustar para la histo- logía tumoral y el estadio. Del mismo modo, las mutaciones en NF1 detecta- das en las muestras post-XRT se asocia- ron a una SG menor después de ajustar para la histología tumoral y el estadio. Podría ser necesario el análisis final de la cohorte mayor para alcanzar la signi- ficación en relación con otros patrones pronósticos.
REFERENCES
- Aisner DL et al., Expanded genomic testing in lung adenocarcinomas expands the survival be- nefit. J Clin Oncol 34, 2016 (suppl; abstr 11510)
- Zill OA et al., Somatic genomic landscape of over 15,000 patients with advanced-stage can- cer from clinical next-generation sequencing analysis of circulating tumor DNA. J Clin Oncol 34, 2016 (suppl; abstr LBA11501)
- Lin SH et al., Circulating tumor DNA as a non-invasive tool to identify patients at risk for recurrence after chemoradiotherapy in stage III non-small cell lung cancer. J Clin Oncol 34, 2016 (suppl; abstr 8553)
More posts
„La importancia de los fármacos dirigidos contra dianas moleculares de primera y segunda línea es evidente“
Cuando se diagnostican mutaciones en EGFR en el contexto de primera línea, tenemos el lujo de contar con tres opciones en el momento actual. Sin embargo, es importante distinguir entre los diferentes tipos.Las mutaciones en EGFR aparecen habitualmente en los exones 18 a 21.
La asistencia sanitaria del cáncer de pulmón en América Latina: evolución de los tratamientos modernos y desafíos para superar las lagunas existentes
Es importante entender que América Latina es un gran continente, con unos 600 millones de habitantes. Las cuatro ciudades más pobladas son Ciudad de México, Rio de Janeiro, São Paulo y Buenos Aires, entre las cuales suman un número de habitantes igual al de Francia. En la actualidad se declaran unos 85.000 casos nuevos de cáncer de pulmón al año en América Latina.
Opciones terapéuticas en expansión para los pacientes con CPNM con mutaciones raras: ALK, ROS1, MET, BRAF
En el 4 % a 5 % de todos los pacientes de raza blanca y asiáticos con cáncer de pulmón no microcítico (CPNM) avanzado se producen reordenamientos del gen ALK. Crizotinib fue el primer inhibidor de ALK autorizado y representa el estándar de tratamiento de primera línea actual para el CPNM con ALK positivo.
Inmunoterapia: actualizaciones sobre ensayos clínicos y otras perspectivas
Además de los fármacos dirigidos contra mutaciones iniciadoras, las inmunoterapias representan uno de los dos avances recientes más importantes del último decenio en el tratamiento del cáncer de pulmón no microcítico (CPNM) metastásico. Nivolumab e ipilimumab potencian la actividad antitumoral de linfocitos T por mecanismos diferentes y complementarios.
Prefacio
Las tasas de mortalidad del cáncer de pulmón han descendido en los varones y las mujeres en estos últimos años. La detección precoz, el mejor conocimiento de la biología tumoral y toda una serie de nuevas opciones de tratamiento han hecho posible este avance. No obstante, el cáncer de pulmón sigue siendo la principal causa de muerte por cáncer en Estados Unidos y en el resto del mundo, lo que ha incitado a la comunidad científica a perseverar en sus esfuerzos de investigación y a trasladarlos a ámbitos caracterizados tradicionalmente por escasos progresos, como el cáncer de pulmón microcítico (CPM).