免疫疗法:临床试验情况更新及其它洞见
纳武单抗联合易普利姆玛:CheckMate 012
除了针对驱动突变的靶向药物之外,免疫疗法代表了过去十年中,治疗转移性非小细胞肺癌(NSCLC)的最近两项重大进展之一。纳武单抗和易普利姆玛通过独特而互补的机制增强 T细胞抗肿瘤活性。这两种药物的组合已在美国和欧盟获批用于转移性黑色素瘤。在非小细胞肺癌中,纳武单抗 单药治疗已被批准作为局部晚期或转移性疾病的二线疗法,而同时一线标准疗法仍由铂双药化疗构成。对于改善一线治疗选择的进展在过去十年里趋于平稳,而对于这一临床环境中的改善的需求至关重要。
因此,3 组随机化 I 期 CheckMate 012 试验对联合免疫疗法在任何组织学的晚期非小细胞肺癌(IIIB / IV 期)患者身上的作用进行了检验。治疗包括每 2 周施用1 mg/kg 纳武单抗结合每 6 周施用 1 mg/kg 易普利姆玛,每 2 周施用 3 mg/kg 纳武单抗结合每12 周施用 1 mg/kg 易普利姆玛,或者每 2 周施用 3 mg/kg 纳武单抗结合每 6 周施用 1 mg/kg 易普利姆玛。先前数据表明,在接受 3 mg/kg 纳武单抗的两个组中疗效最大。在 ASCO 大会上介绍的最新分析是在这两组的长期随访之后进行的,两组分别包含 38 名患者(纳武单抗结合每 12 周施用易普利姆玛)和 39 名患者(纳武单抗结合每 6 周施用易普利姆玛)[1]。安全性和耐受性被定义为主要终点。
提高的耐受性和可喜的疗效
与 CheckMate 012 中包含的,施用更高或更频繁剂量的易普利姆玛的旧有组合方案相比,这些剂量方案显示出提高的耐受性和可控的安全性。治疗相关的 3/4 级不良事件(AE)发生率分别为 37%和 33%,并且导致停药为较早研究组的显示比例的三分之一
(分别为 5%和 8%)。未观察到治疗相关的死亡。令人欣慰的是,3/4 级免疫相关不良事件的总发生率在全部治疗组中均为低水平。这些数据类似于CheckMate 012 试验中每 2 周使用 3 mg/kg 纳武单抗单药治疗的一个单独组。 分析显示出可喜的疗效,其中总反应率(ORR)分别达 47%和 39%。这些 ORR 超过了采用纳武单抗单药治疗获得的 ORR。反应持续时间的中位数尚未获得。根据汇集生物标志物分
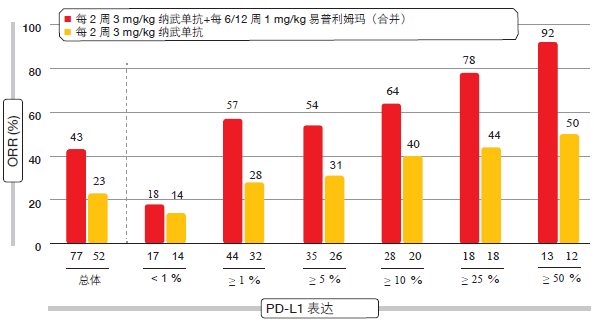
析,疗效提高是因为 PD-L1 的表达得到增强,并且接受组合治疗的患者在所有的 PD-L1 表达水平中都比历史上的仅纳武单抗组表现得更好(图 1)。此外,在从不吸烟者和当前/曾经吸烟者中,该组合都一致地观察到相比纳武单抗单药治疗的优越性。带有EGFR 突变的患者在使用纳武单抗加易普利姆玛的情况下,比单纯使用纳武单抗
的情况显示出明显更高的 ORR。采用组合获得的反应趋向于既深入又持久,并且在大多数病例中在早期就已
实现。包含每 2 周施用 3 mg/kg 纳武单抗结合每 6 周施用 1 mg/kg 易普利姆玛的方案现正在包括 III 期CheckMate 227 试验在内的进一步研究中进行评估。
图 1:CheckMate 012:在不同 PD-L1 表达水平中,两项纳武单抗结合易普利姆玛方案对比纳武单抗单药疗法的合并 ORR 分析
CheckMate 017 and 057 中纳武单抗的持久生存获益
在 III 期 Check-Mate 017(鳞状组织学)试验[2]和 CheckMate 057(非鳞状组织学)试验[3]中,纳武单抗单药疗法对晚期非小细胞肺癌展现出相比于多西他赛的显著总生存率(OS)获益。Borghaei 等人介绍了基于≥2 年的随访,来自这两项研究的最新 OS 和安全性结果。此外,针对这两种组织学类型进行了基线血清细胞因子谱与OS 之间相关性的探索性分析。 在这两项试验中,相比多西他赛,纳武单抗展现出持久、长期的 OS和无进展生存期(PFS)。在从 1 年到2 年的时间中,纳武单抗组与多西他赛组之间的 OS 和 PFS 差异保持一致。在第二年,CheckMate 017 试验中纳武单抗组与多西他赛组患者的存活率 分别为 23%和 8%(HR,0.62)。对于CheckMate 057,该百分比为 29%和16%(HR,0.75)。在 Check-Mate 057 中,如初步分析所显示,PD-L1 表达水平与 OS 获益的幅度相关。在这两项研究中,纳武单抗治疗患者报告的治疗相关不良事件均少于多西他赛治疗患者。总体上,第二年的不良事件率与第一年相似。
反映基线细胞因子谱的 cytoscore评分在鳞状与非鳞状疾病中似乎都与预后相关,但这些结果只是提出假
说,尚需前瞻性验证。Cytoscore 评分与纳武单抗和多西他赛的治疗效果不相关。
派姆单抗(pembrolizumab)的长期结果
基于大型多队列 Ib 期 KEYNOTE-001研究中获得的结果[5, 6],派姆单抗在美国获得加速批准,用于治疗表达了PD-L1 并且施用含铂化疗和获批的EGFR 或 ALK 抑制剂(FGFR 或 ALK阳性情况)之后病情进展的晚期非小细胞肺癌。KEYNOTE-001 展现出较高PD-L1 表达与效果改善之间的相关性。 对 KEYNOTE-001 的长期分析显示,派姆单抗单药疗法在晚期非小细胞肺癌患者中提供了持久的 OS 获益[7]。PD-L1 表达提高关联于生存获益提高。派姆单抗持续具有可控的安全性;在长期随访中未发生意外毒性。连同在先前接受治疗且对肿瘤细胞的PD-L1 表达率≥1 %的非小细胞肺癌患者中展现出使用派姆单抗后 OS 改善的KEYNOTE-010 试验,这些数据支持将PD-L1 作为派姆单抗的预测性生物标志物,并且证实了该药物的可控安全性。
Atezolizumab 带来的 OS改善随时间逐渐变得明显
POPLAR 研究中,针对先前接受治疗并在基于铂的治疗期间或之后病情进展的局部晚期或转移性非小细胞肺癌患者,将工程化人源化抗 PD-L1 抗体atezolizumab 与多西他赛进行了比较。在最少 13 个月的随访后,进行了初步分析,表明在非选择性患者和PD-L1 选择性患者身上,atezolizumab均具有超越多西他赛的 OS 获益[9, 10]。对肿瘤细胞和/或免疫细胞的 PD-L1 表达增加与 OS 获益增大相关联。生存曲线显示出后期分离,凸显出需要进行长期随访以充分反映这种抗PD-L1 疗法的获益。
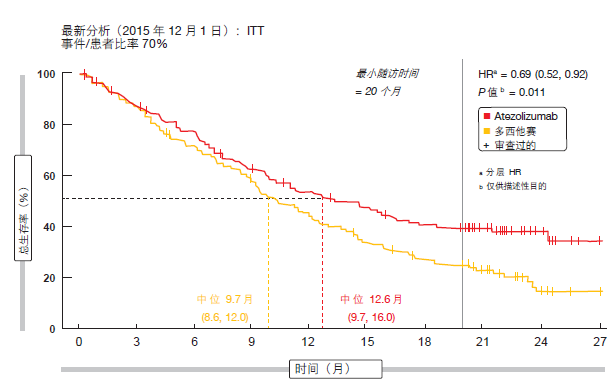
因此 Smith 等人介绍了在最少 20个月的随访之后进行的更新分析[11]。该分析表明了生存曲线在 ITT 人群中的进一步分离(图 2)。与先前模式相一致,随时间推移,atezolizumab改善了 OS 风险比(HR)。在全部PD-L1 亚组中都观察到 OS 获益。此外,全部组织学亚组的生存曲线都显示出随时间推移的持续分立,而在鳞状非小细胞肺癌亚组中 HR 的改善更加明显。在 ITT 人群中,PFS 和 ORR在 atezolizumab 与多西他赛组之间相似;这里,数据与初步分析相比没有显著变化。
图 1:CheckMate 012:在不同 PD-L1 表达水平中,两项纳武单抗结合易普利姆玛方案对比纳武单抗单药疗法的合并 ORR 分析
正如作者所指出,OS 获益与 PFS和 ORR 研究结果之间缺少相关性暗示 着根据实体瘤疗效评价标准(RECIST),atezolizumab 带来的OS 改善可能延伸到疾病进展之外。然而,采用 atezolizumab 观察到的反应是持久的(atezolizumab 与多西他赛的中位数分别为 18.6 与 7.2 个月)。这些结果共同提供了进一步证据表明,atezolizumab 带来的生存获益扩大到所有非小细胞肺癌患者。
Durvalumab 在鳞状疾病和非鳞状疾病中显示出疗效
多中心、开放标签式剂量递增和剂量 扩大 I/II 期试验研究了 durvalumab 在晚期初治非小细胞肺癌患者中的安全性和临床疗效[12]。Durvalumab 是一种选择性、高亲和性、工程化人单克隆抗 PD-L1 抗体。我们对 PD-L1 表达进行了前瞻性评估(高:≥ 25 %肿瘤细胞染色;低或负:< 25 %肿瘤细胞染色)。对 59 名不曾接受过晚期疾病的前期全身疗法的患者进行了治疗,其中有 49 人表现出较高的 PD-L1 表达。
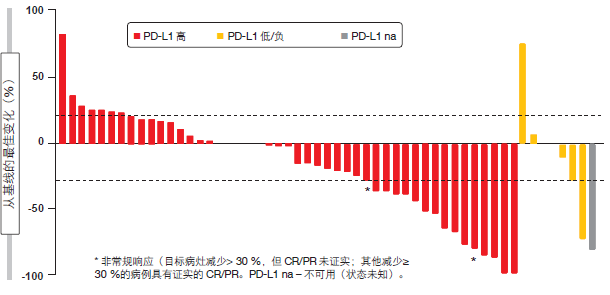
试验表明每 2 周施用 10 mg/kg 的durvalumab 具有可控的安全性。ORR为 27%;在 PD-L1 表达较高的患者中,反应发生率为 29%,而在表达较低或者为负的患者中反应发生率为11%。一名表达较高的患者体验到完全缓解。在较高以及较低/负 PD-L1 表达的患者,以一名 PD-L1 表达状态未知的患者身上,均观察到目标病灶减少(图 3)。对于 PD-L1 表达较高的患者,ORR 与组织学(鳞状与非鳞状)无关。在患有非鳞状疾病且 PD-L1 表达较低或为负的 3 名患者身上,未发生反应。表达较高的目前或曾经吸烟者显示出> 30 %的 ORR。反应总体上快速而持久;到数据截止时,其为69%且正在持续。正在针对初治晚期非小细胞肺癌患者的一系列研究中考察durvalumab。
图 3:根据 PD-L1 表达所获得的使用 durvalumab 时肿瘤尺寸距离基线的最佳变化
JAVELIN:avelumab 在化疗难治性间皮瘤中的作用
每年在美国确诊约 3000 例恶性间皮瘤。对于一线化疗后发生进展的患者,尚无 FDA 批准的治疗方案。国际性多队列剂量递增和剂量扩大 Ib 期JAVELIN 试验基于 PD-L1 在间皮瘤细胞表面上的表达,考察了完全人抗PD-L1 抗体 avelumab 在间皮瘤中的作用[13]。JAVELIN 总共招募了 1600 名各种肿瘤类型的患者。53 名患有晚期不可切除性胸膜或腹膜间皮瘤,且在用铂和培美曲塞(pemetrexed)治疗后病情进展的患者接受了每 2 周 10 mg/kg 的 avelumab 治疗。对 PD-L1表达状态进行了评估,从而揭示出在51.3 %的病例中任何染色强度的存在(≥ 1 %的肿瘤细胞)。
avelumab 单药治疗产生了 56.6 %的疾病控制率,这主要是由于病情稳定(47.2 %)。5 名患者产生部分反应(9.4 %),并在其中 4 名患者的最近随访中仍然持续。尚未达到反应持续时间中位数。ORR 和 PFS 未随 PD-L1表达水平而存在差异。总体上,中位PFS 为 17.1 周。Avelumab 显示出可接受的安全性。大部分治疗相关 AE 都为1 级或2 级。在 13.2%的患者中观察到 任何级别的免疫相关 AE,但 3 级事件发生率仅为 1.9 %。还在进行中的随访将会进一步表征临床活性的持久性。
超越 RECIST 进展的治疗是否可行?
在免疫疗法的情况下,在根据 RECIST作为终点的肿瘤缩小上存在着不确定性,这是因为对缩小的评估似乎低估了在存活方面的真实获益幅度。这种担忧可能并不多余,因为常规反应标准基于传统细胞毒性化疗,并且肿瘤恶化或假性病情进展可能导致早期治疗中止。在最初 RECIST 定义病情进展之后肿瘤尺寸减小的故事性病例已导致人们开展允许在超过 RECIST 定义首次病情进展之后进行治疗的试验。
在 ASCO 大会上介绍的一项回顾性探索分析中,描述了在常规病情进展过后接受抗 PD-1 疗法(病情进展过后治疗,TPP)的转移性非小细胞肺癌患者身上的研究发现[14]。研究者汇集了已提交到 FDA 的,对初始治疗后病情进展的 535 名患者接受的抗 PD-1 单药治疗进行评价的 3 项多中心临床试验。从这些试验中,识别出了 121 名接受 TPP 的患者。对来自 RECIST 定 义病情进展之后影像学肿瘤测量数据的肿瘤负荷变化进行了评价。
与接受抗 PD-1 治疗的全部患者(n = 535)相比,接受 TPP 的亚组表现出频率稍高的非鳞状细胞癌(59 %与 54 %)。大多数患者仅接受过一种前线化疗,并且所有患者均具有 0 或 1的 ECOG 行为状态评分,但 ECOG 0在 TPP 组中频度更高(36 % 与25 %)。接受 TPP 的患者按 RECIST标准最初病情进展,原因为非目标病灶明确进展(38 %)、出现新病灶(32 %),或者目标病灶从最低点出现≥ 20 %的增大。观察到 2 种原因或所有 3 种原因的重叠。
微小但不可忽视的作用
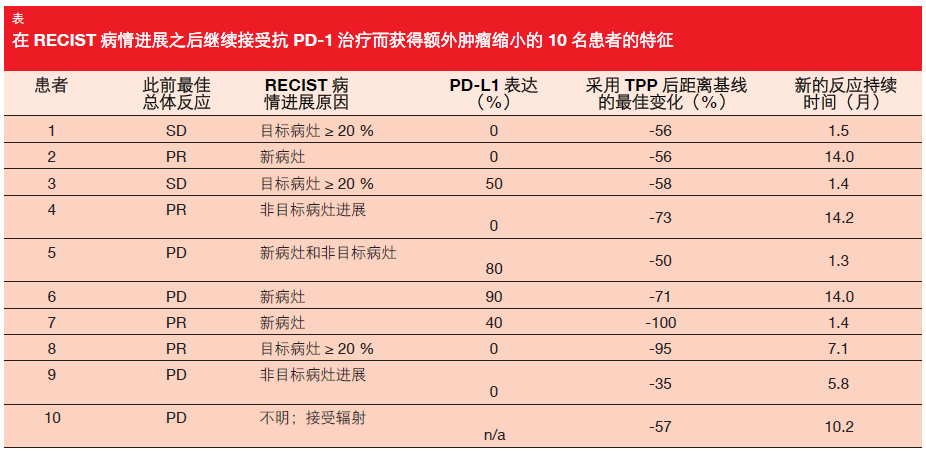
在接受 TPP 的 121 名患者中,有 10 人(8.3 %)经历额外的肿瘤缩小——定义为与基线相比≥ 30 %的后续目标病灶缩小。下表归纳了这些患者的特征。该组代表这些试验中接受抗 PD-1药物治疗的全部患者的 1.9 %。在 TPP期间,与基线相比的最佳肿瘤缩小范围从 35 % 到 100 % (中位 数 为58 %)。对于 TPP,在≥ 30 %缩小之后的反应持续时间中位数尚未达到。 在数据采集时,10 名患者中至少有 5名已有至少 6 个月的反应,并且 3 名患者持续反应超过 1 年。
此外,目标病灶的最佳缩小发生在与总体最低点测量值相比获得至少30 %减少的患者之中。10 名患者中有7 人满足这些条件。与最低点相比,最佳肿瘤缩小范围从 13 %到 100 %,中值为减小 35 %。新反应的持续时间表现出从 1.3 个月到>1 年的较宽范围。 根据作者的结论,目前尚不清楚 观察到的肿瘤缩小是由于 TPP,还是由于患者曾接受过的免疫治疗的延迟效应。这意味着需要在首次病情进展之后持续治疗的风险(免疫相关不良反应)与进一步肿瘤缩小的可能性之间作出权衡。随着关于免疫疗法应用的知识不断积累,有可能能够更好地识别出更能从 TPP 获益的患者(例如,生物标志物、患者特征)。需要进行随机化对照试验来前瞻性地确立首次病情进展之后对患者进行治疗的 获益。然而,TPP 并不太可能显著改变主要 FDA 监管终点结果或者获益/风险判定。
参考文献
- Hellmann MD et al., CheckMate 012: safety and efficacy of first-line nivolumab and ipilimumab in advanced NSCLC. J Clin Oncol 34,
2016 (suppl; abstr 3001) - Brahmer J et al., Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373: 123-135
- Borghaei H et al., Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373:
1627-1639 - Borghaei H et al., Nivolumab vs. docetaxel in patients with advanced NSCLC: CheckMate 017/057 2-year update and exploratory cytokine
profile analyses. J Clin Oncol 34, 2016 (suppl; abstr 9025) - Garon EB et al., Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 2015; 372: 2018-2028
- Chatterjee M et al., Systematic evaluation of pembrolizumab dosing in patients with advanced non-small-cell lung cancer. Ann Oncol. REFERENCES 2016 Apr 26. pii: mdw174. [Epub ahead of print]
- Hui R et al., Long-term overall survival for patients with advanced NSCLC enrolled in the KEYNOTE-001 study of pembrolizumab. J Clin Oncol 34, 2016 (suppl; abstr 9026)
- Herbst RS et al., Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387: 1540-1550
- Vansteenkiste J et al., Atezolizumab monotherapy vs docetaxel in 2L/3L non-small cell lung cancer: Primary analyses for efficacy, safety and predictive biomarkers from a randomized phase II study (POPLAR). ECC 2015, abstract 14LBA, Eur J Cancer 2015; 51 (Suppl 3): 716-717
- Fehrenbacher L et al., Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016; 387(10030): 1837-1846
- Smith DA et al., Updated survival and biomarker analyses of a randomized phase II study of atezolizumab vs. docetaxel in previously treated NSCLC (POPLAR). J Clin Oncol 34, 2016 (suppl; abstr 9028)
- Antonia S et al., Safety and clinical activity of durvalumab (MEDI4736), an anti-PD-L1 antibody, in treatment-naïve patients with advanced non-small cell lung cancer. J Clin Oncol 34, 2016 (suppl; abstr 9029)
- Hassan R et al., Avelumab (MSB0010718C; anti-PD-L1) in patients with advanced unresectable mesothelioma from the JAVELIN solid tumor phase Ib trial: Safety, clinical activity, and PD-L1 expression. J Clin Oncol 34, 2016 (suppl; abstr 8503)
- Kazandjian D et al., Characterization of patients treated with a programmed cell death protein 1 inhibitor (anti-PD-1) past RECIST progression from a pooled analysis of metastatic non-small cell lung cancer (mNSCLC) trials. J Clin Oncol 34, 2016 (suppl; abstr 3000)
More posts
寡转移性非小细胞肺癌中局部治疗产生的无进展生存期改善
有证据表明存在一种“有限转移性” 的非小细胞肺癌(NSCLC)表型。然而,针对这些患者的最佳治疗类型和积极局部治疗作用仍然存在争议。 Gomez 等人介绍了旨在解决这一问题的第一项前瞻性随机化试验。参 与试验的病人患有 IV 期疾病,并且在一线全身治疗(FLST)后无 RECIST进展且最多有 3 处转移。
局部晚期非小细胞肺癌:口服长春瑞滨显示出比依托泊苷更好的安全性
进行的随机化、多中心、开放标签 II期 RENO 试验的目标在于建立局部晚期非小细胞肺癌(NSCLC)放化疗环境下的规范化疗方案。总共有 134 名不能手术的 III 期 NSCLC 患者接受了口服长春瑞滨(vinorelbine)加顺铂或依托泊苷(etoposide)加顺铂治疗。
ULTIMATE:在一线外采用化疗联合贝伐单抗
由于化疗在二线或三线非小细胞肺癌(NSCLC)环境下表现得疗效有限,因此 III 期随机化 ULTIMATE 试验在接受一线或两线治疗后病情进展的晚期非鳞状 NSCLC 患者中对化疗与贝伐单抗(bevacizumab)的联合治疗进行了测试。先前铂基或培美曲塞(pemetrexed)疗法是必含的,并且允许在先前进行贝伐单抗治疗。
新治疗方法为小细胞肺癌患者带来希望
小细胞肺癌(SCLC)在肺癌病例中占比高达 10 %到 15 %,但在过去 30 到40 年里对这种疾病的治疗方面进展不大。SCLC 对放射敏感,但大约 70 %的病人具有无法包含在一个放疗野中的扩大的病变。大部分患者对一线化疗有反应。
突变分析:在通向完善标准的道路上前行
肺癌突变联盟(LCMC)是一个旨在研究肺腺癌驱动突变的多机构联盟。参与合作机构支持鉴别出相对大量带有不常见和罕见变异的患者,从而有助于分析其临床特征,并为靶向治疗试验打下基础。 LCMC II 作为第二轮 LCMC,从2012 年开始[1]。首轮 LCMC I 启动于2009 年,并证明了基因组分析可以在多机构努力下共同进行,以使患者获益。
“一线和二线靶向药物的重要性显而易见”
当在一线环境下诊断出 EGFR 突变时,我们目前拥有 3 种之多的选择。然而,在不同类型之间加以区分是很重要的。EGFR 突变通常发生于外显子18 至 21。大多数激活突变都将反应于所有 EGFR TKI;然而,例如外显子 18等少见位置对阿法替尼(afatinib)的反应往往强于对吉非替尼(gefitinib)和埃洛替尼(erlotinib)等其他一线TKI。