对于EGFR靶向治疗的当前观点
评估阿法替尼(afatinib)的全球IIIb期研究
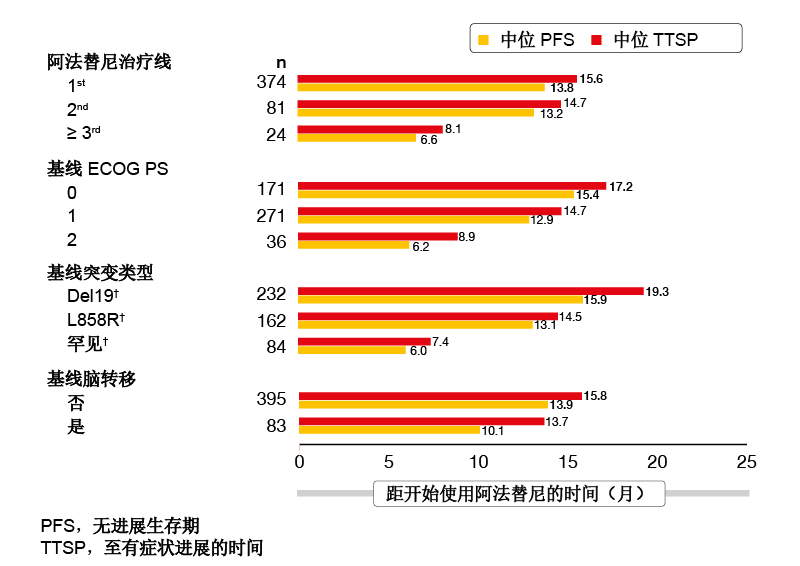
基于III期LUX-Lung 3和6试验,第二代不可逆ErbB家族阻断剂阿法替尼已被确定为EGFR突变NSCLC患者的一线标准选择,该试验显示出与铂双药化疗相比显著的无进展生存期(PFS)和客观缓解率(ORR)改善[1,2]。此外,IIb期LUX-Lung 7研究显示,与第一代EGFR酪氨酸激酶抑制剂(TKI)吉非替尼(gefitinib)相比,阿法替尼在PFS、ORR和至治疗失败时间方面有显著获益[3]。在欧洲、以色列和澳大利亚进行的开放标签多中心IIIb期试验目前正在现实条件下评估40 mg/天阿法替尼直至疾病进展。可基于个体耐受性进行至30 mg/天或20 mg/天的两种剂量减少。允许无症状的脑转移。 在2019年ELCC大会上介绍的中期分析共纳入479名患者[4]。在这些患者中,17 %有脑转移,18 %有罕见EGFR突变,其中外显子20插入代表最常见的类型,并且分别有57 %和8 %的ECOG 表现状态为1和2。分别有78 %和17 %接受阿法替尼作为一线和二线治疗。因此,该人群反映了现实状况。安全性被定义为中期分析的主要终点,PFS、至有症状进展的时间(TTSP)、ORR和疾病控制率(DCR)被定义为疗效终点。 总体而言,结果与在LUX-Lung 3、 6和7试验中观察到的针对阿法替尼的结果相一致。阿法替尼显示出可预测且可控的安全性特征。腹泻和皮疹是最常见的不良事件(AE)和剂量减少 的主要原因,其中剂量减少在54 %的情况下是必要的。在8 %的情况下,患者的AE导致治疗中止,最常见为腹泻。导致中止的每种其他AE占这些情况的< 1 %。此外,中期分析显示出令人鼓舞的疗效结果,中位PFS为13.37个月,TTSP为14.91个月。阿法替尼在脑转移患者中的活性获得了确认;该组的中位PFS和TTSP分别为10.1和13.7个月(图1)。
图1: 根据治疗线、表现状态、突变类型和是否存在脑转移,阿法替尼在现实实践中的中位PFS和
GIDEON:来自德国的现实证据
前瞻性非干预性GIDEON研究在德国调查了一线阿法替尼当在常规临床实践中使用时的疗效和耐受性。GIDEON招募了很高比例的年龄在≥ 70岁的患者,因此提供了研究阿法替尼在老年个体中现实使用的机会。12个月时的PFS构成主要终点,而PFS、总生存期(OS)、ORR和DCR是次要结果。总体而言,151名患者接受了治疗,其中67名(44 %)患者≥ 70岁。在这些老年患者中,22 %在入选时具有脑转移,18 %存在罕见突变。 Brückl等人报告了该研究第一次中期分析中包括的老年患者的事后分析的结果[5]。这些发现支持阿法替尼在老年人中的使用,因为结果甚至优于在整个研究人群中获得的结果。12个月的PFS率达到62 %(整个人群的12个月PFS,54.6 %),中位PFS为17.3个月(相比于12.9个月)。ORR和DCR分别为78 %和93 %(分别相比于73 %和 90 %)。 此外,阿法替尼在老年患者中的安全性特征与在年轻患者中的结果相当。在≥ 70岁和< 70岁的患者中,≥ 3级治疗急性AE相似,最常出现腹泻。老年患者中的起始剂量有较低的趋势,其中在62 %的情况下使用40 mg作为起始治疗,而年轻队列为83 %,但需要剂量减少的患者百分比似乎在不同年龄组之间相当(55 %与58 %)。
奥希替尼(osimertinib)的一线结果
评价第三代不可逆EGFR TKI奥希替尼的一线治疗的AURA研究的两个I期扩展队列在局部晚期或转移性EGFR突变NSCLC患者中产生了强效的ORR和延长的PFS [6]。30名患者的顺序患者队列各自接受80 mg/天或160 mg/天奥希替尼直至进展。Yang等人在2019年ELCC大会上介绍了这些扩展队列的最终疗效和安全性数据[7]。 80 mg奥希替尼显示出持久的临床活性和可控的耐受性。对于80 mg和160 mg队列,确认的ORR分别为67 %和87 %。中位缓解持续时间分别为19.3和16.7个月,中位PFS分别为22.1和19.3个月。80 mg奥希替尼的安全性特征与先前的报道一致。促使剂量减少的AE总体在35 %的患者中发生,并且在160 mg队列中比在80 mg队列中更常见(53 %与17 %)。共有12 %的患者由于AE中止治疗。研究人员得出结论认为,最终结果支持使用奥希替尼作为EGFR突变NSCLC患者的一线治疗。80 mg剂量被确认是最佳的,因此作为推荐剂量。
EGFR TKI失败后四种药物的活性
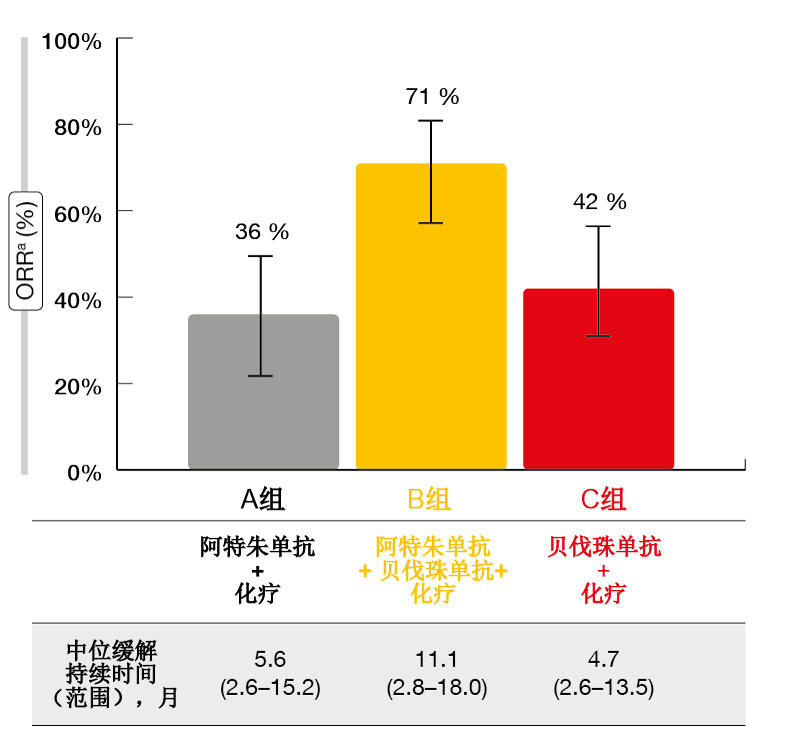
在一线EGFR TKI失败后存在迫切的未满足的需求,因为这些患者治疗选择有限。潜在途径是在化疗以外伴随使用抗血管生成剂和免疫疗法。随机化三组IMpower150试验评估了抗PD-L1抗体阿特朱单抗(atezolizumab)、卡铂(carboplatin)/紫杉醇(paclitaxel)和抗VEGF抗体贝伐珠单抗(bevacizumab)的组合(B组)与阿特朱单抗加化疗(A组)和化疗加贝伐珠单抗(C组)的比较。IMpower150在所有参与者都具有IV期或复发性转移性非鳞状NSCLC的人群(n = 1,202)中进行,并且B组的PFS和OS相比于C组均显示显著获益[8,9]。 该研究包括经历过对至少一种批准的靶向药物治疗进展或不耐受的EGFR突变患者(n = 124)。其中,分别有45、34和45人在A组、B组和C组中进行治疗。在2019年ELCC大会上,Reck等人介绍了EGFR阳性患者中疗效结果的探索性分析[10]。该分析表明,阿特朱单抗、卡铂、紫杉醇和贝伐珠单抗四种药物的组合改善了EGFR突变组的临床结果。B组相比于C组经历了延长的PFS(10.2与6.9个月),OS也是如此(中位OS,未达到与18.7个月)。在贝伐珠单抗和化疗之外添加阿特朱单抗在EGFR阳性患者的所有亚组中均增加了PFS和OS获益。此外,B组患者在ORR(71 %与A组和C组分别为36 %和42 %;图2)和缓解持续时间(11.1个月与分别5.6和4.7个月)方面表现最佳。相比之下,A组和C组之间的比较并未在PFS或OS方面产生任何显著差异。 在EGFR阳性患者中观察到的安全性特征与在ITT群体中观察到的相当,在免疫相关AE方面也是如此。与A组和C组相比,B组的治疗相关AE的发生率略高。根据这些结果,阿特朱单抗、贝伐珠单抗和铂类化疗的组合可能代表着EGFR TKI治疗失败的EGFR突变肺癌患者的潜在新选择。
图2: 与其他治疗组相比,使用阿特朱单抗加贝伐珠单抗和化疗的缓解率和缓解持续时间翻倍
耐药性机制
PD-L1不仅负性调节T细胞功能,还导致NSCLC条件下对EGFR TKI的获得性耐药。Zhang等人评价了PD-L1在对EGFR TKI治疗的原发性耐药中的机制作用[11]。基于体外研究和异种移植小鼠模型,研究人员发现PD-L1导致对吉非替尼的原发性耐药。PD-L1的过表达减弱对吉非替尼的体内敏感性。总之,似乎PD-L1助长了EGFR突变NSCLC中对EGFR TKI的原发性耐药,这可能通过诱导上皮-间充质转化而介导。该数据表明,PD-L1靶向免疫疗法是在原发性耐药情况下恢复对EGFR TKI治疗敏感性的大有前景的策略。 安罗替尼(anlotinib)是一种新型的多靶点受体TKI,其显示出抑制肿瘤血管生成和生长的活性。对EGFR TKI难治的晚期NSCLC患者的子集对安罗替尼治疗敏感。Lian等人使用不同类型的肺癌细胞系和异种移植模型阐明了这种效应背后的机制[12]。他们发现FGFR1助长获得性耐药,而安罗替尼通过抑制FGFR1信号通路抑制增殖、凋亡和细胞周期。因此,FGFR1可能是EGFR突变NSCLC和获得性耐药患者中的潜在治疗靶点。
对第三代治疗的耐药性
Fassunke等人提供了对第三代EGFR TKI治疗的获得性耐药机制的新见 解[13]。研究人员分析了对早代EGFR TKI治疗产生了T790M耐药性并接受了第三代TKI治疗的124名患者的治疗前和治疗后样品。有可能介导对第三代药物的先天性和获得性耐药的其他遗传异常的发生率很高。在75 %的样品中发现了共同出现的异常。其中TP53突变最为常见,但对第三代TKI治疗没有影响。 在对第三代EGFR TKI具有获得性耐药的样品中,遗传变化出现在EGFR基因(例如,T790M丢失、获得C797S)和其他基因(例如,MET扩增、KRAS突变)中。MET扩增显示出与初始治疗失败的强关联,因此是先天性耐药的最强因素。T790M丢失和MET扩增代表第三代TKI治疗后最常见的异常。第三代TKI治疗后新发EGFR耐药性突变为G724S。作者指出,使用第二代EGFR酪氨酸激酶抑制剂有可能克服由G724S引起的获得性耐药。
参考文献
- Sequist LV et al., Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2012; 31(27): 3327-3334
- Wu YL et al., Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol 2014; 15(2): 213-222
- Park K et al., Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol 2016; 17(5): 577-589
- Passaro A et al., Afatinib in EGFR TKI-naïve patients with locally advanced/metastatic NSCLC harbouring EGFR mutations: an interim analysis of a phase IIIB trial. ELCC 2019, abstract 1150
- Brückl WM et al., Elderly patients treated with afatinib in clinical practice – results from the prospective non-interventional study GIDEON. ELCC 2019, abstract 125P
- Ramalingam SS et al., Osimertinib as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer. J Clin Oncol 2018; 36(9): 841-849
- Yang JCH et al., Osimertinib as first-line (1L) treatment for epidermal growth factor receptor (EGFR) mutation-positive advanced non-small cell lung cancer (NSCLC): final efficacy and safety results from two phase I expansion cohorts. ELCC 2019, abstract 122P
- Reck M et al., Primary PFS and safety analyses of a randomised phase III study of carboplatin + paclitaxel ± bevacizumab, with or without atezolizumab in 1L non-squamous metastatic NSCLC (IMpower150). ESMO 2017, LBA1_PR
- https://www.roche.com/media/releases/med-cor-2018-03-26.htm
- Reck M et al., IMpower150: an exploratory analysis of efficacy outcomes in patients with EGFR mutations. ELCC 2019, abstract 1040
- Zhang Y et al., PD-L1 confers primary resistance to EGFR TKI in EGFR mutant non-small cell lung cancer via inducing EMT phenotype. ELCC 2019, abstract 138P
- Lian Z et al., Anlotinib can overcome acquired resistance to EGFR-TKIs via FGFR1 signaling in non-small cell lung cancer. ELCC 2019, abstract 129P
- Fassunke J et al., New insights into acquired resistance mechanisms to third-generation EGFR tyrosine kinase inhibitor therapy in lung cancer. ELCC 2019, abstract 132P
More posts
“当需要快速缓解时,化疗必不可少”
在过去几年中,由于引入了诸如靶向药物等新药物和免疫疗法,肺癌患者的治疗得到了极大改善。然而,所有数据都显示这些治疗并不适用于所有患者。因此,我们仍然需要化疗。例如,在多线治疗后发生多重耐药时,化疗对于诱导具有驱动突变患者的全身反应可能必不可少。
广泛期小细胞肿瘤:活性信号
大多数小细胞肺癌(SCLC)患者在广泛期(ED-SCLC)得以诊断。它们通常对一线铂类化疗反应良好;然而,反应并不持久,且预后较差。在二线及以后,NCCN指南建议患者参与临床试验,取决于患者的表现状态和无复发间隔持续时间的全身治疗,或姑息症状管理。 目前没有可用的维持治疗来延长一线化疗获得的效果。CheckMate 451试验设计用于评估这种条件下的免疫疗法。
提高肺癌筛查的准确性
毫无疑问,戒烟是初级预防的目标,但是一旦发现患者吸烟或曾经吸烟,应尽可能进行早期检测。目前经验证的用于此目的的平台之一是低剂量计算机断层扫描。然而,我们的目标是在该平台之外添加分子生物标志物以提高特异性甚至灵敏度。存在来自不同身体隔室的一系列大有前景的生物标志物。
NTRK-、ROS1-和ALK-阳性肺癌中令人鼓舞的发现
NTRK-、ROS1-和ALK-阳性肺癌中令人鼓舞的发现 TRK抑制:拉罗替尼(larotrectinib) 神经营养受体酪氨酸激酶(NTRK)基因融合发生在包括诸如婴儿纤 ...
免疫疗法:分析阐明度伐鲁单抗和派姆单抗活性
III期随机化双盲国际PACIFIC试验在根治性铂类同步放化疗后未经历进展的III期无法切除NSCLC患者中确立了度伐鲁单抗治疗。在放化疗后6周内, 将患者随机分配为每2周(Q2W) 10 mg/kg 度伐鲁单抗达最多12个月 (n = 476)或匹配安慰剂(n = 237)。
对于EGFR靶向治疗的当前观点
基于III期LUX-Lung 3和6试验,第二代不可逆ErbB家族阻断剂阿法替尼已被确定为EGFR突变NSCLC患者的一线标准选择,该试验显示出与铂双药化疗相比显著的无进展生存期(PFS)和客观缓解率(ORR)改善。此外,IIb期LUX-Lung 7研究显示,与第一代EGFR酪氨酸激酶抑制剂(TKI)吉非替尼(gefitinib)相比,阿法替尼在PFS、ORR和至治疗失败时间方面有显著获益。