免疫チェックポイント阻害療法:効果の増大および耐性の克服
POSEIDON試験:デュルバルマブ併用療法へのトレメリムマブの追加
第Ⅲ相国際共同オープンラベルランダム化比較POSEIDON試験では転移性NSCLC患者を対象に、一次治療としての抗PD-1抗体薬のデュルバルマブと化学療法の併用療法と、同併用療法に抗CTLA-4抗体のトレメリムマブを追加する併用療法を比較評価している。 19か国の153施設で、IV期の扁平上皮NSCLC患者と非扁平上皮NSCLC患者の1,013人を3群にランダムに割り付けた。被験治療1のD+CT群には、デュルバルマブ1,500 mg+試験担当医師が選んだ3週間間隔の化学療法を4コース行い、その後は病勢が進行するまでデュルバルマブ1,500 mgの4週間間隔投与+ペメトレキセドを投与した(n=338)。被験治療2のD+T+CT群には、デュルバルマブ+トレメリムマブ75 mg+3週間間隔の化学療法を4コース行い、その後は病勢が進行するまでデュルバルマブの4週間間隔投与+トレメリムマブ(16週目のみ)+ペメトレキセドを投与した(n=338)。一方、対照治療のCT群には、3週間間隔のプラチナ製剤ベースの化学療法を最大6コース行い、その後ペメトレキセドを投与した(n=337)。Johnsonらが同試験の成績をWCLC 2021で発表した[1]。
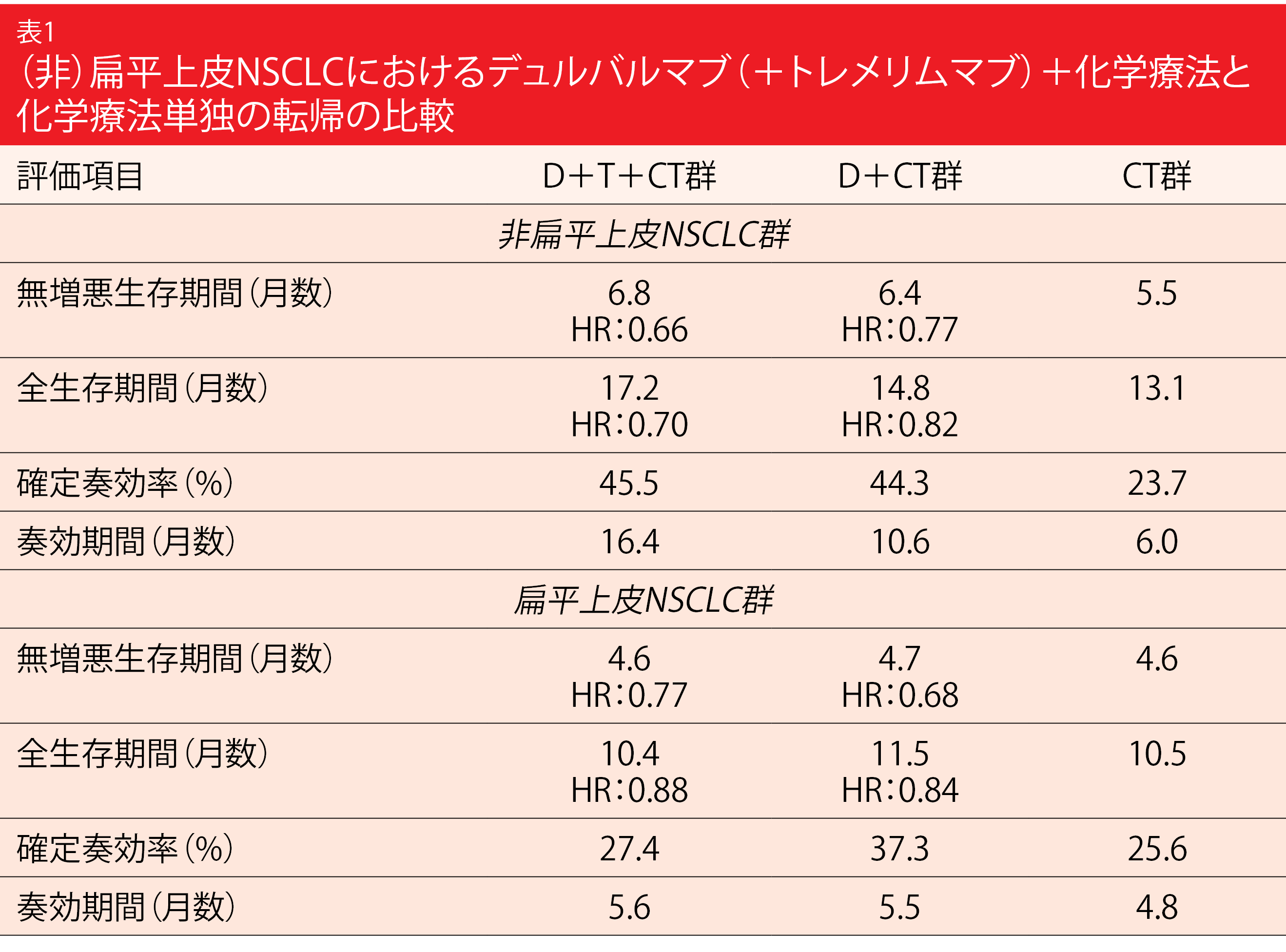
D+CT群の主要評価項目はCT群と比較した無増悪生存期間(PFS)および全生存期間(OS)である。PFSに関しては予想通りD+CT群にCT群を統計的有意に上回る延長効果があり(D+CT群は5.5か月、CT群は4.8か月、HR:0.74、p=0.00093)、OSについてもD+CT群に良好な結果がみられた(同13.3か月、同11.7か月、HR:0.86、p=0.07581)。主要な副次評価項目を解析したところ、CT群と比較したD+T+CT群のPFS(D+T+CT群は6.2か月、CT群は4.8か月、HR:0.72、p=0.00031)とOS(同14.0か月、同11.7か月、HR:0.77、p=0.00304)の双方に統計的有意性と臨床的意義のある改善が認められた。非扁平上皮NSCLC群には扁平上皮NSCLC群よりも、D+T+CTの効果がよりはっきりみられた(表1)。非扁平上皮NSCLC群でCTを受けた患者に対するD+T+CTを受けた患者のPFSとOSのハザード比は、それぞれ0.66と0.70になり、扁平上皮NSCLC群ではこれが0.77と0.88になった。
安全性プロファイルは3群でほぼ同様な内容だった。デュルバルマブ+化学療法にトレメリムマブを追加したことが、投与中止率を統計的有意に上昇させることはなかった(D+T+CT群は15.5%、D+CT群は14.1%)。デュルバルマブ+トレメリムマブ+化学療法は転移性NSCLC患者にとって新たな一次治療の選択肢になりうると、著者らは結論の中でこう述べた。
セミプリマブ+化学療法:EMPOWER-Lung 3試験
抗PD-1抗体のセミプリマブはEMPOWER-Lung 1試験の成績をもとに、PD-L1の発現率が50%以上の進行NSCLC患者への一次治療の単独療法として承認を受けている[2]。第Ⅲ相二重盲検ランダム化比較EMPOWER-Lung 3試験で評価した、セミプリマブ350 mg+3週間間隔のプラチナダブレット化学療法4コースに関する2回目の中間解析結果を、GogishviliらがESMO 2021で報告した[3]。進行NSCLCの非扁平上皮がん患者と同扁平上皮がん患者を、被験群(n=312)もしくは化学療法にプラセボを併用する対照群(n=154)にランダムに割り付け、両群とも最長で108週目または病勢が進行するまで治療を続けた。なお、PD-L1の発現率を問わずに患者を組み入れている。
化学療法にセミプリマブを追加したことでOS(被験群は21.9か月、対照群は13.0か月、HR:0.71、p=0.014)、PFS(同8.2か月、同5.0か月、HR:0.56、p<0.0001)、奏効率(ORR:同43.3%、同22.7%、オッズ比:2.68、p<0.0001)に臨床的意義があり、統計的有意性もある改善がみられた。完全奏効に達したのは被験群が2.6%になったのに対して対照群は0%になり、奏効期間の中央値は前者が15.6か月、後者が7.3か月だった。
被験群のベネフィット・リスクプロファイルは許容できる内容で、治療関連AE(TRAE)による投与中止率(被験群は3%、対照群は1%)は低く、グレードを問わず免疫関連AE(irAE)が発現したのは19%だった。安全性プロファイルについては、セミプリマブやプラチナ製剤ベースの化学療法の既知のプロファイルとほぼ同じ内容だった。全体的な健康状態と生活の質が臨床的意義のある低下をするまでの期間(HR:0.78)と、疼痛症状が現れるまでの期間の延長(HR:0.39)が患者報告アウトカムから見て取れた。また、どちらともベースライン時と比較しておおむね改善していた。組織型とPD-L1の発現率にかかわらず、セミプリマブ+プラチナダブレット化学療法は、標的にする遺伝子変異のない進行NSCLC患者への一次治療の新しい選択肢になると、著者らは報告の中で語った。
脳転移のある患者へのNIVO+Ipi併用に関する事後解析
NSCLC患者の10%が脳転移の診断を受け、予後不良の原因につながることが多い[4、5]。進行NSCLCも含めた複数のがん種で、ニボルマブとイピリムマブの併用投与がCNS病変のある患者に期待できる効果を示している[6~9]。第Ⅲ相ランダム化比較CheckMate 9LA試験でⅣ期のNSCLC患者や再発性NSCLC患者への一次治療として、ニボルマブ360 mgの3週間間隔投与とイピリムマブ1 mg/kgの6週間間隔投与に化学療法2サイクルを行う併用療法と、化学療法4サイクルに任意でペメトレキセドの維持療法を行う単独療法を比較評価している。2年間の追跡調査結果によると、化学療法に追加した併用投与群に化学療法単独群を上回るしっかりとした生存期間の延長効果を現し、全生存率は併用投与群が38%、単独投与群が26%になった[10]。
脳転移のある患者は初回投与までに十分な治療を受けて、無症状の状態が2週間以上続いていれば、試験への参加を許可した。被験治療の併用投与群にはこの患者が51人、対照治療の単独群には50人いたが、前者の310人、後者の308人にはベースライン時に脳転移は起きていなかった。2年以上の追跡調査後に、脳転移を認めた患者とそうでない患者から得たデータに行った事後解析の成績を、CarboneらがWCLC 2021で報告した[11]。
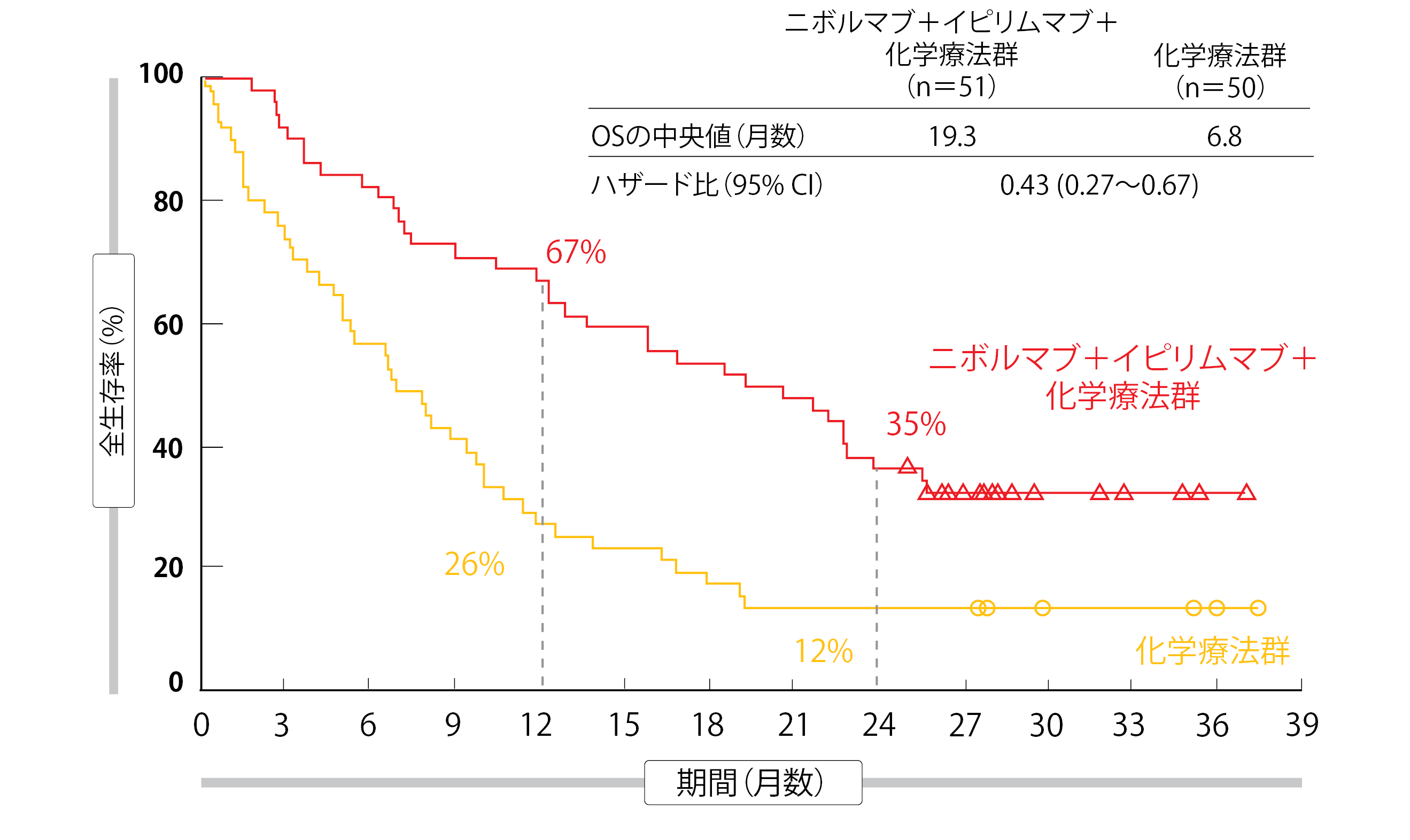
この解析結果からは、ベースライン時の脳転移の有無を問わず、化学療法単独群に比べて、化学療法にニボルマブとイピリムマブを追加した併用投与群に統計的有意な生存期間の延長効果が見て取れた。脳転移のある患者(併用投与群のOSの中央値は19.3か月、単独群は6.8か月、HR:0.43、図1)の場合、そうでない患者(同15.6か月、同12.1か月、HR:0.79)に比べて死亡率が顕著に減少し、全身奏効についても同様で、両群のHRはそれぞれ0.40と0.74だった。併用投与群のORRは脳転移のある患者群で43%、ない患者群で37%になり、奏効期間の中央値はそれぞれ15.5か月と13.0か月になった。
脳転移のある患者群への併用投与はPFS(併用投与群は13.5か月、単独群群は4.6か月、HR:0.36)、ORR(同39%、同20%)、奏効期間(同22.3か月、同18.9か月)の点で頭蓋内奏効が得られたことを示し、全身奏効と一致していた。頭蓋内完全奏効を得たのはそれぞれ10%と8%になっている。新たに脳転移が生じた患者数は、ベースライン時に脳転移のあった患者群(併用投与群は16%、単独群は30%)でもなかった患者群(同2%、同4%)でも併用投与群で少なくなっていた。ベースライン時に脳転移のあった患者群の、新たな脳転移発生までの期間の中央値は併用投与群で9.0か月、単独群で4.6か月だった。化学療法へのニボルマブとイピリムマブの併用は、脳転移のある患者も含めて進行NSCLC患者への効果の高い一次治療の選択肢になることを、今回のデータがさらに裏付けたと著者らは報告の中で述べた。
図1:CheckMate 9LA試験:ベースライン時に脳転移のあった患者を対象にしたニボルマブ+イピリムマブ+化学療法と化学療法単独の全生存期間・率の比較
ATEZO-BRAIN試験
ベイズ流アプローチによる第Ⅱ相単群ATEZO-BRAIN試験は、未治療の脳転移があるⅣ期の非扁平上皮NSCLC患者へのアテゾリズマブの有効性と安全性を評価することを目的にしている。一次治療としての化学療法と免疫療法の併用療法を評価する臨床試験で、未治療の脳転移がある患者が対象になる機会
が非常に限られているため、同試験の対象になった。カルボプラチン(5 AUC)、ペメトレキセド500 mg/m2、アテゾリズマブ1,200 mgの3週間間隔投与を4~6コース患者に投与し、その後、ペメトレキセドとアテゾリズマブを最長で2年に渡って3週間おきに投与した。1日に 4 mg以下なら抗けいれん薬とデキサメタゾンの投与を許可した。主要評価項目は安全性とPFSの両方である。
副腎皮質ステロイド剤を投与されている患者も含めて、アテゾリズマブ+カルボプラチン+ペメトレキセドの安全性プロファイルは良好だった[12]。12週間後のPFSが60%、グレード3と4のAE発現率が27.5%ということで、有効性があり、毒性も許容できるレベルであったため同試験は終了となった。治療関連AEに関してはグレード1と2のものが大半を占め、致死的なAEは発現しなかった。グレード4の治療関連AE(血小板減少症、好中球減少症、幻覚)が3人に現れたが、AE全体では疲労(全グレードで60%)と貧血(45%)が発現率の上位を占めた。特に発現率が高かった免疫関連AEは発疹(20%)とトランスアミナーゼ値上昇(13%)になり、1人にグレード3の間質性肺炎が生じた(3%)。
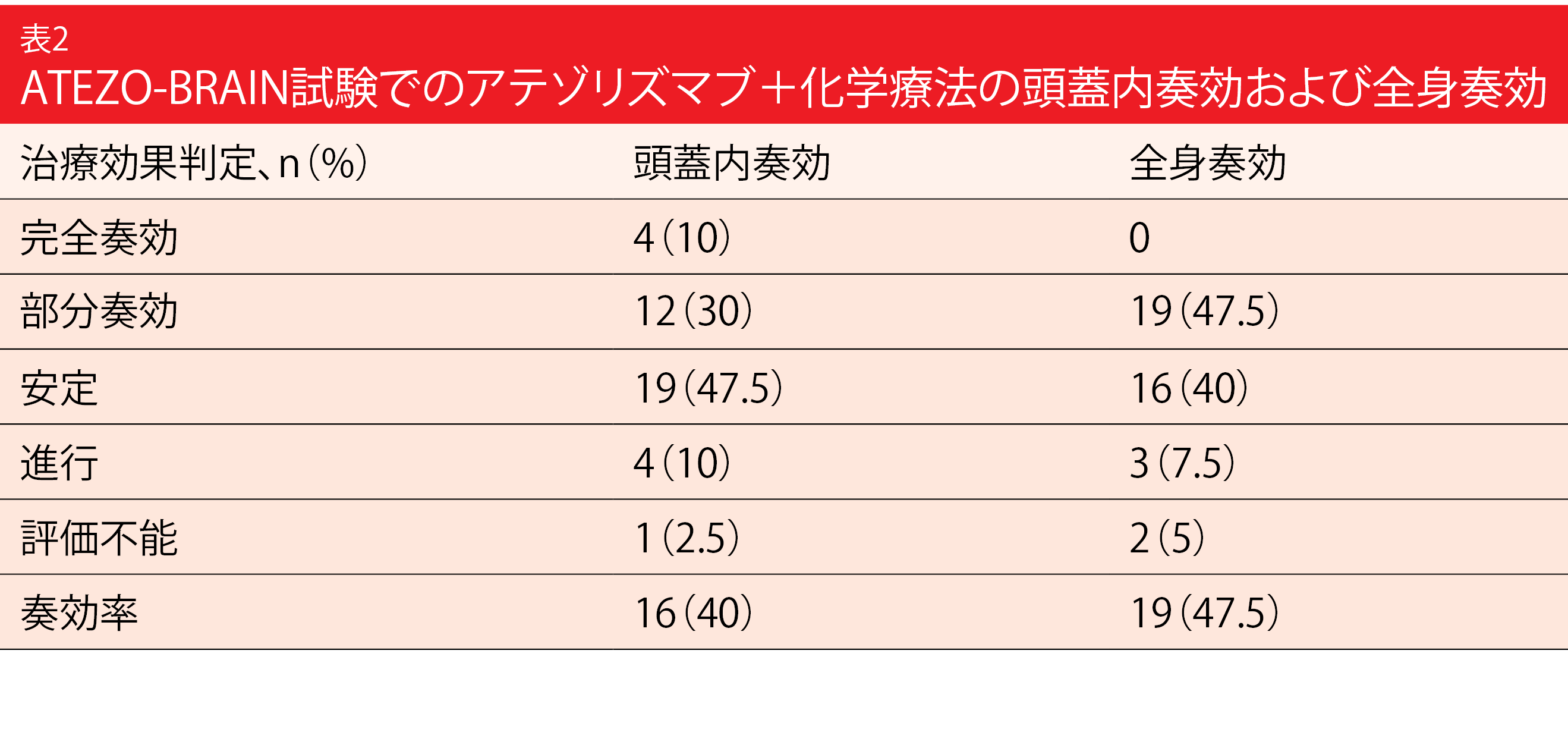
全身のPFSの中央値は8.9か月で、18か月後でも患者の24.9%にこの状態が続いていた。頭蓋内PFSの中央値は6.9か月で、KEYNOTE-189試験に参加した脳転移のある患者にみられたPFSとほぼ同じだった[13]。全身奏効と頭蓋内奏効も大半が一致しており(表2)、40%が頭蓋内奏効に、47.5%が全身奏効に達し、OSの中央値は13.6か月となり、2年生存率は32%にのぼった。頭部の画像所見と血液検体との相関性試験を現在行っている。
MRTX-500試験:シトラバチニブ+ニボルマブの併用
免疫チェックポイント阻害薬の登場によってNSCLCの治療法に変化が訪れたが、がん微小環境が免疫を抑制することなど耐性獲得に様々なメカニズムが関わっていることが多く、抗PD-(L)1抗体薬に対する難治性や抵抗性のがんへの治療の選択肢は限られている。ニボルマブにチロシンキナーゼ阻害薬のシトラバチニブを併用すると、抗腫瘍免疫応答が増強し、患者へのベネフィットがより長くなるという仮説を立てた。シトラバチニブはTAM受容体ファミリーのTYRO3、AXL、MERTKをターゲットにするだけでなく、中でも、骨髄由来抑制細胞を減らして抗腫瘍免疫応答を増強させることが示されているVEGFR2とKITもターゲットにしている[14]。第Ⅱ相オープンラベル単群MRTX-500試験では非扁平上皮進行NSCLCで、抗PD-(L)1抗体薬が有効だった(完全奏効、部分奏効、安定のいずれかが12週間以上持続)患者を対象に、シトラバチニブ120 mgの1日1回投与とニボルマブの併用投与について調査した。免疫チェックポイント阻害薬は直近の治療ラインで投与していることを条件にした。
シトラバチニブ+ニボルマブを二次治療または三次治療で使用した場合の有効性および安全性について、LealらがESMO 2021で最新成績を報告している[15]。この解析の対象集団は68人で、主要評価項目のORRは18%になり、そのうち3%が完全奏効に達した。病勢コントロール率は78%で、奏効期間の中央値は12.8か月、PFSの中央値は5.7か月、OSの中央値は14.9か月となり、24か月後のOSは32%にのぼった。
治療関連AEのうち発現率の上位に入ったのは下痢(全グレードで62%)、疲労(52%)、悪心(44%)だった。一方、免疫関連AEではこれが甲状腺機能低下症、下痢、トランスアミナーゼ値上昇、TSH値上昇、斑状丘疹状皮疹、膵炎となった。なお、グレード5のAEは発現していない。治療関連AEによる投与中止率は22%になったが、このうちの81%に、AEの発現がもとでシトラバチニブの投与を1回以上やめることになった。この成績を受けて、現在進行中の第Ⅲ相オープンラベルランダム化比較SAPPHIRE試験では、免疫チェックポイント阻害薬による治療中もしくは治療後に病勢が進行した進行NSCLC患者を対象に、二次治療や三次治療でのシトラバチニブ+ニボルマブ併用投与の有効性と安全性をドセタキセルと比較している。
シトラバチニブへの併用薬のチスレリズマブ
抗PD-1抗体であるチスレリズマブは、マクロファージ上のFcγ受容体への結合を最小限に抑えるように設計しており、その結果、T細胞クリアランのメカニズムや抗PD-1療法への耐性獲得にかかわる抗体依存性細胞貪食を無効にしている[16、17]。シトラバチニブとチスレリズマブの併用にそれぞれの抗腫瘍作用を上回る効果があるのかを調べるため、複数の種類の固形がんで調査を進めている。第Ib相多施設共同オープンラベル非ランダム化試験では、シトラバチニブ120 mgの1日1回投与とチスレリズマブ200 mgの3週間間隔投与を併用する療法を評価した。扁平上皮NSCLC患者と非扁平上皮NSCLC患者で、これまでに1~3ラインの治療を受けた患者を抗PD-(L)抗体薬の使用歴を問わずに組 み入れたA、B、Fの各コホート(n=75)から得た成績を、Zhouらが発表した[18]。なお、PD-L1の発現率がどのレベルでも組み入れることにした。
免疫チェックポイント阻害薬の使用歴にかかわらず、併用療法に有効性のあることが見受けられた。全体のORRは16.9%で、再発・難治性患者コホートに比べて抗PD-(L)1抗体療法を受けたことのない患者の方が、ORRが高くなった(抗PD-(L)1抗体未治療コホートは22.2%、再発・難治性コホートは13.6%)。
PFSとOSも同様に、抗PD-(L)1抗体薬の治療歴がある患者(PFSは5.2か月、OSは10.1か月)よりも治療歴のない患者で期間は延びていた(PFSは7.0か月、OSは15.3か月)。コホート全体のPFSの中央値は5.5か月、OSの中央値は11.9か月となり、病勢コントロール率は84.5%に達した。併用投与群の安全性プロファイルは治療可能な内容で、過去の報告と一致していた。グレード3以上の試験薬投与後に発現したAEと治療関連AEで最も多かったのは高血圧だったが、投与中止に至ることはなかった。
この成績とは別に、難治性や抗PD-(L)1抗体薬に抵抗性のある、扁平上皮NSCLC患者と非扁平上皮NSCLC患者の47人で構成するコホートAおよびコホートFに関する解析データを、Gaoらが報告している[19]。両コホートの病勢コントロール率は86.4%で、奏効期間の中央値は6.9か月だった。シトラバチニブ+チスレリズマブの併用投与はこの試験で今後に期待できるような抗腫瘍作用を示し、抗PD-(L)1抗体療法後に再発したり、同療法に抵抗性を示したりした転移性NSCLC患者への新たな治療の選択肢になりうる証拠だと、著者らは述べた。今後の調査が待たれるところだ。
RATIONALE 304試験・同307試験での喫煙状況別の成績
RATIONALE 304試験では、非扁平上皮進行NSCLC患者への一次治療でチスレリズマブ+化学療法を併用した群のPFSが、化学療法単独群のそれを上回る結果となった[20]。ESMO 2021でLuらが発表したサブグループ解析の結果によると、喫煙者(全体の63.8%)への併用投与の有効性と安全性は患者集団全体にみられたものと一致していた[21]。両群のうち喫煙者のPFSの中央値は併用群が9.7か月、単独群が4.6か月(HR:0.466)となり、非喫煙者のPFSの中央値と大差はなかった(同8.5か月、同7.7か月、HR:1.075)。化学療法にチスレリズマブを追加したことは、喫煙状況にかかわらずORRに延長効果をもたらした。
扁平上皮進行NSCLC患者にチスレリズマブと化学療法を一次治療として併用した場合の効果を評価したRATIONALE 307試験でも、同304試験のようにサブグループ解析を行ったが、そこでも喫煙状況にかかわらずPFSとORRに同様の延長効果が認められている[22]。同307試験で行った一時解析から、化学療法単独に比べてPFSに統計的有意な延長効果があり、安全性プロファイルも治療可能な内容であることが判明した[23]。この試験の対象者の83.7%は喫煙者である。喫煙群のPFSの中央値は併用群(パクリタキセルまたはnab-パクリタキセル+カルボプラチン)が7.6か月であるのに対して、単独群は5.5か月である。非喫煙群でもチスレリズマブの追加がPFSの延長に寄与しており、HRは併用群が0.475、単独群が0.119で、ORRに関しては喫煙状況を問わず併用群で高くなっていた。どちらの試験でも喫煙群と非喫煙群での安全性プロファイルは、患者全体に認められたものと一致していた。
STK11/KRASの両遺伝子変異:予後予測因子の重要性
次世代シーケンシングで検出したSTK11とKRASの両遺伝子変異の同時発現および免疫関連有害事象(irAE)の発現率が、免疫チェックポイント阻害薬の治療を受ける患者の予後予測因子になりうるのか、Basherらがその解明に取り組んだ[24]。フロリダの医療機関3施設から総勢703人分のⅢB期とIV期のNSCLC患者のデータを収集して、後ろ向きにデータを解析した。
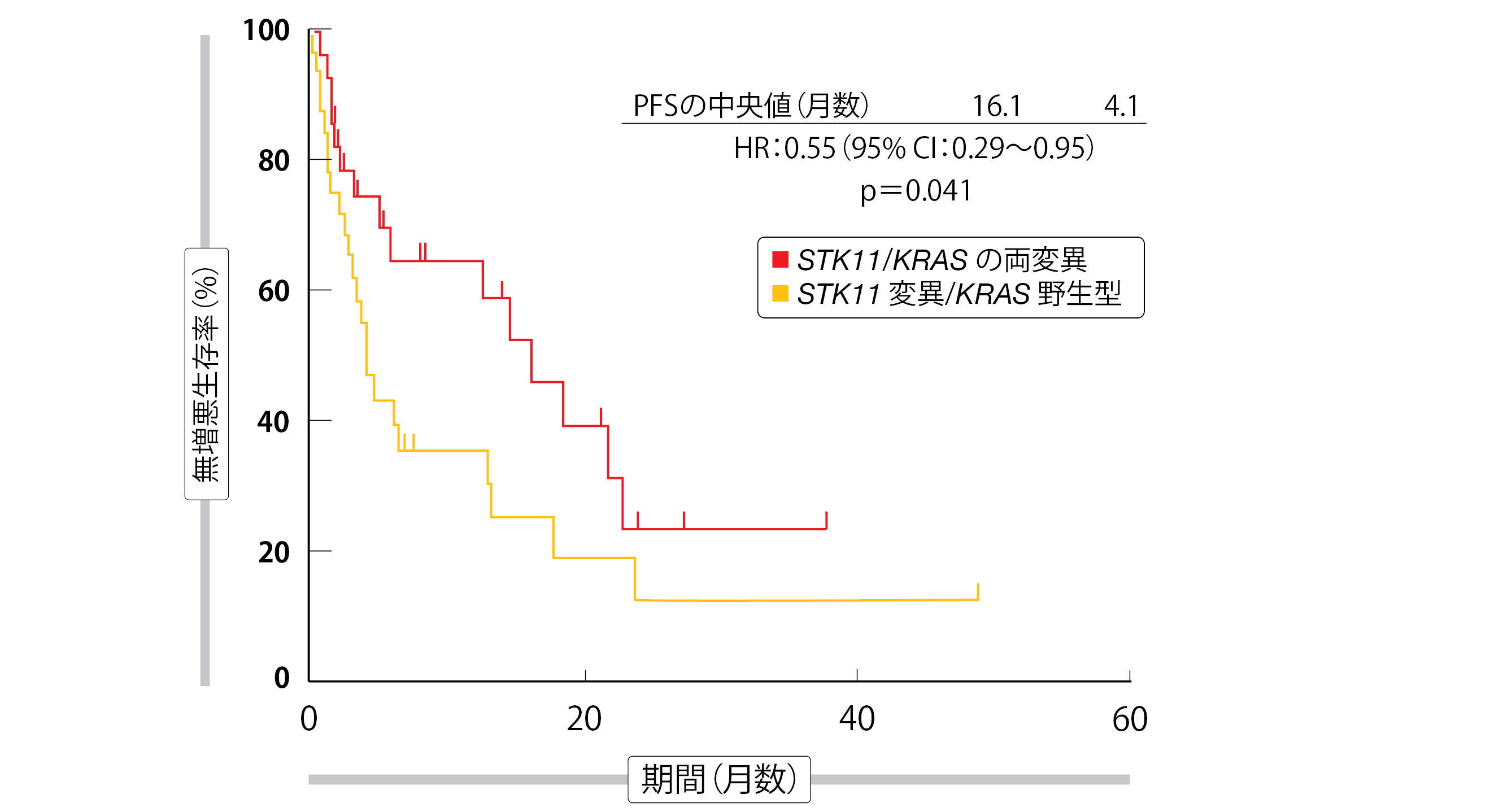
STK11とKRASの両遺伝子変異が同時に存在していると、双方が野生型の場合よりも、PFSが統計的有意に改善していた(両遺伝子変異群は16.1か月、野生型群は4.1か月、HR:0.55、p=0.041、図2)。OSについても両遺伝子変異群で有利になる傾向がみられた(同32.3か月、同21.8か月、HR:0.61、p=0.21)。
irAEの発現は治療がOSにもたらす延長効果の予測因子になっており、このAEが生じた患者のOSの中央値が46.3か月になったのに対して、これが生じなかった患者では29.7か月となった(HR:0.59、p=0.022)。白人患者に比べてヒスパニック系患者でirAEの発現率が高くなったが、生存率や生存期間の延長に関係していなかった。さらに研究を行えば今回の解析対象集団に固有の予後予測因子が判明するかもしれない。
図2:STK11/KRASの両遺伝子変異が発現している患者に免疫チェックポイント阻害薬がもたらした統計的有意なPFSの延長効果
参考文献:
- Johnson ML et al., Durvalumab ± tremelimumab + chemotherapy as first-line treatment for mNSCLC: results from the phase 3 POSEIDON study. WCLC 2021, PL02.01
- Sezer A et al., Cemiplimab monotherapy for first-line treatment of advanced non-small-cell lung cancer with PD-L1 of at least 50%: a multicentre, open-label, global, phase 3, randomised, controlled trial. Lancet 2021; 397(10274): 592-604
- Gogishvili M et al., EMPOWER-Lung 3: cemiplimab in combination with platinum-doublet chemotherapy for first-line treatment of advanced non-small cell lung cancer. ESMO 2021, LBA51
- Waqar NS et al., Non-small-cell lung cancer with brain metastasis at presentation. Clin Lung Cancer 2018; 19(4): e373-e379
- Sperduto PW et al., Estimating survival in patients with lung cancer and brain metastases: an update of the graded prognostic assessment for lung cancer using molecular markers (Lung-molGPA). JAMA Oncol 2017; 3(6): 827-831
- Di Giacomo AM et al., Immunotherapy of brain metastases: breaking a “dogma”. J Exp Clin Cancer Res 2019; 38(1): 419
- Tawbi HA et al., Combined nivolumab and ipilimumab in melanoma metastatic to the brain. N Engl J Med 2018; 379(8): 722-730
- Emamekhoo H et al., Safety and efficacy of nivolumab plus ipilimumab (NIVO+IPI) in patients with advanced renal cell carcinoma (aRCC) with brain metastases: Interim analysis of CheckMate 920. J Clin Oncol 37, 2019 (suppl; abstr 4517)
- Borghaei H et al., Nivolumab + ipilimumab as first-line treatment for patients with advanced non-small cell lung cancer with brain metastases: results from Checkmate 227. Cancer Research 2020; 80(Suppl. 16): Abstract CT221
- Reck M et al., First-line nivolumab plus ipilimumab plus two cycles of chemotherapy versus chemo alone (4 cycles) in patients with advanced non-small cell lung cancer: Two-year update from CheckMate 9LA. J Clin Oncol 39, 2021 (suppl 15; abstr 9000)
- Carbone DP et al., First-line nivolumab + ipilimumab + chemotherapy in patients with advanced NSCLC and brain metastases: results from CheckMate 9LA. WCLC 2021, OA09.01
- Nadal E et al., ATEZO-BRAIN (GECP 17/05): non-randomized phase II clinical trial of atezolizumab combined with carboplatin plus pemetrexed in chemotherapy-naïve patients with advanced non-squamous NSCLC with untreated brain metastases. WCLC 2021, OA09.02
- Garassino MC et al., Outcomes among patients with metastatic nonsquamous NSCLC with liver metastases or brain metastases treated with pembrolizumab plus pemetrexed-platinum: Results from the KEYNOTE-189 study. AACR Annual Meeting 2019, CT043
- Du W et al., Sitravatinib potentiates immune checkpoint blockade in refractory cancer model. JCI Insight 2018; 3: e124184
- Leal TA et al., MRTX-500: phase 2 trial of sitravatinib + nivolumab in patients with nonsquamous non-small-cell lung cancer progressing on or after prior checkpoint inhibitor therapy. ESMO 2021, 1191O
- Qin S et al., RATIONALE 301 study: tislelizumab versus sorafenib as first-line treatment for unresectable hepatocellular carcinoma. Future Oncol 2019; 15: 1811-1822
- Zhang T et al., The binding of an anti-PD-1 antibody to FcγRΙ has a profound impact on its biological functions. Cancer Immunol Immunother 2018; 67(7): 1079-1090
- Zhou Q et al., Sitravatinib + tislelizumab in patients with metastatic non-small cell lung cancer. ESMO 2021, 1280P
- Gao B et al., Sitravatinib + tislelizumab in patients with anti-PD-(L)1 refractory/resistant metastatic non-small cell lung cancer. ESMO 2021, 1284P
- Lu S et al., Tislelizumab plus chemotherapy as first-line treatment for locally advanced or metastatic nonsquamous NSCLC (RATIONALE 304): a randomized phase 3 trial. J Thorac Oncol 2021; 16(9): 1512-1522
- Lu S et al., RATIONALE 304: tislelizumab plus chemotherapy vs chemotherapy alone as first-line treatment for non-squamous non-small cell lung cancer in patients who are smokers vs non-smokers. ESMO 2021, 1290P
- Yu X et al., RATIONALE 307: tislelizumab plus chemotherapy vs chemotherapy alone as first-line treatment for advanced squamous non-small cell lung cancer in patients who were smokers vs non-smokers. ESMO 2021, 1297P
- Wang J et al., Tislelizumab plus chemotherapy vs chemotherapy alone as first-line treatment for advanced squamous non-small-cell lung cancer: a phase 3 randomized clinical trial. JAMA Oncol 2021; 7(5): 709-717
- Basher F et al., Prognostic value of STK11 & KRAS mutations and irAE incidence in response to immunotherapy in Hispanics: a multicenter analysis. WCLC 2021, MA01.07
© 2021 Springer-Verlag GmbH, Impressum
More posts
ATALANTE-1試験:がん免疫療法が不成功に終わった後の抗がんワクチン使用
OSE-2101は、HLA-A2+拘束性修飾ネオエピトープを利用した抗がんワクチンで、肺がんで発現率の高い腫瘍関連抗原のCEA、p53、HER2、MAGE-2、MAGE-3を標的にしている[1]。 HLA-A2は血清で測定するが、患者の半数ほどが陽性を示す。プラチナ製剤ベースの化学療法と免疫チェックポイント阻害薬の併用療法もしくは逐次療法が失敗した、HLA-A2陽性の進行NSCLC患者と同じく転移性NSCLC患者を対象に、第Ⅲ相ランダム化比較ATALANTE-1試験でOSE-2101を評価した。
徐々に進展する中皮腫および胸腺腫の 治療管理法
切除できない悪性胸膜中皮腫への画期的な治療法の中では、どれが一番期待できるとお考えですか。 大変重要性の高い分野ですが、これまでに大きな進展は見られていません。そんな中、ランダム化比較試験のCheckMate-743試験でニボルマブとイピリムマブの併用療法を化学療法 と比較した最新成績を、Peters教授らがESMO 2021で発表しています。
悪性胸膜中皮腫:全治療ラインで行う免疫チェックポイント阻害薬をベースにした治療法
第Ⅲ相ランダム化比較CheckMate 743試験では、切除不能な悪性胸膜中皮腫(MPM)患者に対する一次治療として、ニボルマブ3 mg/kgの隔週投与+イピリムマブ1 mg/kgの6週間間隔投与を最長で2年間続ける療法を、シスプラチンまたはカルボプラチン+ペメトレキセドの3週間間隔投与を6コース行う療法と比較して評価した。
小細胞肺がん:有効性と忍容性改善への道のり
プラチナ製剤ベースの化学療法の実施中やその後に病勢が進行した小細胞肺がん(SCLC)患者には、発がん性転写因子を選択的に阻害するルルビネクテジン3.2 mg/m2の3週間おきの投与が米国で承認を受けている。 そこで、化学療法を1ライン受けた後に再発したSCLC患者307人を対象に、ルルビネクテジン 2 mg/m2とドキソルビシン40 mg/m2を3週間間隔で最大10コース併用投与し、次いでルルビネクテジン3.2 mg/m2を3週間間隔で単独投与した場合の有効性と安全性を第Ⅲ相ランダム化比較ATLANTIS試験で調査した。
免疫チェックポイント阻害療法:効果の増大および耐性の克服
第Ⅲ相国際共同オープンラベルランダム化比較POSEIDON試験では転移性NSCLC患者を対象に、一次治療としての抗PD-1抗体薬のデュルバルマブと化学療法の併用療法と、同併用療法に抗CTLA-4抗体のトレメリムマブを追加する併用療法を比較評価している。 19か国の153施設で、IV期の扁平上皮NSCLC患者と非扁平上皮NSCLC患者の1,013人を3群にランダムに割り付けた。
多岐にわたる遺伝子変異をターゲットにする新規治療薬や既存の治療薬
HER2変異は非扁平上皮NSCLCに顕著なドライバー遺伝子変異のおよそ3%を占める。 NSCLCを適応症に承認を受けたHER2阻害薬はいまだ限ら れているものの、抗HER2抗体薬物複合体のトラスツズマブデルクステカン(T-DXd)が別のがん種のHER2遺伝子変異陽性例に適応する薬剤として、複数の国で承認されている。