多种实体瘤中的新型组合方法
乐伐替尼(lenvatinib)加派姆单抗
抗血管生成多激酶抑制剂乐伐替尼已显示出发挥免疫调节作用,增强抗PD-1抗体的抗肿瘤活性[1]。 在早期条件下,乐伐替尼加派姆单抗在不同肿瘤类型的患者中引起部分缓解[2]。正在进行的II期LEAP-005研究正在六种类型的经治疗晚期实体瘤中评估最多35个周期的乐伐替尼每日口服20 mg加派姆单抗200 mg Q3W。这些实体瘤包括三阴性乳腺癌(TNBC)、卵巢癌、胃癌、大肠癌(CRC)、胆道癌(BTC)和多形性胶质母细胞瘤(GBM)。ORR以及安全性和耐受性构成研究的主要目标。
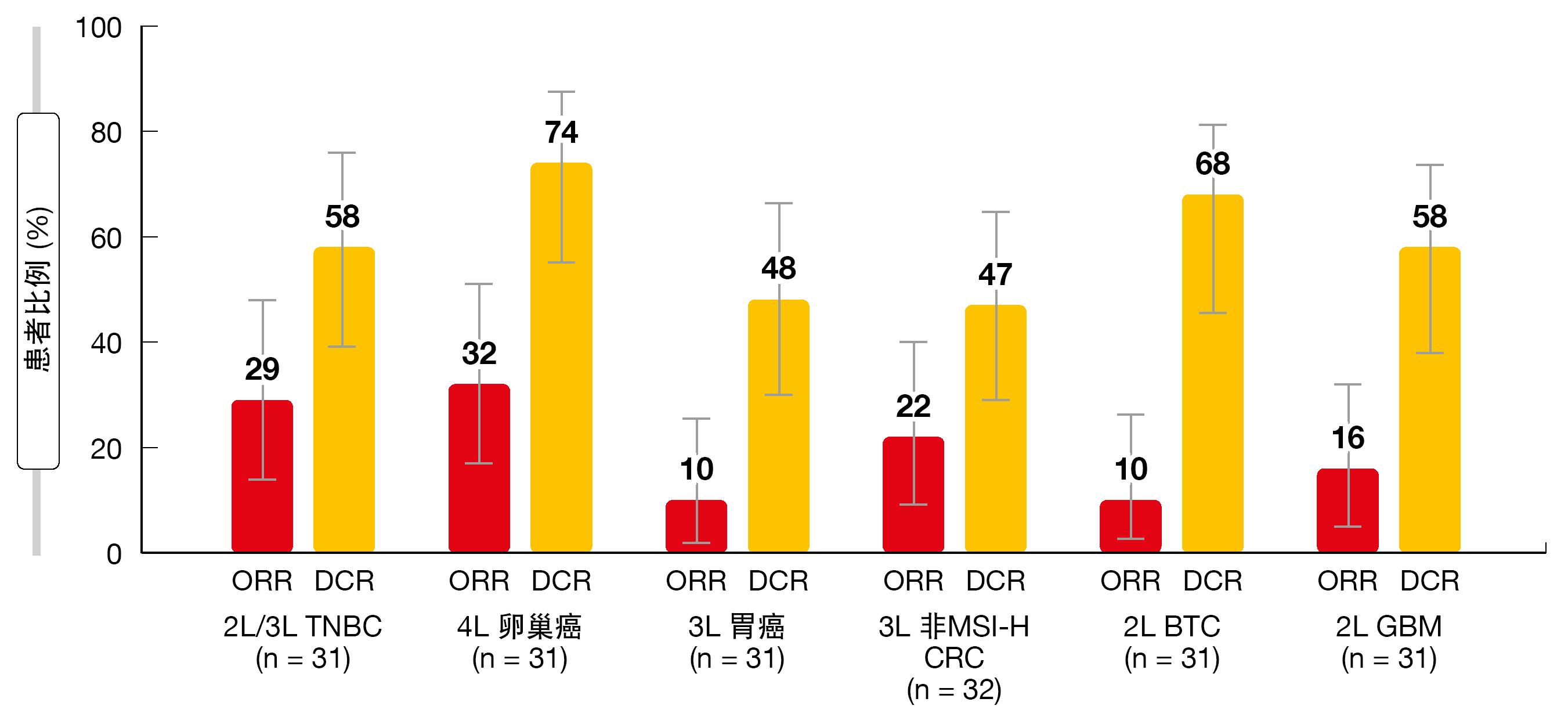
Lwin等人在2020年ESMO大会上报告了在平均随访8.6个月后,LEAP-005中招募的首批187名患者的中期结果[3]。对于评估的每种肿瘤类型,分析中包括31名患者,但CRC队列例外,其包括32名患者。值得注意的是,在该群组中,肿瘤属于非高度MSI/错配修复完整类别。TNBC患者接受二线或三线治疗,卵巢癌患者接受四线治疗,胃癌和CRC患者接受三线治疗,而BTC和GBM患者接受二线治疗。实质性疾病控制
实质性疾病控制
针对队列扩展预设的无效用标准已达成,甚至被超过(图)。关于女性癌症,TNBC和卵巢癌患者的ORR分别为29.0%和32.3%。疾病控制率分别达到58.1%和74.2%。就胃肠道癌而言,CRC群组的ORR最高(21.9%)。患有胃癌和BTC的患者均获得9.7%的ORR。DCR分别为46.9%,48.4%和67.7%。GBM患者的缓解率为16.1%,疾病控制率达到58.1%。BTC和GBM队列的中位缓解持续时间分别为5.3和3.2个月,其他队列尚未获得中位缓解持续时间。
BTC(中位PFS为6.1个月)、卵巢癌(4.4个月)和TNBC(4.2个月)队列的中位PFS最长。对于其他类型的肿瘤,PFS介于2.3与2.8个月之间。TNBC和卵巢癌患者的6个月PFS率分别为48.9%和47.1%。对于胃癌、CRC和BTC,6个月PFS率分别为22.2%,30.5%和56.5%。在GBM队列中,有11.5%的患者在6个月时无进展。
在所有队列中,毒性均可控。每个队列中约有一半的患者出现3至5级的治疗相关AE,不过3至5级AE导致的终止率较低,仅为6%至13%。除BTC队列外,其他各群组均发生一例致命性AE。高血压通常是最常见的AE,另外还报告了疲劳、腹泻、食欲下降、甲状腺功能减退和恶心。
免疫介导的所有等级AE的发生率在26%至48%之间,而3至5级事件的发生率为3%至6%。在TNBC、卵巢癌和BTC队列中,各有一名患者出现了输液反应。总体而言,安全特性与先前使用派姆单抗加乐伐替尼的组合所观察到的一致。LEAP-005将继续在各100名患者的扩展队列中评估乐伐替尼加派姆单抗在先前接受过治疗的晚期实体瘤患者中的疗效和安全性。
图: LEAP-005试验中纳入的所有队列的客观缓解率(ORR)和疾病控制率(DCR)
PD-1/PD-L1协同作用:替雷利珠单抗和BGB-A333
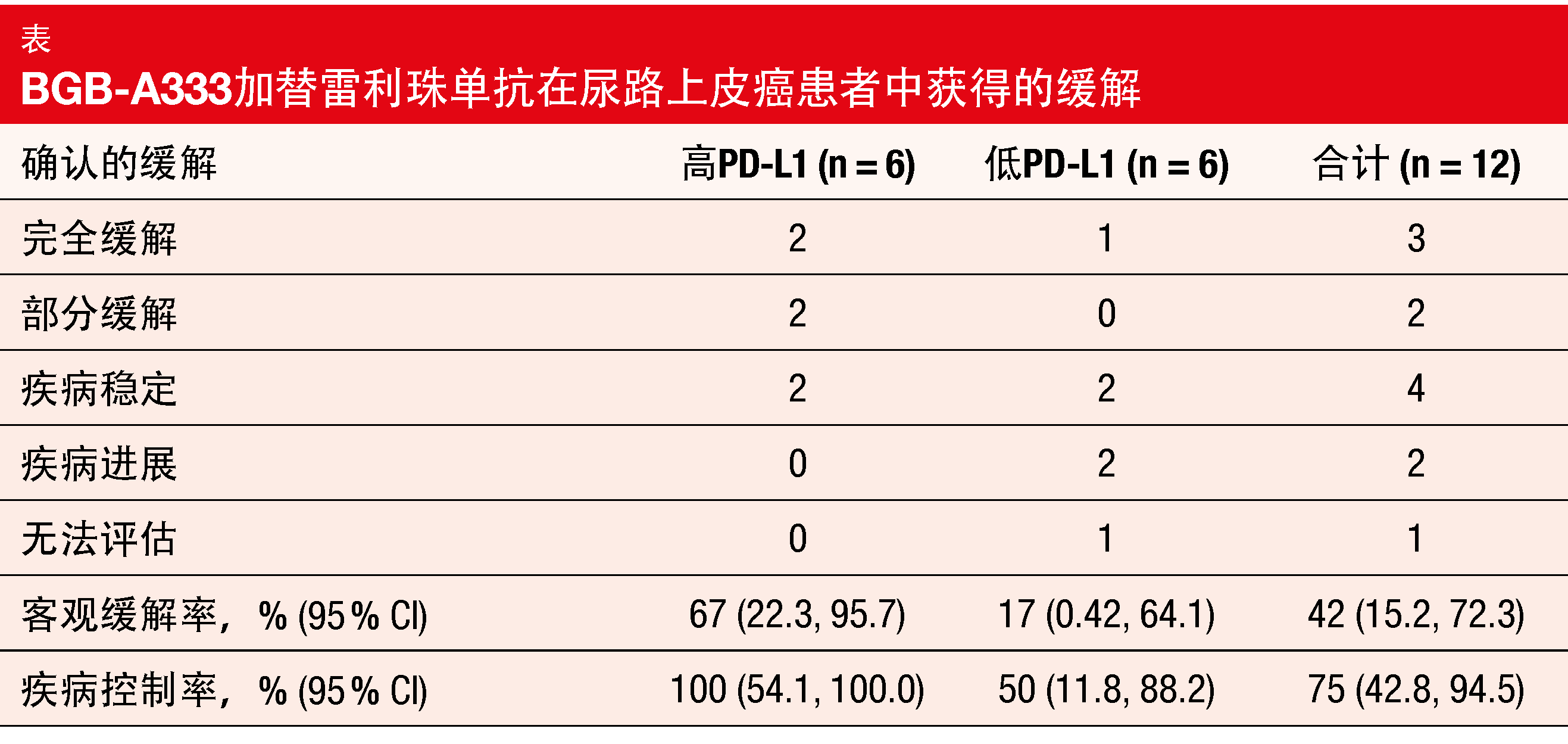
一直以来都有假设同时阻断PD-1和PD-L1来提供协同抗肿瘤作用[4]。一项开放标签的I/IIB期临床试验评估了PD-1抑制剂替雷利珠单抗(目前正在III期条件下测试)与研究性抗PD-L1抗体BGB-A333的组合[ 5]。在15名患者中进行的研究的剂量递增部分期间,BGB-A333的II期推荐剂量为静脉注射1.350 mg Q3W。随后是剂量扩展阶段IIB部分,该阶段涉及12名局部晚期或转移性尿路上皮癌患者,这些患者在至少一种含铂方案治疗后发生进展。他们接受了替雷利珠单抗200 mg加BGB-A333 1.350 mg Q3W。经过10个月的中位随访后,在ESMO 2020上介绍了该组合所获得的结果。各有六名患者属于高PD-L1和低PD-L1类别。四人患有仅限于淋巴结的疾病。
中位治疗持续时间为6.2个月。总体而言,有42%的患者缓解(表)。高PD-L1肿瘤群组的ORR(67%)高于低PD-L1肿瘤群组的ORR(17%)。但是,鉴于样本量较小,应谨慎解释这些差异。缓解持久并且持续的中位时间为9.1个月。总队列中的中位PFS达6.1个月, 高PD-L1肿瘤患者的表现再次好于低PD-L1肿瘤患者(分别为10.0和4.1个月)。
替雷利珠单抗加BGB-A333总体耐受性良好,大多数AE表现为轻度或中度严重程度。在整个研究中,疲劳构成了最常报告的治疗相关AE。没有发生致命事件。IIB期有2名患者经历了4起免疫相关AE,包括3级内分泌失调、3级垂体炎、2级肌肉骨骼和结缔组织疾病以及2级肌炎。作者在其结论中指出,这些数据为将替雷利珠单抗与抗PD-L1抗体治疗相结合提供了见解。
帕米帕利加替莫唑胺:生物标志物分析
患有不同的局部晚期或转移性实体瘤的患者参与了正在进行的IB期BGB-290-103研究,该研究正在评估研究性PARP抑制剂帕米帕利与低剂量给药的烷化剂替莫唑胺的组合。剂量递增和剂量扩展阶段总结招募114名患者。其中大多数都经过了大量的预治疗,平均有3条先前的治疗线。第1至第28天60 mg帕米帕利和第1至第7天60 mg替莫唑胺被确定为II期推荐剂量。
在ESMO 2020上介绍了来自一项回顾性生物标志物分析的发现,该分析基于来自研究的两个阶段中纳入的患者的样品[6]。在基线获得的档案组织样品中进行了同源重组缺乏症(HRD)测试,并使用基因组不稳定性评分(GIS)进行表示,该评分根据大规模转变、端粒等位基因失衡和杂合性丢失而确定。GIS≥33的样品被定义为GIS阳性。在基线获得的血液样品中进行循环肿瘤DNA新一代测序,重点关注16个核心DNA损伤反应(DDR)基因,包括ATM、BRCA1、BRCA2、CDK12、PALB2和RAD51B。DDR阳性突变状态定义为这16个DDR基因之一中有≥1突变。研究人员试图在GIS/DDR状态与总体缓解/疾病控制率之间建立关联性。
GIS的强大结果
在34名经HRD分析的患者中,有32%为GIS阳性。无论BRCA1/2突变状态如何,这些阳性患者的ORR和DCR都比GIS阴性个体高。GIS阳性队列的ORR和DCR分别为81.8%和90.9%,而GIS阴性组的ORR和DCR分别为13.0%和56.5%。在评估了DDR状态的86名患者的队列中,有26%证明为DDR阳性。在这里,阳性患者的ORR也高于阴性队列(27.3%与14.1%),不过缓解的发生频率与GIS阳性队列相比要低得多,并且取决于BRCA1/2状态。多数缓解的DDR阳性患者都携带BRCA1/2突变,而不是BRCA1/2野生型。DDR阳性患者和DDR阴性患者的DCR相似。
正如作者所总结,作为对基因组不稳定性的总体衡量标准,GIS状态似乎是预测对帕米帕利加低剂量替莫唑胺的应答的强大生物标志。而且,该分析证实了以下观察:除BRCA1/2以外,DDR基因中的突变在预测对PARP抑制剂的响应中的效用有限。该研究的队列6目前正在评估帕米帕利加低剂量替莫唑胺在患有GIS阳性的NSCLC、头颈部肿瘤、食道肿瘤和软组织肉瘤肿瘤的患者中的抗肿瘤活性。
参考文献
- Kimura T et al., Immunomodulatory activity of lenvatinib contributes to antitumor activity in the Hepa1-6 hepatocellular carcinoma model. Cancer Sci 2018; 109(12): 3993-4002
- Taylor M et al., A phase 1b trial of lenvatinib plus pembrolizumab in patients with selected solid tumors. Ann Oncol 2016; 27(Suppl 6): 266-295
- Lwin Z et al., LEAP-005: phase 2 study of lenvatinib plus pembrolizumab in patients with previously treated advanced solid tumors. ESMO 2020, LBA41
- Naing A et al., Anti-PD-1 monoclonal antibody MEDI0680 in a phase I study of patients with advanced solid malignancies. Immunother Cancer 2019; 7(1): 225
- Martin-Liberal J et al., BGB-A333, an anti-PD-l1 monoclonal antibody, in combination with tislelizumab in patients with urothelial carcinoma. ESMO 2020, 535MO
- Stradella A et al., Clinical benefit in biomarker-positive patients with locally advanced or metastatic solid tumors treated with the PARP1/2 inhibitor pamiparib in combination with low-dose temozolomide. ESMO 2010, 530MO
© 2020 Springer-Verlag GmbH, Impressum
More posts
卵巢癌:将PARP抑制更进一步
根据NOVA试验的结果,尼拉帕利已被批准作为铂敏感性复发性卵巢癌(OC)患者的维持治疗。 NOVA中使用的起始剂量为每天口服300 mg。回顾性分析表明,基于基线体重和血小板计数的个性化起始剂量可能会改善尼拉帕利的安全特性,而不会影响疗效。该方法通过NORA研究在铂敏感性复发性OC的中国患者中进行了测试,这些患者具有高级别浆液性或高级别主要浆液性的组织学或有种系BRCA突变。
将创新从实验室带入临床实践
ESMO大会提供了胃食管癌方面令人惊喜的新数据,并介绍了世界各地不同作者的巨大贡献。 接受常规化疗治疗的晚期胃癌患者的中位总生存期不到一年。由于检查点抑制的添加,该生存期首次延长到超过一年。在主席研讨会III上报告了两个随机化研究,表明在向常规化疗中加入纳武单抗后,胃癌和胃食管连接部癌患者的预后有所改善。
胃癌和食管癌中PD-1抑制取得的里程碑式进展
胃癌、胃食管连接部(GEJ)腺癌和食道腺癌是全球范围内与癌症相关死亡的重要原因,并且在晚期被诊断出时其5年总生存率(OS)较差。对于晚期或转移性HER2阴性胃癌和GEJ癌,标准一线化疗的中位OS不到1年。 一些针对胃癌和GEJ癌的抗PD-(L)1单一疗法的临床研究得到了阴性结果。然而,在2017年的随机化、双盲、安慰剂对照的III期ATTRACTION-2试验中显示,在至少两条先前治疗线之后,纳武单抗改善胃癌和GEJ癌患者的生存率。
序言
2020年线上ESMO大会上讨论了在治疗实体瘤方面取得的显著进展,其中包括在胃食管肿瘤领域获得的引人注目的成果。对于患有转移性胃癌和食道癌的患者,长期结果仍然很差,并且最近几年进行的几项评估PD-(L)1抑制的临床试验显示出中等至阴性的结果。 但是,免疫检查点抑制在这些难于治疗的肿瘤中的治疗作用已于2020年9月显现,2020线上ESMO举行的主席研讨会完全专注于可能改变临床实践的在可手术疾病的转移条件以及辅助条件(首次)下的III期试验。