NTRK、ROS1、ALKの融合遺伝子陽性肺がんへの良好な成績が 判明
TRK阻害薬のラトロレクチニブ
神経栄養因子チロシンキナーゼ受容体(NTRK)融合遺伝子は、乳児型線維肉腫のようなまれながんだけではなく、悪性黒色腫や大腸がん、肺がんといった一般的ながんも含め、多種多様ながんに発現している[1]。肺がんでの発現率は0.2~3.3%と推測されている[1、2]。非常に選択性の高い、中枢神経系活性型の経口TRK阻害薬のラロトレクチニブは、成人および小児のNTRK融合遺伝子陽性の固形がんに対する治療薬として米食品医薬品局がすでに承認している。進行性の固形がん患者を対象にした第Ⅰ相試験および第Ⅱ相バスケット試験で、ラロトレクチニブの投与を受けたTRK融合遺伝子陽性肺がん患者11人の統合データを、Drilonらが発表した[3]。このうちの5人がこれまでに1種類または2種類の全身療法を受けており、別の5人は3種類以上の療法を受けていた。治療内容はラロトレクチニブ100 mgを1日2回に連日投与することである。 TRK融合遺伝子陽性進行肺が んへのラロトレクチニブの有効性が、 確かに解析結果から示された。7人の患者(71%)に奏効し、1人が完全奏効(CR)、4人が部分奏効(PR)と判定され、2人は安定(SD)と判定された。なお、進行と判定された患者はいなかった。解析を行った時点では、また奏 効期間の中央値は判明していなかった。また、ラロトレクチニブは頭蓋内病変にも効果を示した。部分奏効の判定を受けた女性患者の1人は、脳に複数あった病変が完全奏効に近い状態にな った。 肺がん以外の患者も含めた患者全体で、ラロトレクチニブの忍容性の高さが見られた。疲労、めまい、悪心が、発現率が最高レベルだったAEで、大半のAEのグレードは低かった。対象患者全員のうち用量の減量が必要になったのは9%以下で、投与中止になった患者は1%未満にとどまった。NSCLS患者にはTRK融合遺伝子を調べる遺伝子検査を日常的に行うことの妥当性を、統合データが証明した。
エヌトレクチニブによる臨床的に意義のある改善
極めて選択性の高い、中枢神経系活性型のもう1つの経口TRK阻害薬、エヌトレクチニブは、ROS1融合遺伝子そしてALK融合遺伝子もターゲットにしている。ALKA-372-001、STARTRK-1、 STARTRK-2の3試験で対象になった、NTRK融合遺伝子陽性固形がんで、TRK阻害薬を使ったことのない成 人患者の統合解析結果をPaz-Ares らが報告した[4]。ALKA-372-001とSTARTRK-1の両試験は第Ⅰ相用量漸増試験であるため、国際共同試験のSTARTRK-2の第Ⅱ相試験でエヌトレクチニブの600 mg/日投与を評価している。 この3試験に参加したNTRK融合遺伝子陽性のさまざまな固形がん患者54人のうち、肺がん患者は10人である。試験組み入れの段階で、この10人のうち6人に脳転移を認めた。6人のうち3人が1治療ラインの全身療法を受け、残る3人は2治療ライン以上を受けていた。 エヌトレクチニブにより全身および頭蓋内に、臨床的に意義のある、しっかりとした改善が認められた。独立評価委員会の盲検下(BIRC)での判定によると、NTRK融合遺伝子陽性固形がんの患者全体のORRは57.4%だった。NSCLC患者に限定するとORRは70.0%になり、奏効期間の中央値はまだ判明していなかった。患者1人がCR、6人がPR、1人がSDと判定され、PFSの中央値は14.9か月だった。ベースライン時に脳転移のあった患者の解析データによると頭蓋内奏効率は66.7%で、患者2人がCRの判定を受けた(表1) AEのグレードは主に1または2で、忍容性も高かった。最も発現率の高かったAEは味覚異常で47.1%に達し、次いで便秘、披露、下痢となった。ほとんどのAEは休薬も用量減量もせずにコントロールすることができ、投与中止に至ったのは4.4%のみだった。
ROS1融合遺伝子陽性がんへのエヌトレクチニブの作用
ROS1融合遺伝子陽性肺がんには、ALK/ROS1/MET阻害薬であるクリゾチニブが標準治療として確立している。クリゾチニブを投与したROS1融合遺伝子陽性NSCLC患者に初めて進行が見られる部位として最も多いのがCNSであることから、ここにアンメットニーズが生じている[5]。そのため、CNSに有効性を示すROS1阻害薬をファーストライン治療に用いることが望ましい。エヌトレクチニブはクリゾチニブに比べて、ROS1阻害作用の高いことが前臨床試験で示されている[6]。原発性脳腫瘍やCNSへの二次性転移を含めた複数の腫瘍の組織型に、エヌトレクチニブは臨床活性を表している[7]。 エヌトレクチニブについて評価す るALKA-372-001、STARTRK-1、 STARTRK-2の3試験には、ROS1阻害薬による治療を受けたことのないROS1融合遺伝子陽性NSCLC患者が53人参加した。このうち23人にはベースライン時にCNS病変が認められている。53人に関する統合解析からは、全身と頭蓋内へのエヌトレクチニブの臨床的に意義のある確かな有効性が示されている [8]。全身への効果とベースライン時に脳転移の有無とは関係していない。CNS病変のある患者の奏効率は73.9%、ない患者の奏効率は80%だった。奏効期間の中央値は前者が12.6か月、後者が24.6か月、PFSの中央値は前者が13.6か月、後者が26.3か月だった。CNS病変のない患者のうち3人がCRと判定された。独立評価委員会による頭蓋内病変への有効性の評価については、ベースライン時に脳転移を認めた20人のうちの55%に奏効しており、CRの判定を受けたのは20%、PRの判定を受けたのは35%だった。頭蓋内奏効期間の中央値は12.9か月になった。なお、OSの中央値はまだ判明していない。 安全性解析対象集団になったエヌトレクチニブの投与を受けた患者134人全員が、チロシンキナーゼ阻害薬による治療が未経験というわけではない。ROS1融合遺伝子陽性患者へのエヌトレクチニブの忍容性は良好で、休薬や用量減量することですんなりと回復する低グレードのAEが大半を占めた。治療関連AEで非常に多く見られたのは味覚異常、めまい、便秘だった。AEにより投与中止となったのはわずか4.5%である。
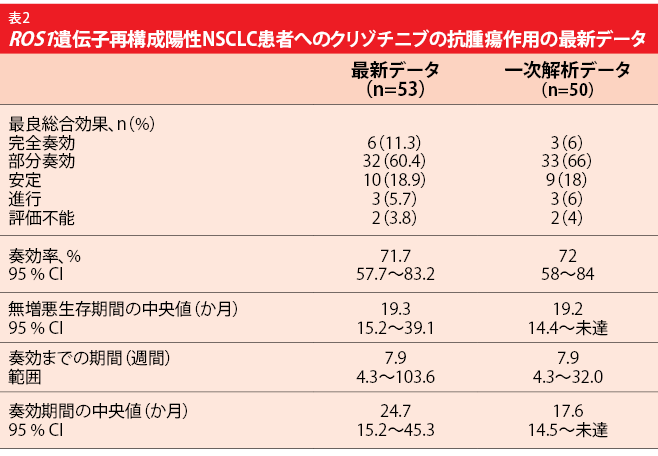
PROFILE 1001試験:OSの新たなベンチマーク
PROFILE 1001試験で対象になった、 ROS1遺伝子再構成陽性NSCLCの拡大コホートへのクリゾチニブの効果に関する最新結果を、Shawらが本会議で発表した[9]。追跡期間の中央値である16か月目を過ぎてから公表されたPROFILE 1001試験の一次解析からは、顕著な抗腫瘍作用が示された[10]。クリゾチニブ250 mgの1日2回投与によりORRは72%、奏効期間の中央値は17.6か月、PFSの中央値は19.2か月に達した。この時点ではOSの中央値はまだ判明していなかった。このデータを基に、多くの国でROS1遺伝子再構成陽性の進行NSCLCを適応症に承認を受 けた。 OSの追跡期間の中央値62.2か月を過ぎた時点の、合計で53人になる拡大コホートのOSの中央値は51.4か月となった。この53人の大部分は進行NSCLCの治療薬をこれまでに1種類以上は投与されている。1年後のOSは79%、4年後のOSは51%になった。ROS1遺伝子が融合する別の遺伝子ごとに生存率や生存期間が変化することはなかったものの、融合した遺伝子ごとの患者数が少なかったため、さらなる調査が求められる。最新のORRは一次解析結果と一致しており、最新のPFSも同様だった表2)。しかし、最新の奏効期間の中央値は24.7か月となっており、一次解析の中央値を上回っている。一次解析時よりもCRの判定を受けた患者の割合が大幅に増えたが、おそらく長期間の投与がその理由なのだろう。クリゾチニブを長期間投与しても安全性の問題は生じず、投与中止が必要になるような治療関連AEが起きた患者はいなかった。 ROS1遺伝子再構成陽性の進行NSCLC患者のOSの新たなベンチマークが、今回の解析結果から明らかになったと著者らは語った。生存率が大幅に改善したことを考えると、この種類のがんは慢性疾患と見なせる数少ないがんの1つなのかもしれない。この遺伝子変異がある肺がん患者にはクリゾチニブを用いる治療を続けられることも、今回のデータで裏付けられた。
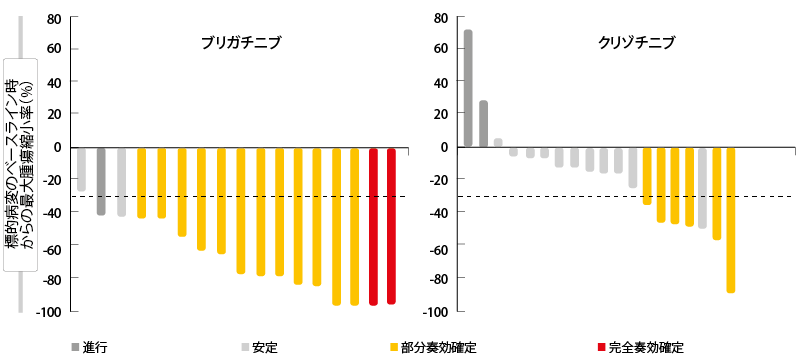
ALTA-1L試験の初回中間解析結果
第Ⅲ相ランダム化比較ALTA-1L試験では、ALK融合遺伝子陽性の進行NSCLCで、ALK阻害薬の使用経験がない患者を対象に、次世代のALK/ROS1阻害薬ブリガチニブを第一世代のTKIクリゾチニブと比較している。同試験には進行NSCLCに1治療ラインの全身療法を受けたことのある患者も組み入れている。7日間の導入期間はブリガチニブを90 mg/日投与し、その後は180 mg/日を投与した(n=137))。対照群の患者138人にはクリゾチニブ250 mgを1日2回投与している。Califanoらが、本会議で1回目の中間解析結果を発表した[11]。 主要評価項目であるPFSを独立評価委員会が盲検下(BIRC)で評価したところ、ブリガチニブ群に大幅な延長が見られた(ブリガチニブ群は判明せず、クリゾチニブ群は9.8か月、HR:0.49、p=0.0007)。1年後に増悪が認められなかったのはブリガチニブ群で67%、クリゾチニブ群で43%だった。サブグループ解析でも、すべてのサブグループでブリガチニブ群のPFSに同様の改善があることが示された。ORRについては、ブリガチニブ群がクリゾチニブ群の数値を上回り(前者は71%、後者は60%)、奏効期間の中央値は前者でまだ判明していないが、後者は11.1か月だった。 ベースライン時に測定可能な脳転移巣のあった患者で頭蓋内奏効を認めたのは、前者は78%、後者は29%である(OR: 10.42、p=0.0028)。ベースライン時に測定可能かどうかは問わず脳転移巣のあった患者で頭蓋内奏効を認めたのは、前者は67%、後者は17%だった(OR:13.00、p<0.0001)。ブリガチニブ群の患者は全員に測定可能なCNS病変の縮小を認めたが、クリゾチニブ群の患者にはこれが認められなかった(図)。 ITT解析対象集団(HR:0.42、p=0.0006)にも、測定可能かどうかは問わずベースライン時に脳転移のあった患者にも、頭蓋内病変のPFSに同様の改善が認められた(ブリガチニブ群は判明せず、ク リゾチニブ群は5.6か月、HR:0.27、 p<0.0001)。ベースライン時に脳転移のなかった患者の、頭蓋内病変のPFSは、まだ明らかになっていない。
図:ALTA-1L試験:測定可能な脳病変のある患者の頭蓋内奏効率
CNS病変の増悪が有意に遅延
全身性病変の増悪がない状態でCNS病変が初めて増悪するまでの期間と(CNS病変の増悪の原因別HR:0.30、 p<0.001)、CNS病変の増悪がない状態で全身性病変が初めて増悪するまでの期間(全身性病変の増悪の原因別HR:0.51、p<0.017)の競合リスクに関する解析結果によると、ブリガチニブ群に統計学的に有意な改善が見られた。つまり、クリゾチニブよりもブリガチニブが、CNSと全身の両病変の増悪を著しく遅らせたということになる。 クリゾチニブ群で発現頻度の高かったAEは主に消化器症状、高トランスアミナーゼ血症、徐脈、浮腫、視覚障害だったが、ブリガチニブ群では症状を伴わないCPK、リパーゼ、アミラーゼの上昇が主だった。試験実施計画書が定めた用量減量の原因は大半が検査値の異常だった。なお、膵炎はどちらの群にも認められていない。投与開始から2週間以内という早い段階で間質性肺炎/肺炎を発症するのは、 ALK TKIの中でもブリガチニブの特徴のようだが、これ以降の臨床試験での発症率に比べると発症はまれで、3%の低さだった[12]。ブリガチニブはALK融合遺伝子陽性NSCLCへのファーストライン治療として期待が持てることを、以上のデータが示した。
ブリガチニブの投与期間
2016年6月から世界的に始まったブリガチニブのアクセス強化プログラム(Expanded Access Program、EAP)には、試せる治療法がなくなったあるいは治験に参加できない、ALK融合遺伝子陽性の局所進行NSCLC患者または転移性NSCLC患者が参加した。2016年6月から2018年11月までの間に、西ヨーロッパ、アジア太平洋地域、南アフリカの21か国の患者604人がEAPに組み入れられ、すべての治療ラインでブリガチニブの投与を受けた。 本会議で報告のあった患者転帰の解析結果は、ALK遺伝子再構成のあるNSCLC患者へのブリガチニブの実際の有効性の評価が目的だった[13]。EAPでは臨床転帰の評価項目を設定していないので、TKIに関してはPFSと非常に相関性の高い治療開始から中止までの期間を、忍容性と治療の有効性の代替評価項目にした。 解析対象になった患者には、 1剤以上のALK TKIに耐性あるいは忍容性の問題がある。大部分の患者(67.2%)にブリガチニブをサードライン以降の治療で投与した。ブリガチニブの前に投与することの多かったALK TKIは、セリチニブ、クリゾチニブ、アレクチニブだった。異なる製剤を使用しているにもかかわらず、投与中止までの期間の中央値はすべての治療ラインでほぼ1年(10.95か月)となった。6か月間継続して使用している確率は67.1%、12か月間では48.6%だった。ALK TKIの製剤ごとに解析すると、アレクチニブの後(n=111、ブリガチニブの投与中止までの期間の中央値は8.72か月)とセリチニブの後(n=249、ブリガチニブの投与中止までの期間の中央値は10.33か月)にブリガチニブの継続使用が見られた。ロルラチニブの後にもブリガチニブを継続的に使用していて、ブリガチニブの投与中止までの期間の中央値は7.5か月だった。先に試したALK TKIが多いほど、ブリガチニブを続けて使用する確率も、ブリガチニブの投与中止までの期間の中央値も減少した。 投与中止になった患者は合計で260人だが、AEが原因で投与中止になったとの報告があったのはわずか4人 (0.7%)である。ブリガチニブの投与を中止した主な理由は治療効果の低さだった(9.6%)。すでに試しているALK阻害薬の種類にかかわらず、実臨床で見られたブリガチニブを用いた治療期間をもとにするとこの製剤には期待が持て、安全性プロファイルもコントロール可能なことが示された。
参考文献:
- Vaishnavi A et al., TRKing down an old oncogene in a new era of targeted therapy. Cancer Discov 2015; 5(1): 25-34
- Stransky N et al., The landscape of kinase fusions in cancer. Nat Commun 2014; 5: 4846
- Drilon A et al., Activity of larotrectinib in TRK fusion lung cancer. ELCC 2019, abstract 1110
- Paz-Ares L et al., Entrectinib in NTRK fusion-positive non-small cell lung cancer (NSCLC): integrated analysis of patients enrolled in STARTRK-2, STARTRK-1 and ALK-372-001. ELCC 2019, abstract 1130
- Patil T et al., The incidence of brain metastases in stage IV ROS1-rearranged non-small cell lung cancer and rate of central nervous system progression on crizotinib. J Thorac Oncol 2018; 13(11): 1717-1726
- Ardini E et al., Entrectinib, a Pan-TRK, ROS1, and ALK inhibitor with activity in multiple molecularly defined cancer indications. Mol Cancer Ther 2016; 15(4): 628-639
- Drilon A et al., Safety and antitumor activity of the multitargeted pan-TRK, ROS1, and ALK inhibitor entrectinib: combined results from two phase I trials (ALKA-372-001 and STARTRK-1). Cancer Discov 2017; 7(4): 400-409
- Barlesi F et al., Entrectinib in locally advanced or metastatic ROS1 fusion-positive non-small cell lung cancer (NSCLC): integrated analysis of STARTRK-2, STARTRK-1 and ALKA-372-001. ELCC 2019, abstract 1090
- Shaw AT et al., Crizotinib in advanced ROS1-rearranged non-small cell lung cancer (NSCLC): overall survival (OS) and updated safety from PROFILE 1001. ELCC 2019, abstract 1070
- Shaw AT et al., Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med 2014; 371(21): 1963-1971
- Califano R et al., Brigatinib vs crizotinib in the phase 3 ALTA-1L trial, ELCC 2019, abstract 1060
- Kim DW et al., Brigatinib in patients with crizotinib-refractory anaplastic lymphoma kinase-positive non-small-cell lung cancer: a randomized, multicenter phase II trial. J Clin Oncol 2017; 35(22): 2490-2498
- Lin HM et al., Treatment duration of brigatinib in patients enrolled in the international Expanded Access Program (EAP). ELCC 2019, abstract 1080
More posts
「迅速な効果を求める場合には化学療法が必要」
「迅速な効果を求める場合には化学療法が必要」 NSCLC治療に対する化学療法の相対的な重要性が変わりつつあるなか、新たな治療法という点で抗がん剤の効果をどのように高められる
進展型小細胞肺がん:免疫療法の効果のシグナル
進展型小細胞肺がん:免疫療法の効果のシグナル CheckMate 451試験:維持療法としての免疫療法 小細胞肺がん(SCLC)患者の大部分は進展型の段階で(ED-SCLC
肺がん検診の精度を高める
肺がん検診の精度を高める Nir Peled, MD PhD, The Legacy Heritage Oncology Center & Dr. Larry No
NTRK、ROS1、ALKの融合遺伝子陽性肺がんへの良好な成績が 判明
NTRK、ROS1、ALKの融合遺伝子陽性肺がんへの良好な成績が 判明 TRK阻害薬のラトロレクチニブ 神経栄養因子チロシンキナーゼ受容体(NTRK)融合遺伝子は、乳児型線
免疫療法:デュルバルマブおよびペムブロリズマブの作用が分析により明らかに
免疫療法:デュルバルマブおよびペムブロリズマブの作用が分析により明らかに PACIFIC試験:治療後に実施した免疫療法のOSへの影響 切除不能なⅢ期のNSCLC患者で、プラ
EGFR阻害薬への現在の評価
EGFR阻害薬への現在の評価 アファチニブを評価する国際共同第Ⅲb相試験 第二世代の不可逆的ErbBファミリー阻害薬であるアファチニブが、EGFR遺伝子変異陽性NSCLC患