EGFRおよび他の変異における液体生検
組織生検および再生検と比較して、液体生検では最少の侵襲性、腫瘍奏功をモニタリングするための経時的に連続測定が可能、X線検査に先立って血漿中の耐性変異の検出が可能という利点がある[1]。治療不全の重要な因子である腫瘍異質性の問題も考慮される。ドライバー遺伝子変異を高い感度と特異度で同定でき、それによりテーラーメイド医療の提供が改善される。標準化、新規技術の検証、組織分子プロファイルとの調和など議論の余地がある問題が残っているが、液体生検は進行したNSCLC患者の管理のための代替手段として位置づけられた。
血漿と組織の間の高い合致率
液体生検を新しい標準として検討するいくつかの解析の中の1つがWCLCで発表された。Mackらは、集団規模のゲノミクス、臨床的正確度、および臨床的有用性について、Guardant360パネルを評価した[2]。Gurdant360試験により、血中循環腫瘍DNA (ctDNA) にもとづく73の遺伝子中の重要なエクソンのデジタル配列決定が可能となる。コホートは、9202名をサンプリングし、ステージIII/IVの腺癌患者(4142名)およびNSCLC-NOS患者(4246名)の総計8388名からなる。最初の診断時からctDNA採取時は、中央値で177日間経過していた。組織の情報は、患者の一部で入手可能であった。解析は対象の薬剤を投与されている患者に重点が置かれたため、患者はランダム化および層別化されなかったことに留意すべきである。一般に、患者は第2選択療法またはそれ以降の療法で治療されていた。
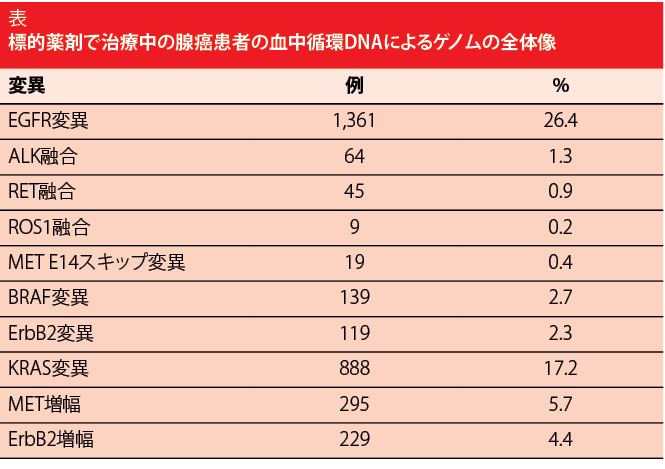
変異の総検出率は87%であり、1サンプル当たり中央値で3つの変異があった(レンジ0~93)。血漿中で検出された変異は、腫瘍の全系統に存在するトランケル変異にあてはまる組織で検出された変異と頻度および分布が類似していた。Guardant360によると、ctDNAの融合パターンは腫瘍組織を反映していた。腺癌の患者では、症例の26.4%にEGFR変異が認められた(表を参照)。エクソン19欠失は、EGFRドライバー変異 (52%) の多くを占めており、次にL858R変異 (34%) とエクソン20挿入 (4%) であった。
既に知られているように、ドライバー変異は、統計的に有意な程度に相互排他的である。例えば、EGFR変異が存在するときはKRAS変異は存在しない。逆の場合も同じである。変異が重複する場合、二次的耐性変異の出現による可能性がある。
バイオマーカ収率65%の増加
組織情報が入手可能であった543のマーカー陽性例において、臨床的正確性が測定された。このとき、陽性の予測値は、変異の種類に応じて92%~100%であった。KRAS、BRAFV600E、およびMET E14のスキップ変異陽性の血漿サンプルを有する患者のすべてで、腫瘍組織中にこれらの変異が認められた。ALK、RET、およびROS1の融合遺伝子については、92%は組織の検査結果は陽性を示さなかった。これらは、偽陰性の可能性が高い。ALK融合遺伝子の40%、EGFR陽性例の50%は、進行時に1つの有効な耐性標的を有していた可能性がある。全体として、ctDNA次世代シーケンシングによりバイオマーカの収率は65%高まるので、血漿分析によりさらなる恩恵が得られる。これは、有効なバイオマーカが252例追加されることに相当する。発癌ドライバーは、遺伝子型特定中の組織または評価不能の組織の29%で検出された。
Santosらもまた、ステージIVまたは再発腺癌の連続患者100名を対象にした液体生検の評価にGuardant360試験を用いた[3]。組織の分子プロファイルの結果は、液体生検の対応物との比較のため、各被験者から採取または回収された。治験責任医師らは、異常の種類に関する2つの方法は、EGFR変異については一致度が高いことを示した (68%)。この結果は、血中循環腫瘍DNA試験が腫瘍組織試験の数カ月後または数年後に実施された場合でも同じであった。診断および腫瘍生検の時点では液体生検は実施されなかった。
異常の同定率は、液体生検の方が組織生検よりも高かった。液体生検によりEGFR異常を示した患者の46%で実際の変異を有していた。EGFR変異を有する35名の患者のうち16名が、液体生検のみで同定された変異または多様体が示された。16名中5名において、有効なEGFR変異が液体生検のみを用いて同定された。
T790M変異の検出
TIGER-X第I相/第II相試験において、尿と血漿のEGFR変異試験の組み合わせが実施され、解析された[4]。TIGER-X試験では、EGFR-TKI既治療のEGFR変異陽性の患者548名が登録された。患者には臨床開発済みのEGFR-TKIロシレチニブが投与された。この試験では、540個の組織サンプル、482個の血漿サンプル、213個の尿サンプルが、治療前EGFR試験のために提供された。この分析には、174例の対応する組織サンプル、血漿サンプル、尿サンプルが含まれていた。
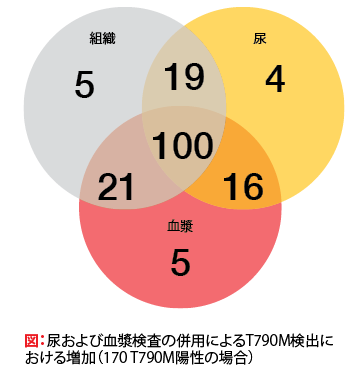
非侵襲性の尿および血漿のT790M検出は高感度であることが示された。血漿および尿の双方の試験で、感度は80%超であった。複合試験ではさらに感度は高く、96.6%であった。174例の対応サンプルでは、血漿検体および尿検体のいずれでもT790M陽性の同定率は97.7%であった。尿検査および血漿検査の組み合わせでは、組織検査単独の場合よりもT790M陽性の同定率が高かった。(図を参照)。T790M変異が液体生検で検出されたか、組織生検で検出されたかに関わらず、ロシレチニブ治療による奏効率は同等であった。
さらに分析の結果、T790M変異は、胸腔内のみに疾患 (M1a/M0) のある患者に比較して、胸腔外病変を有する (M1b) 患者の血漿からより容易に検出された。しかし、尿と血漿を組み合わせた試験では、病状にかかわらず高感度の検出が可能であった。M1a/M0およびM1b疾患の患者では、感度はそれぞれ90.7%と95.8%であった。著者らは、胸腔外転移を伴う患者を含めて、EGFR-TKI耐性NSCLC患者では、組織検査の前に尿と血漿の組み合わせ分析を検討すべきであると結論付けた。
図:尿および血漿検査の併用によるT790M検出における増加(170 T790M陽性の場合)
参考文献
- Burrell RA & Swanton C, Tumour heterogeneity and the evolution of polyclonal drug resistance.Mol Oncol 2014; 8(6): 1095-1111
- Mack PC et al., Clinical utility of circulating tumor DNA (ctDNA) analysis by digital next generation sequencing of over 5,000 advanced NSCLC patients.WCLC 2016, OA06.01
- Santos ES et al., Report on liquid biopsies from advanced lung adenocarcinoma patients and correlation with their tumor biopsy profiles.WCLC 2016, OA10.07
- Wakelee HA et al., A highly sensitive next-generation sequencing platform for detection of NSCLC EGFR T790M mutation in urine and plasma.WCLC 2016, MA08.01
More posts
診療を変える肺癌ステージ分類の変更
TNM分類が最近第8版に改定された。2009年に発刊された第7版 と比較して、予後と研究の改善を目的として、肺癌のステージ分類にいくつかの重要な調整がなされている。スペイン、バルセロナのHospital Universitari Mútua Terrassa、胸部手術部のRamón Rami-Porta医師 (MD、PhD) は、次のように述べている。
ニンテダニブによる抗血管新生:中皮腫における活性、バイオマーカの候補
悪性胸膜中皮腫は、一般に進行期に診断されることが多いため、患者の予後が不良である。唯一承認されているレジメンは、ペメトレキセドとシスプラチンの併用であり、約1年のOS中央値が得られる。ランダム化、二重盲検、プラセボ対照、第II相LUME-Meso試験では、中皮腫治療のための経口マルチキナーゼ阻害剤ニンテダニブが評価された。
インタビュー:「免疫療法の対象者は誰か?」
NSCLCの免疫療法を検討するとき、我々は治療を受けた患者の20%が奏功することを認識する必要があります。奏功する可能性が高い患者の治療を方向付けするため、バイオマーカは有益でしょう。臨床現場で確立されているバイオマーカの1つは、免疫組織化学に基づいた腫瘍上でのPD-L1発現です。当面の間は、さまざまなPD-L1発現の評価方法がありますが、徐々に統合されていきそうです。
免疫療法:新規抗PD-L1抗体およびさまざまな併用レジメン
抗PD-1抗体と比較した抗PD-L1抗体の利点は、PD-1/PD-L2経路をそのまま残しながら、PD-1/PD-L1相互作用を阻害でき、その結果として末梢免疫恒常性を維持できることである。OAK試験は、進行したNSCLCにおける抗PDL1剤を評価する、最初のランダム化第III相試験であった。局所進行性または転移性のNSCLC患者に、アテゾリズマブ1200 mgを3週間ごとに、またはドセタキセルを投与した。
EGFRおよび他の変異における液体生検
組織生検および再生検と比較して、液体生検では最少の侵襲性、腫瘍奏功をモニタリングするための経時的に連続測定が可能、X線検査に先立って血漿中の耐性変異の検出が可能という利点がある。治療不全の重要な因子である腫瘍異質性の問題も考慮される。ドライバー遺伝子変異を高い感度と特異度で同定でき、それによりテーラーメイド医療の提供が改善される。
ALK陽性NSCLCにおける新たな治療法:新しい選択肢と新たな課題
ALK融合遺伝子陽性NSCLC患者における標準的な第1選択肢として、ALKチロシンキナーゼ阻害薬 (TKI) クリゾチニブによる治療が確立されている。クリゾチニブの出現前は、プラチナ製剤+ぺメトレキセドの2剤併用、それに続くペメトレキセド維持療法が非扁平上皮NSCLCの標準療法であった。しかし、クリゾチニブに対する最初の応答後、ALKチロシンキナーゼドメインでの二次変異を含む可能性のある複数の機序のため常に耐性を獲得する。