伴有MET改变的NSCLC:分子见解和创新治疗
间充质-上皮转化(MET)基因外显子14的致癌改变发生在3%至4%的肺腺癌患者和2%的鳞状细胞肺癌患者中[1,2]。
MET外显子14(METex14)的突变往往与MET扩增并存。正在开发多种药剂来治疗具有这些改变的肺癌患者。高度选择性的口服MET酪氨酸激酶抑制剂(TKI)卡马替尼(capmatinib)和特泊替尼(tepotinib)已获得监管部门的批准。
在正在进行的国际性开放标签II期GEOMETRY mono-1研究中,正在对患有IIIB/IV期非小细胞肺癌(NSCLC)并伴有METex14跳跃突变或MET扩增的患者进行卡马替尼的研究。该试验显示,在禁食条件下对携带METex14跳跃突变的患者施用卡马替尼时,有快速、深入且持久的应答[3]。基于此,在2020年5月,美国食品和药物管理局加速批准了卡马替尼用于治疗METex14突变的转移性NSCLC患者。
GEOMETRY mono-1:高水平MET扩增的NSCLC
高水平MET扩增(即基因拷贝数≥10)已成为MET定向疗法的潜在预测性生物标志物。在ASCO 2020大会上,Wolf等人报告了包括在GEOMETRY mono-1中的患有高水平MET扩增的NSCLC但没有METex14突变的患者使用400 mg卡马替尼BID(每日两次)的结果[4]。
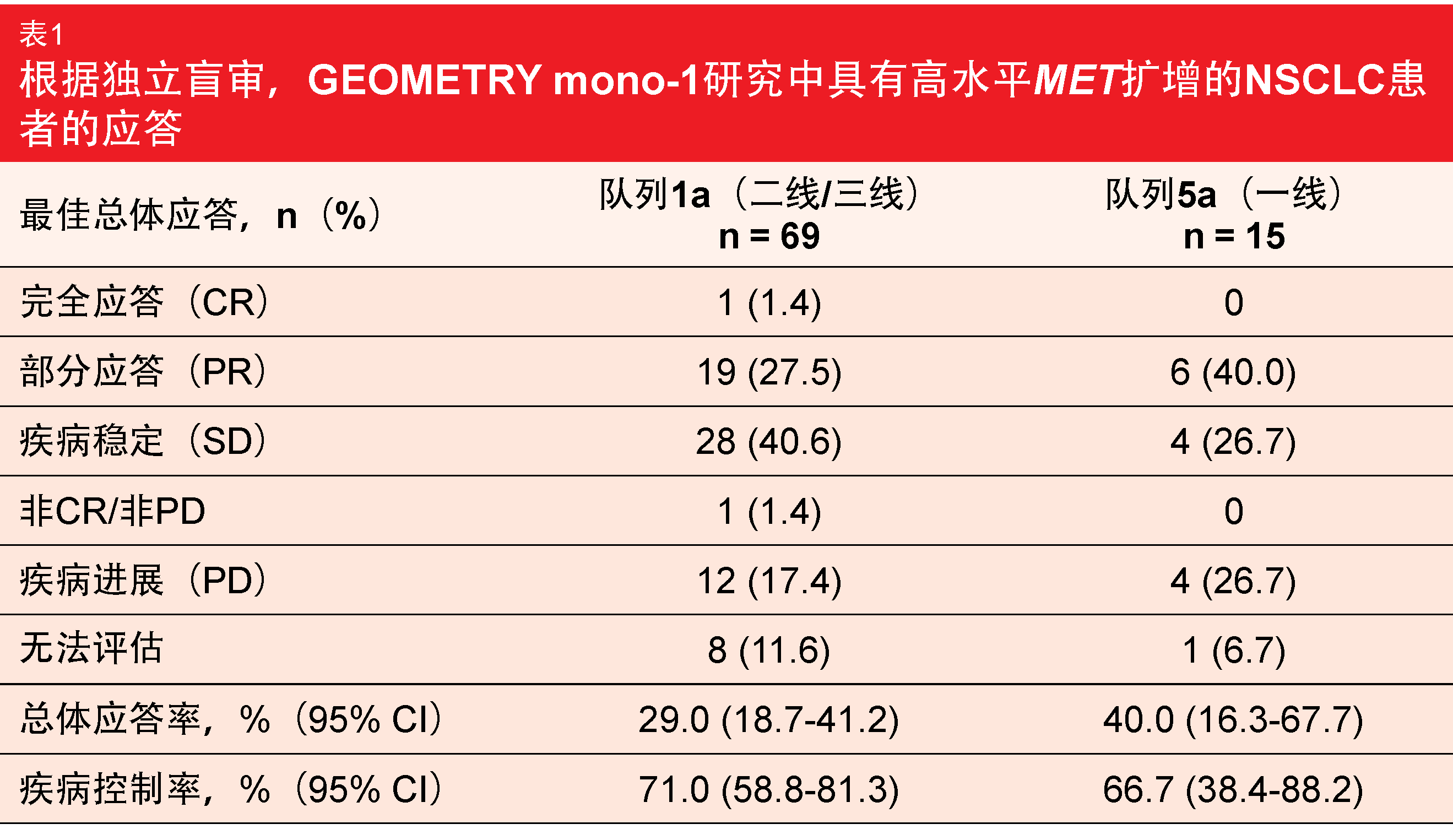
这些患者中的一些用一线或二线全身疗法进行了预治疗(队列1a;n = 69),一些为初治(队列5a;n = 15)。带有METex14突变的患者主要为女性且从不吸烟的,相比之下,具有高水平MET扩增的群体倾向于是男性且有吸烟史。总体应答率(ORR)被定义为主要终点。根据独立盲审,队列1a和5a的ORR分别为29.0%和40.0%(表1)。队列1a中的一名患者实现了完全应答。疾病控制率分别为71.0%和66.7%。治疗线似乎决定ORR但不决定其他的结果,这在不同的队列中颇为相似。对于经预治疗的患者和初治的患者,应答持续时间的中位数均约为8个月。无进展生存期(PFS)分别为4.07个月和4.17个月,总生存期(OS)分别为10.61个月和9.56个月。卡马替尼显示出良好的安全性特征,这与之前的报告相符。大多数与治疗相关的不良事件(AE)为1级和2级。
作者的结论是,该分析证明了卡马替尼在伴有高水平MET扩增的晚期NSCLC患者中的活性,尽管与GEMOTRY mono-1的METex14突变队列中的第一和第二/第三治疗线(分别为67.9%和40.6%)相比,应答率是中等的[6]。可以假设,高水平MET扩增群体中的一个亚组从MET定向疗法中获得了明显的益处。将来应该更精确地对这一组进行表征。
卡马替尼的使用不受禁食的限制
Groen等人提供了GEOMETRY mono-1研究的队列6的疗效和安全性结果[5]。该扩展组在二线条件下接受400 mg卡马替尼BID,并且是第一个没有禁食限制的队列。其包括具有高水平MET扩增但无METex14突变的患者(第1组;n = 3),和具有高水平MET扩增且具有带有任意MET基因拷贝数的METex14突变的患者(第2组;n = 31)。
第1组中的所有患者都实现了疾病稳定,但只有第2组中的患者有应答,基于根据独立盲审的部分应答,ORR为48.4%。第2组的应答持续时间为6.93个月。第2组的中位PFS为8.11个月,而第1组由于患者数量有限而无法评估中位PFS。总体而言,安全性特征被证明是可控的,并且与在禁食条件下观察到的安全性特征相一致。值得注意的是,与禁食状态下的给药相比,在没有禁食限制的情况下服用卡马替尼时,任何级别的胃肠AE的次数都有减少的趋势。
作者在其总结中认为,卡马替尼显示出作为二线药剂的疗效。与以前报道的结果相结合,不管治疗线如何,卡马替尼的活性都得到确认,并且在较早线治疗的患者中,ORR较高。
MET定向抗体混合物
Sym015是针对MET的非重叠表位的两种重组人源化单克隆抗体的协同混合物。开发这种抗体方法是为了提高MET选择性,从而避免脱靶毒性并规避细胞内获得的对MET TKI的抗性机制,例如激酶结构域突变。在IIa期条件下,共有45名患者接受了Sym015测试,第1周期第1天的负荷剂量为18 mg/kg,随后每两周的维持剂量为12 mg/kg [6]。其中20名患者患有伴有MET扩增或METex14缺失的NSCLC。在该队列中,允许使用既往的MET和/或EGFR靶向药物进行治疗,其中为MET-TKI初治和经MET-TKI预治疗的患者各有10名。这些组均包含带有MET扩增和METex14缺失的患者。
肺癌患者的应答仅发生于初治的个体中(n=5;25%),中位持续时间为13.8个月。尽管有数据表明在某些情况下有轻微应答且疾病长期稳定,但经预治疗的患者均未出现完全或部分应答。MET-TKI初治的患者的疾病控制率(DCR)为100%,经MET-TKI预治疗的患者的DCR为60%。在整个NSCLC队列中,尚未达到中位OS,PFS为7.4个月与5.4个月。在METex14突变且MET扩增的NSCLC中,在MET-TKI-初治群体中获得的应答率与用MET TKI治疗观察到的应答率相似。
Sym015显示出良好的安全性特征,与治疗有关的最常见AE为外周性水肿、天冬氨酸转氨酶升高、恶心、乏力和食欲下降。在45名个体中,有6名患者的AE ≥ 3级,但只有一名肺癌患者需要降低剂量。没有患者因AE而终止治疗。此外,分析表明,液体活检是选择METex14缺失患者的可行选择,因为在9个可评估的患者中,对于这种畸变,局部肿瘤与血液循环肿瘤DNA(ctDNA)之间有100%的一致性。另一方面,MET扩增检测的一致性很低,仅为29%,这可能是由于肿瘤脱落少或肿瘤演变等因素造成。计划对Sym015联合MET TKI治疗进行评估以延迟或治疗耐药性。
METex14改变的亚型
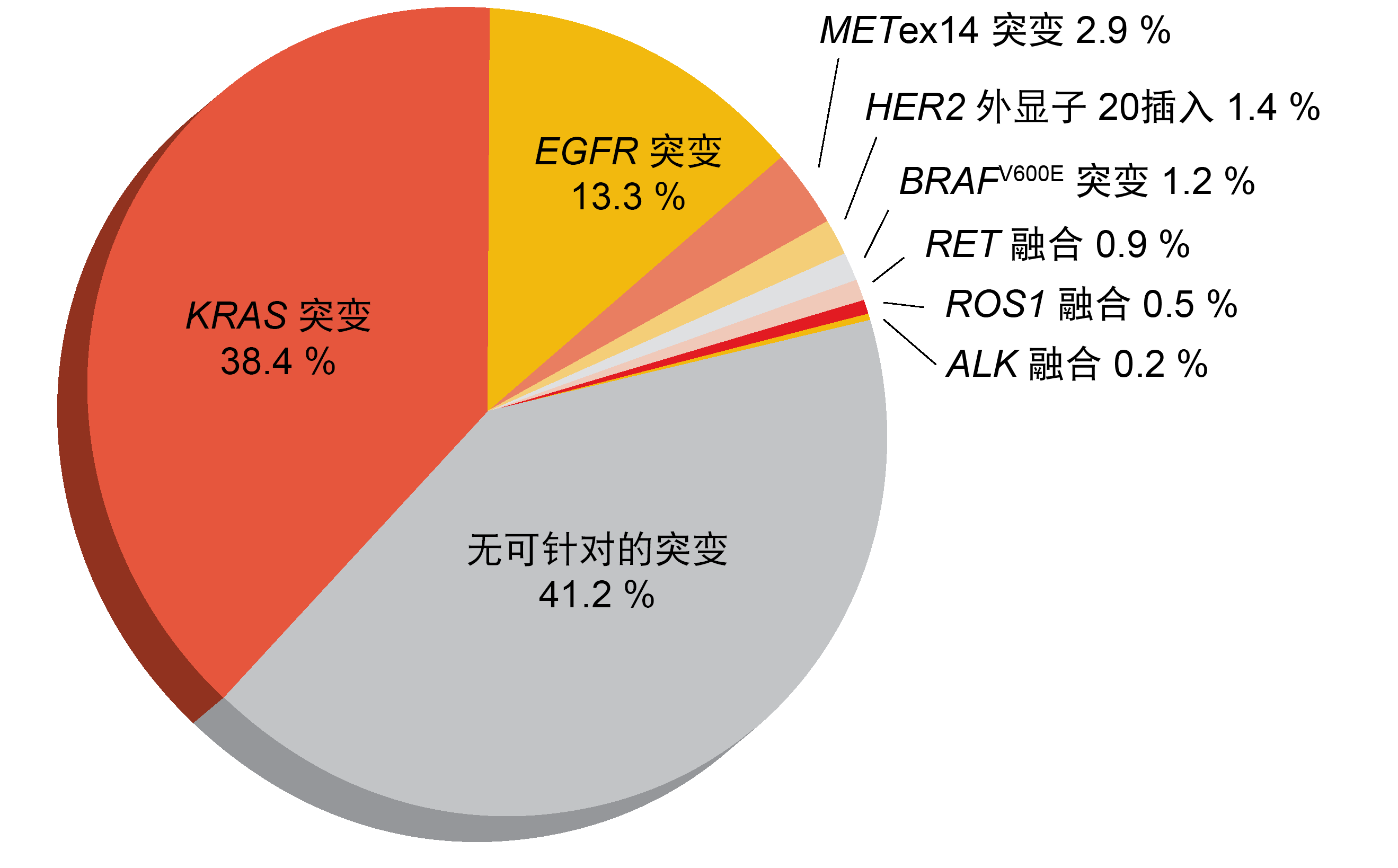
外显子14跳跃是由外显子14及其侧翼内含子的一系列基因组改变引起的。Awad等人分析了来自NSCLC患者的样品以表征各种METex14改变亚型之间的潜在差异,并评估可能影响治疗效果并提示组合策略的共存改变以及免疫治疗生物标志物[7]。对60,495名NSCLC患者的肿瘤DNA进行的基于NGS的杂交捕获基因组分析显示,其中2.3%(n = 1,387)在多个功能位点亚群处有METex14改变,导致Y1003处的外显子14跳跃、缺失或突变。METex14改变的肺肿瘤显示了显著低于具有野生型METex14的肺肿瘤的突变负荷(TMB)(p < 0.001)。而且,与野生型样品相比,它们富含高(≥ 50%)PD-L1表达(48%比29%;图1)。PD-L1阳性在METex14改变功能位点的亚群中相对类似。没有一个病例显示TMB与PD-L1表达之间存在关联。需要额外的数据来确定这些生物标志物对免疫疗法应答的预测作用。
而且,在多个剪接功能位点之间,共改变(如MDM2、CDK4和MET扩增)的频率基本一致。包括KRAS和EGFR突变在内的并存驱动因素很少,分别为3.2%和0.65%。没有出现并存的BRAFV600E突变或ALK/ROS1/NTRK融合。
根据对36个配对病例的分析,潜在的获得性耐药机制基本上与主要的METex14改变亚型不相关。耐药性改变包括复发性继发性MET突变(配对的25%)、MET扩增(配对的8%)以及具有EGFR/ErbB2激活、KRAS扩增和PI3K突变的个别病例。
图1: 与METex14野生型相比,METex14改变的肺肿瘤中PD-L1表达更高
基于DNA与基于RNA的测定
假设单独的基于DNA的测定可能不是检测METex14突变的最佳方法,Jurkiewicz等人检查了由NGS确定的肺腺癌的分析数据以比较基于DNA和基于RNA的测定用于检测METex14变异的性能[8]。644名患者的肿瘤由靶向MET外显子2、14、16、18和19的基于DNA的定制靶向面板进行分析。没有基于DNA的驱动突变的病例被反射到基于NGS的RNA融合面板。
在21个月的时间里,DNA分析在2.5%的患者中检测到METex14跳跃事件。然而,对驱动因子阴性病例的RNA分析确定了另外9个METex14突变,这些突变构成了总共3.9%的事件。因此,36%的METex14突变被DNA面板遗漏。仅能由RNA面板鉴定的变异倾向于存在于内含子13剪接受体位点或与剪接有关的其他位点。这些位点没有被DNA面板覆盖,而内含子14剪接供体位点被覆盖。作者指出,突变可能发生在剪接受体位点、分支位点A和多嘧啶轨道上。覆盖这些区域的定制DNA面板可以提高测试灵敏度,但需要更深的内含子覆盖度,这带来了技术挑战。
总体而言,在面板引物未同时靶向内含子13的3’剪接位点和内含子14的5’剪接位点时,基于DNA的NGS面板可能会遗漏肺腺癌中的METex14跳跃事件。在没有DNA检测到的驱动突变的情况下,对RNA融合进行反射工作流称测试可以潜在地捕获此类事件。对于未来的研究,仅由RNA测定法检测的变体的组织学、临床和分子表征值得进一步研究。
VISION试验:特泊替尼
VISION II期试验评估了在≤ 2个治疗线后,在携带METex14跳跃突变的局部晚期或转移性NSCLC患者中,每日剂量500 mg的MET TKI 特泊替尼的疗效和耐受性。基于这些结果,特泊替尼及其伴随诊断法于2020年3月在日本获得批准。在纳入试验之前,已通过液体活检或组织活检检测到MET改变。允许无症状的脑转移患者参加。Le等人报告了VISION试验的主要疗效、安全性和生物标志物结果[9]。
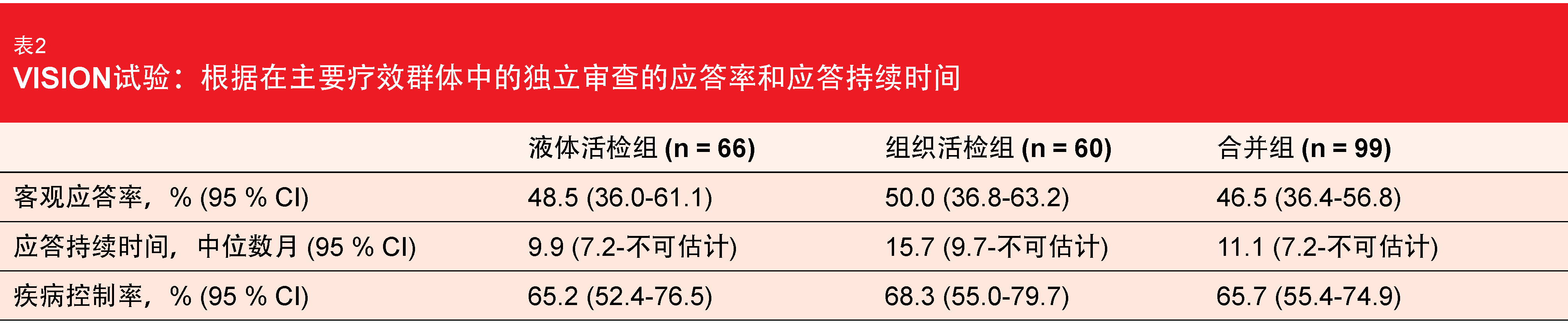
根据独立审查的ORR被定义为主要终点,其在液体活检阳性组中为48.5 %,在组织活检阳性组中为50.0%,在液体和/或组织活检阳性合并组中为46.5%(表2)。89%的患者出现肿瘤缩小。在合并组中,中位PFS和OS分别为8.5个月和17.1个月。全部为非靶向病灶的基线脑转移患者(n = 11)的结果与总群体中的结果相当,ORR为54.5%,中位PFS为10.9个月。
67%的患者实现了分子ctDNA应答,即METex14突变体等位基因频率降低。在这些患者中,观察到较高的应答率,分别有71%和88%的患者经历了放射照相术应答和疾病控制。特泊替尼具有可控的耐受性特征。外周性水肿、恶心和腹泻是最常见的AE。27.6%的患者出现与治疗相关的≥3级的AE。32.9%的患者需要减少剂量,11.2%的患者需要永久停药。
作者的结论是,对于通过液体或组织活检确定的具有METex14跳跃突变的NSCLC患者,特泊替尼是一种具有持久临床活性的有前景的靶向疗法。
来自VISION的生活质量数据
在VISION试验中,与健康有关的生活质量的调查结果在ASCO大会上另行报告[10]。使用EORTC QLQ-LC13、EORTC QLQ-C30和EQ-5D-5L问卷以及直观类比标度(VAS)对结果进行评估。在进入研究时,几乎所有患者都患有转移性疾病;他们比具有其他可针对的分子改变的患者(中位年龄,74.0岁)年长,并且其中大部分的ECOG表现状态为1。基线评分显示中度至高度功能和生活质量,以及中度肺癌症状负担。
对于QLQ-LC13症状,相对于基线的平均变化表明咳嗽得到了有意义的改善,呼吸困难和胸痛得到了数值上的改善。QLQ-C30总体健康和功能标度评分以及EQ-5D-5L VAS评分的平均变化表明,生活质量随着时间推移保持稳定。这些发现与VISION研究的疗效和安全性结果一起支持特泊替尼作为具有METex14跳跃突变的NSCLC患者的有前景的治疗选择。
沃利替尼(savolitinib)的强活性
一项中国的多中心、单组II期研究在患有不可切除或转移性的METex14跳跃阳性肺肉瘤样癌的患者(PSC;n = 25)和其他类型的NSCLC患者(n = 45)中评估了高选择性的口服MET TKI 沃利替尼[11]。这些患者不适合化疗或对化疗没有应答。PSC是一种罕见的NSCLC,其临床表现尤其具有侵袭性,且预后不良,通常对化疗有耐受性。沃利替尼以按体重调整的方式提供,体重≥ 50 kg和< 50 kg的患者每日剂量分别为600 mg和400 mg。
沃利替尼显示出强大而持久的活性,在疗效可评估组中的ORR为49.2%。应答持续的中位时间为9.6个月。中位PFS为6.9个月;PSC患者的PFS比其他NSCLC类型的患者短(分别为5.5个月和9.7个月)。此外,经过先前治疗的组中的PFS(13.8个月)比初治队列(5.6个月)更长,尽管这反映了一个事实,即初治队列中近一半的患者患有PSC。中位OS为14.0个月。25.7%的患者发生了与治疗有关的严重AE,包括肝功能障碍、药物超敏性和发热。1名患者死于肿瘤溶解综合征。14.3%的患者必需因AE而停止治疗。总体而言,沃利替尼表现出有前景的抗肿瘤活性和可接受的耐受性。
早期METex14突变肺癌的特征
METex14突变NSCLC的临床和基因组学特征已在转移条件下表征,而对这种分子亚型在早期疾病中的了解还很少。因此,Recondo等人回顾性地评估了613例I-III期NSCLC切除患者队列中METex14突变肺癌的各种特征,并将其与IV期肺癌进行了比较[12]。该组中METex14突变的发生率为2.8%;非鳞状肿瘤的频率(2.9%;图2)比具有鳞状组织学的肿瘤(1.4%)高。
关于基因组共改变,MET扩增、TP53突变和CDKN2A/B丢失在NSCLC的I-III期中的发生率明显低于IV期中。MDM2和CDK4/6扩增的差异不显著,而KRAS突变/扩增和EGFR突变/扩增仅发生在IV期肿瘤中。肿瘤比例分数≥ 50%的高PD-L1表达在I期和II期中并不常见(分别为13.5%和14.3%),但在III期更为普遍(36.0%),不过这仍低于IV期PD-L1 TPS ≥ 50%的发生率(48.7%)。
就临床结果而言,分析显示,约46%的II或III期疾病患者在具有治疗意图的切除后有复发。这些组中,来自手术的中位无疾病生存期(DFS)分别仅为2.6年和2.1年。另一方面,患有I期疾病的患者的DFS为8.3年(p = 0.017)。研究人员强调,在这一群体中探索辅助和新辅助MET靶向疗法的作用的临床试验可能是必要的。
图2: I-III期非鳞状NSCLC在切除后的分子亚型的分布
参考文献
- Drilon A et al., Targeting MET in lung cancer: will expectations finally be MET? J Thorac Oncol 2017; 12: 15-26
- Tong JH et al., MET amplification and exon 14 splice site mutation define unique molecular subgroups of non-small cell lung carcinoma with poor prognosis. Clin Cancer Res 2016; 22: 3048-3056
- Wolf J et al., Capmatinib (INC280) in METΔex14-mutated advanced non-small cell lung cancer (NSCLC): Efficacy data from the phase II GEOMETRY mono-1 study. J Clin Oncol 37, 2019 (suppl; abstr 9004)
- Wolf J et al., Capmatinib in patients with high-level MET-amplified advanced non-small cell lung cancer (NSCLC): results from the phase 2 GEOMETRY mono-1 study. J Clin Oncol 38: 2020 (suppl; abstr 9509)
- Groen HJM et al., Capmatinib in patients with METex14-mutated or high-level MET-amplified advanced non-small-cell lung cancer (NSCLC): results from cohort 6 of the phase 2 GEOMETRY mono-1 study. J Clin Oncol 38: 2020 (suppl; abstr 9520)
- Camidge DR et al., Safety and preliminary clinical activity of the MET antibody mixture Sym015 in advanced non-small cell lung cancer (NSCLC) patients with MET amplification/exon 14 deletion (METAmp/Ex14Δ). J Clin Oncol 38: 2020 (suppl; abstr 9510)
- Awad M et al., Characterization of 1,387 NSCLCs with MET exon 14 (METex14) skipping alterations (SA) and potential acquired resistance (AR) mechanisms. J Clin Oncol 38: 2020 (suppl; abstr 9511)
- Jurkiewicz M et al., Efficacy of DNA vs. RNA NGS based methods in MET Exon 14 skipping mutation detection. J Clin Oncol 38: 2020 (suppl; abstr 9036)
- Le X et al., Primary efficacy and biomarker analyses from the VISION study of tepotinib in patients with NSCLC with MET exon 14 skipping. J Clin Oncol 38: 2020 (suppl; abstr 9556)
- Paik PK et al., Tepotinib in NSCLC patients with MET exon 14 skipping: health-related quality of life. J Clin Oncol 38: 2020 (suppl; abstr 9575)
- Lu S et al., Phase II study of savolitinib in patients with pulmonary sarcomatoid carcinoma and other types of non-small cell lung cancer harboring MET exon 14 skipping mutations. J Clin Oncol 38: 2020 (suppl; abstr 9519)
- Recondo G et al., Clinical characteristics, genomic features, and recurrence risk of early-stage MET exon 14 mutant non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9042)
© 2019 Springer-Verlag GmbH, Impressum
More posts
罕见突变:HER2、RET、ALK和BRAF
曲妥珠单抗deruxtecan(T-DXd)是一种含有与拓扑异构酶I抑制剂依喜替康(exatecan)衍生物连接的人源化抗HER2单克隆抗体的新型抗体-药物偶联物。 开放标签、多中心、II期DESTINYLung01研究在表达HER2(队列1;n = 42)或携带HER2激活突变(队列2;n = 42)的复发性或难治性晚期NSCLC患者中测试了6.4 mg/kg每3周一次的T-DXd。在ASCO大会上,Smit等人报告了队列2的中期结果。
患有胸部癌症的COVID-19患者:TERAVOLT
建立全球联盟TERAVOLT的目的是确定将患上COVID-19的胸部恶性肿瘤患者置于住院和死亡风险中的因素,以便阐明这些患者的临床病程并确定可能影响生存的治疗策略。 正在将诊断为COVID-19的胸部癌症患者(即根据RT-PCR技术确诊感染的病例和疑似COVID-19病例)输入数据库。后者由临床标准(已知暴露于确诊COVID-19者并且有发烧> 37.5°C、咳嗽、腹泻等症状)或符合冠状病毒性肺炎和症状的肺部影像学特征确定。
抗血管生成疗法的现状和未来展望
口服三联血管激酶抑制剂尼达尼布(nintedanib)已在欧盟和其他国家批准与多西他赛联用,用于治疗一线化疗后的晚期肺腺癌。它通过靶向血管内皮生长因子(VEGF)受体1-3、血小板衍生生长因子(PDGF)受体α/β和成纤维细胞生长因子(FGF)受体1-3,以及RET来发挥作用。 鉴于晚期NSCLC中治疗环境的变化,在以前接受过免疫检查点抑制剂(ICI)治疗的患者中,尼达尼布加多西他赛的活性是特别令人关注的。该疗法在进展后的最佳顺序尚未阐明,但潜在的肿瘤生物学可能有助于指导治疗的选择。
(新)辅助策略改善早期条件下的结果
约30%的NSCLC患者在诊断时表现出可切除的疾病。手术是早期NSCLC的主要治疗方法。 切除后,对于II/IIIA期肺癌患者和IB期疾病的选定患者,会建议采用基于顺铂的辅助化疗。然而,手术和辅助化疗后疾病复发率或死亡率仍然很高,从IB期的45%至III期的76%。显然,对改善临床结果的有效新疗法的需求尚未得到满足。
EGFR突变疾病:外显子20插入阳性肺癌的早期组合和新方法
寡转移性疾病通常由一至五个转移病灶定义。由于进展最经常发生在原发病部位,因此推测积极的局部治疗可能会阻止进一步的传播。 基于这一理论,在中国进行的开放标签、随机、Ⅲ期SINDAS试验探索了体部立体定向放疗(SBRT)和EGFR TKI疗法在寡转移、EGFR突变的NSCLC患者中的并行使用。患者在任何一个器官的转移病灶不超过两个,总共最多五个转移病灶。在实验组(n = 68)中,SBRT以25至40 Gy的剂量分5部分施用,而对照组(n = 65)的患者仅接受TKI治疗(即,吉非替尼(gefitinib)、厄洛替尼(erlotinib)、埃克替尼(icotinib))。
免疫检查点抑制:综合获益,但并非没有风险
在随机、III期CheckMate 227研究中,无论肿瘤PD-L1表达情况如何,一线纳武单抗(nivolumab)加伊匹单抗(ipilimumab)(NI)与化疗相比显著延长晚期NSCLC患者的OS。在ASCO大会上,Ramalingam等人提供了试验第1部分更新的3年疗效和安全性结果。 第1部分由第1a部分和第1b部分组成,第1a部分比较了NI(n = 396)与化疗(n = 397)和纳武单抗单药治疗(n = 396),而第1b部分评估了NI(n = 187)与化疗(n = 186)和纳武单抗加化疗(n = 177)。第1a部分的患者显示PD-L1表达≥ 1%,而第1b部分的患者的PD-L1检测为阴性(