免疫检查点抑制:综合获益,但并非没有风险
CheckMate 227中的三年发现
在随机、III期CheckMate 227研究中,无论肿瘤PD-L1表达情况如何,一线纳武单抗(nivolumab)加伊匹单抗(ipilimumab)(NI)与化疗相比显著延长晚期NSCLC患者的OS[1]。在ASCO大会上,Ramalingam等人提供了试验第1部分更新的3年疗效和安全性结果[2]。
第1部分由第1a部分和第1b部分组成,第1a部分比较了NI(n = 396)与化疗(n = 397)和纳武单抗单药治疗(n = 396),而第1b部分评估了NI(n = 187)与化疗(n = 186)和纳武单抗加化疗(n = 177)。第1a部分的患者显示PD-L1表达≥ 1%,而第1b部分的患者的PD-L1检测为阴性(< 1 %)。
在三年时,不管PD-L1表达如何,与化疗相比,一线NI持续提供长期益处。在第1a部分中,该组合和化疗的3年OS率分别为33%和22%(HR,0.79)。对于第1b部分,这分别为34%和15%(HR,0.64)。超过三分之一的应答者在三年后仍有NI应答(对于≥ 1%和< 1%的PD-L1表达者分别为38%和34%),而化疗组的相应比率在5%以下。而且,该组合显示出独立于PD-L1表达的优于纳武单抗单药治疗和纳武单抗加化疗的持久优势。
探索性里程碑分析评估了六个月时的应答对长期OS的影响。这显示,在PD-L1≥ 1%的患者中,采用NI在六个月时达到完全或部分应答的患者中,有70%在三年时仍存活;在化疗组,这仅为39%。对于PD-L1 <1%的组,观察到了相似的结果(82%与25%)。至少36.3个月的延长的安全性随访未发现任何新的关于该组合的信号。影响皮肤、胃肠道、内分泌系统和其他区域的NI治疗相关的选择性AE随着时间减少。作者得出结论,对于晚期NSCLC患者,NI是一种不用化疗的新型一线治疗选择。2020年5月,该方案已在美国获得此适应症的批准,而欧洲的申请在四个月前被撤回。
两个周期的化疗加检查点阻断:CheckMate 9LA
III期、随机CheckMate 9LA试验是基于以下假设进行的,即在一线NI中增加有限的化疗疗程可能会提供快速的疾病控制,同时有助于在CheckMate 227中用NI观察到的持久OS益处。在719例IV期或复发性NSCLC患者中,有361例接受了NI以及两个周期的化疗。在对照组(n = 358)中,施用了四个周期的化疗,随后对非鳞状肿瘤患者给予可选的培美曲塞(pemetrexed)维持剂量。OS被定义为主要终点。
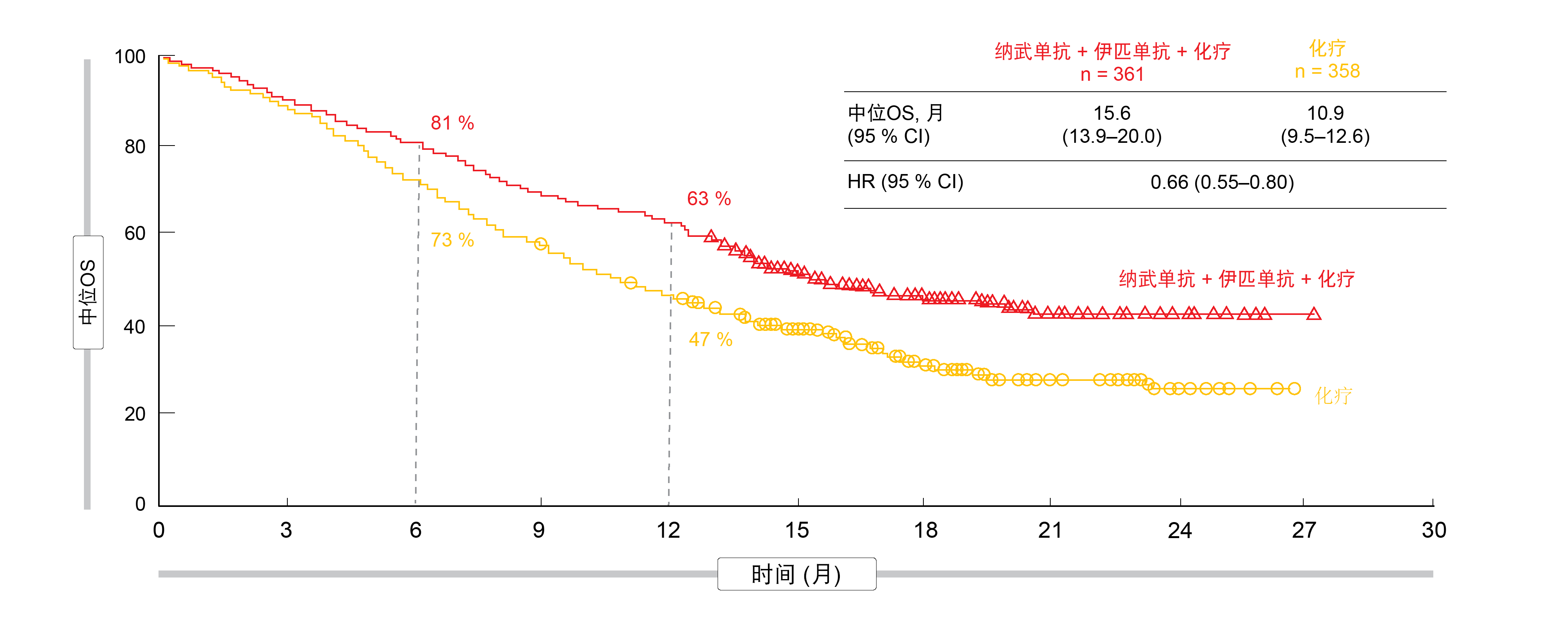
经过至少8.1个月的随访,CheckMate 9LA在预先计划的中期OS分析时达到了其主要终点,与仅化疗相比,基于免疫疗法的治疗方案在统计学上具有显著的优势(14.1个月与10.7个月;HR,0.69;p = 0.0006)[3]。OS的优势随着时间的推移而增加;根据随访12.7个月后获得的最新结果,中位OS为15.6个月与10.9个月(HR,0.66;图1)。不管组织学(鳞状或非鳞状)和PD-L1表达(< 1%、≥ 1%、1-49%、≥ 50%)如何,基于免疫疗法的患者均可获得更好的生存率。在12个月时,PFS率分别为33%和18%(HR,0.68),并且49%和24%的患者对治疗有应答。
该组合没有引起任何新的AE;与治疗有关的所有级别的AE主要包括恶心、贫血、乏力和腹泻。免疫相关的AE大多为1级和2级。总体而言,CheckMate 9LA研究表明,对于晚期NSCLC患者,应将NI加有限的化疗疗程视为新的一线治疗选择。实际上,美国食品和药物管理局已于2020年5月批准。
图1: CheckMate 9LA:纳武单抗加伊匹单抗和化疗与化疗相比具有持续的总体生存优势
度伐鲁单抗(Durvalumab)/替西木单抗(tremelimumab)±化疗
另一项在IV期NSCLC中评估双重检查点抑制和化疗组合的一线方法的试验是国际性、随机II期CCTG BR.34研究[4]。根据组织学,将患者分配为度伐鲁单抗加替西木单抗并随后进行度伐鲁单抗维持治疗(n = 150),或者采用相同的方案加铂双药化疗并随后单独用度伐鲁单抗或用度伐鲁单抗联合培美曲塞进行治疗(n = 151)。尽管增加化疗并不能延长OS(HR,0.88),但与单纯免疫疗法相比,组合策略在PFS(7.7与3.2个月;HR,0.67;p = 0.0035)和ORR(p = 0.033)方面带来了显著益处。
对于血液肿瘤突变负荷(bTMB)< 20个突变/Mb的患者,增加化疗的效果似乎更大;但是,相互作用测试是阴性的。据研究者称,这一发现值得在随机研究中进一步评估。无论治疗类型如何,bTMB ≥ 20 mut/Mb的患者的OS和PFS均比bTMB < 20 mut/Mb的患者长,这提示了预后(而非预测)效果。PD-L1水平与增加化疗的益处差异无关。尽管两组之间免疫相关AE的发生率相似,但在实验组中更多的患者经历了严重的AE。该试验的生活质量、血浆基因组学和成本的分析正在进行中。
KEYNOTE-189的最终分析
在一项随机、双盲、III期KEYNOTE-189试验中,对于未经治疗的转移性非鳞状NSCLC患者,无论PD-L1表达如何,派姆单抗(pembrolizumab)加铂化疗首先显示出显著优于安慰剂加化疗的OS和PFS[5,6]。在ASCO 2020上,Rodriguez-Abreu等人提供了从随机分组到数据截止的中位时间31.0个月后,KEYNOTE-189的方案规定的最终分析[7]。
通过长期随访,相较于单独化疗,派姆单抗加培美曲塞/铂持续改善疗效结果。实验组的中位OS大约是对照组的两倍长(22.0与10.6个月;HR,0.56)。PFS(9.0与4.9个月;HR,0.49)和PFS2,即下一线治疗后的PFS也是如此(17.0与9.0个月;HR;0.50)。客观应答率为48.3%与19.9%。PD-L1表达不影响任何这些结果。在完成35个周期的派姆单抗的实验组患者(n = 56)中,ORR高达85.7%;其中包括四个完全应答者。在此队列中尚未达到中位OS。
作者得出结论,派姆单抗加培美曲塞/铂是针对新诊断的转移性非鳞状NSCLC患者的标准护理疗法。
抗TIGIT抗体tiragolumab
共抑制受体TIGIT在多种免疫细胞上表达,并通过与肿瘤和抗原呈递细胞上的配体结合而抑制T细胞和NK细胞[8-10]。据推测,防止这种结合反应的抗TIGIT抗体可能恢复抗肿瘤应答并补充抗PD-(L)1抗体的活性。确实,抗TIGIT单克隆抗体Tiragolumab在I期GO30103试验(NCT02794571)中显示出与阿特朱单抗(atezolizumab)组合的活性。根据这些观察结果,随机、双盲、II期CITYSCAPE研究评估了tiragolumab加阿特朱单抗(n = 67)与安慰剂加阿特朱单抗(n = 68)在表达PD-L1的IV期NSCLC患者的一线治疗中的比较[11]。
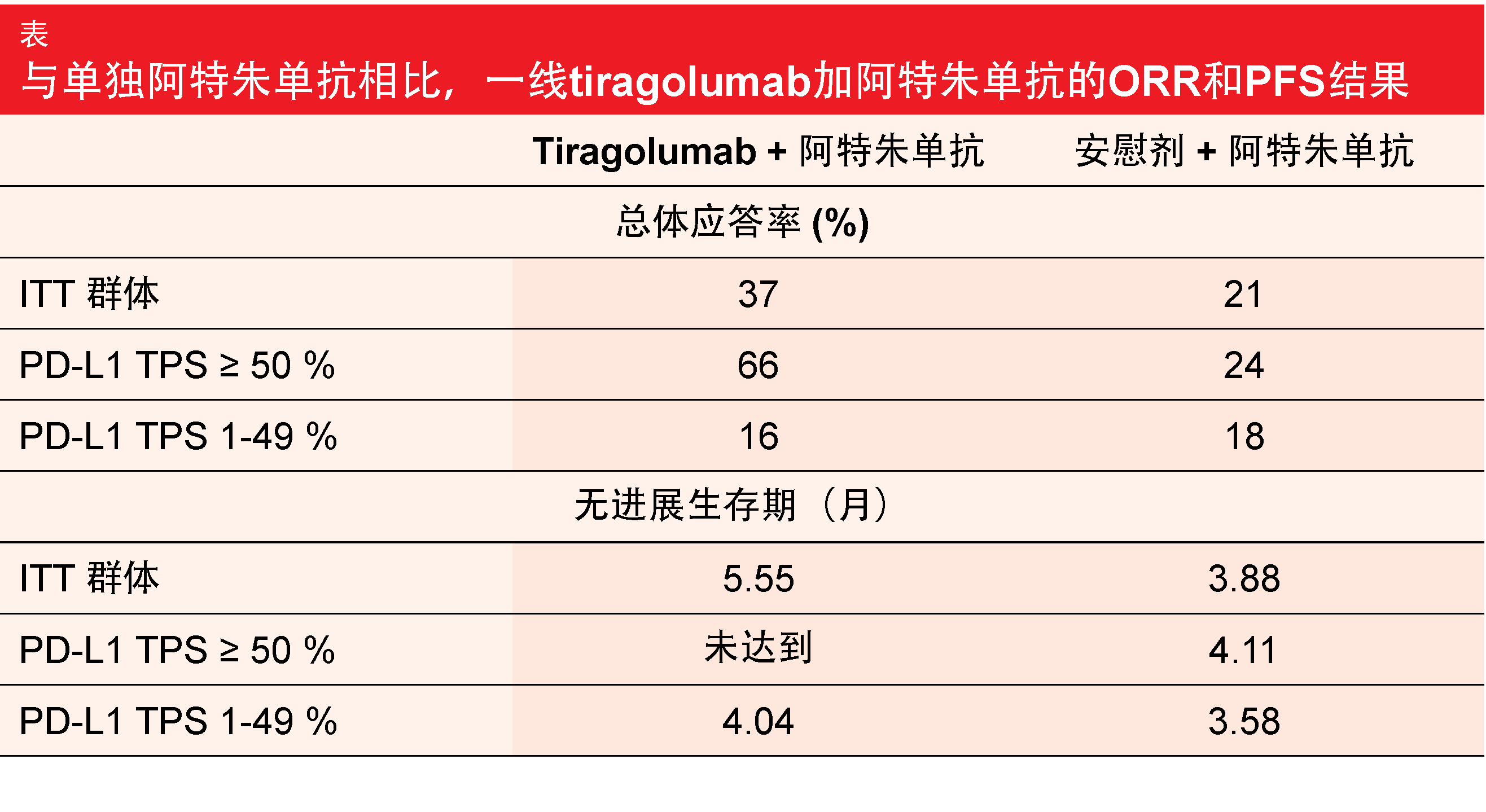
ORR和PFS被定义为共同主要终点。在中位随访10.9个月后,与安慰剂加阿特朱单抗相比,tiragolumab加阿特朱单抗在ITT群体中引起了ORR(37%与21%)和PFS(5.55个月与3.88个月;HR,0.58)的临床有意义的改善。值得注意的是,在PD-L1肿瘤比例评分(TPS)≥ 50%的患者中观察到ORR和PFS益处,但在TPS 1-49%的患者中没有观察到(表)。应答持续时间和OS尚未完成。
Tiragolumab加阿特朱单抗的耐受性良好,安全性特征与比较方案相似。尽管免疫介导的毒性在实验组中更频繁地发生,但这些AE主要为1级或2级,并且是可控制的。一项正在进行中的III期研究SKYSCRAPER-01旨在确认tiragolumab加阿特朱单抗在未经治疗的表达PD-L1(TPS ≥50%)的NSCLC患者中是否有观察到的活性和安全性。
肺炎是未充分报道的AE
尽管免疫疗法在晚期NSCLC患者的治疗中日益重要,但潜在的威胁生命的AE,例如检查点抑制剂性肺炎(CIP),也需要应对,并且可能需要更多的考虑。Spieler等人假设,在接受纳武单抗单药疗法的晚期NSCLC患者中,CIP可能未被充分报道,并且放射组学特征可识别出临床上错误分类的CIP[12]。在机构审查委员会批准的数据库中,在159名接受纳武单抗治疗的NSCLC患者中有9名(5%)被诊断出患有不同级别的CIP。研究者从同一群体中随机选择了另外40名没有诊断出CIP的患者。在所有49例病例中,对最后一次免疫疗法前的CT成像研究中未受累的肺进行了分割、描绘并分析了与CIP相关的放射组学特征。包含放射组学的逻辑回归模型为每名患者分配了CIP概率评分。
六个放射组学特征值显示与CIP相关。基于放射组学的概率模型向40名无CIP临床诊断的患者中的7名(17.5%)分配了概率> 50%的CIP。图表回顾显示,这7名患者中有6名表现出高度提示CIP的症状或放射影像学特征。因此,CIP的发病率似乎未得到充分报道,而放射组学特征可以帮助识别临床上错误分类的病例。未来的研究方向包括将研究范围扩大整个数据库,将放射组学特征与血液生物标志物相关联,以及纳入肿瘤负荷和放疗作为分析中的附加协变量。
肺炎后的度伐鲁单抗再激发
Saito等人研究了在现实条件下,在度伐鲁单抗获得批准后,接受放化疗的局部晚期NSCLC患者中肺炎/放射性肺炎的发生时间、临床病程、严重程度、管理和临床结果[13]。这项回顾性研究在日本的17个中心进行,涉及在2018年5月至2019年5月之间开始同步放化疗的连续患者。分析群体由275人组成。在74.2%的病例中进行度伐鲁单抗巩固。
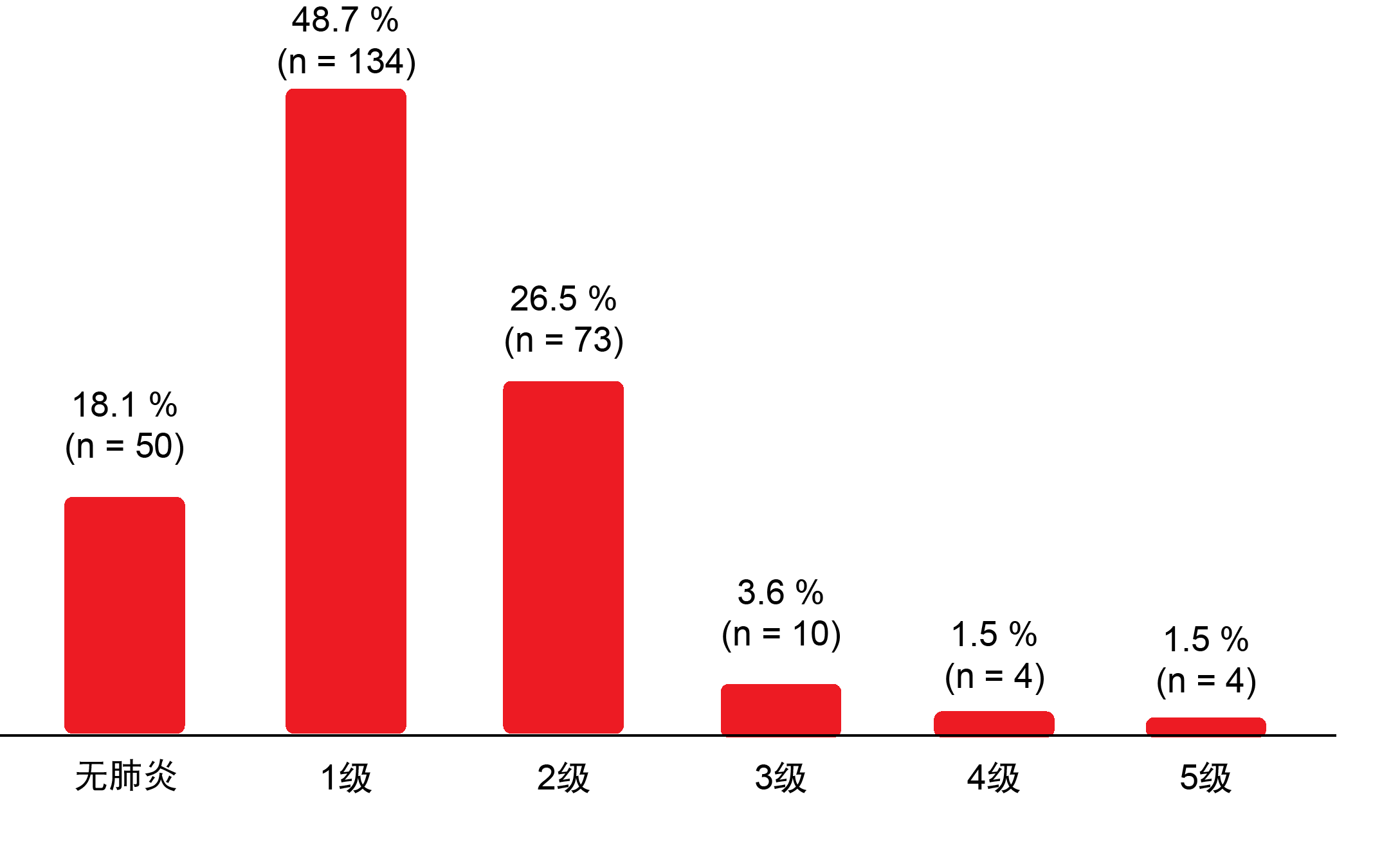
超过80%的患者患上肺炎,主要是1级(48.7%)和2级(26.5%)的,不过1.5%的肺炎是致命的(图2)。33%的患者经历过任何症状的肺炎(≥2级);在此,肺容积接受剂量≥20 Gy(V20)被确定为独立危险因素。6%的患者发生≥3级肺炎。有十三例患者(5%)在肺炎后需要家庭氧疗。肺炎的中位发病时间是放化疗开始后14周,以及度伐鲁单抗治疗开始后约4至7周。
在度伐鲁单抗巩固期间患上肺炎的患者中,给予类固醇治疗的比例为25%。在该组中,41%的患者进行了度伐鲁单抗再激发,大多数患者未出现肺炎复发。半数复发者不需要中断治疗,也无致命的复发或慢性呼吸衰竭。作者提出,经过慎重考虑,度伐鲁单抗再激发可能是皮质类固醇治疗肺炎后的一种选择。
图2: 经放化疗和度伐鲁单抗巩固治疗的III期NSCLC患者中肺炎的发病率和严重程度
参考文献
- Hellmann MD et al., Nivolumab plus ipilimumab in advanced non-small-cell lung cancer. N Engl J Med 2019; 381: 2020-2031
- Ramalingam SS et al., Nivolumab + ipilimumab versus platinum-doublet chemotherapy as first-line treatment for advanced non-small cell lung cancer: Three-year update from CheckMate 227 Part 1. J Clin Oncol 38: 2020 (suppl; abstr 9500)
- Reck M et al., Nivolumab + ipilimumab + 2 cycles of platinum-doublet chemotherapy vs. 4 cycles chemo as first-line treatment for stage IV/recurrent non-small cell lung cancer (NSCLC): CheckMate 9LA. J Clin Oncol 38: 2020 (suppl; abstr 9501)
- Leighl NB et al., CCTG BR.34: A randomized trial of durvalumab and tremelimumab +/- platinum-based chemotherapy in patients with metastatic (stage IV) squamous or nonsquamous non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9502)
- Gandhi L et al., Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N Engl J Med 2018; 378(22): 2078-2092
- Gadgeel S et al., Updated analysis from KEYNOTE-189: Pembrolizumab or placebo plus pemetrexed and platinum for previously untreated metastatic nonsquamous non-small-cell lung cancer. J Clin Oncol 2020; 38(14): 1505-1517
- Rodriguez-Abreu D et al., Protocol-specified final analysis of KEYNOTE-189: pemetrexed-platinum chemotherapy with or without pembrolizumab in patients with previously untreated metastatic nonsquamous NSCLC. J Clin Oncol 38: 2020 (suppl; abstr 9582)
- Manieri NA et al., TIGIT: A key inhibitor of the cancer immunity cycle. Trends Immunol 2017; 38(1): 20-28
- Rotte A et al., Mechanistic overview of immune checkpoints to support the rational design of their combinations in cancer immunotherapy. Ann Oncol 2018; 29(1): 71-83
- Yu X et al., The surface protein TIGIT suppresses T cell activation by promoting the generation of mature immunoregulatory dendritic cells. Nat Immunol 2009; 10: 48-57
- Rodriguez-Abreu D et al., CITYSCAPE: Primary analysis of a randomized, double-blind, phase II study of the anti-TIGIT antibody tiragolumab plus atezolizumab versus placebo plus atezo as first-line treatment in patients with PD-L1-selected NSCLC. J Clin Oncol 38: 2020 (suppl; abstr 9503)
- Spieler B et al., Is checkpoint inhibitor pneumonitis underreported in patients with advanced non-small cell lung cancer (NSCLC) on PD-1 inhibitor monotherapy? J Clin Oncol 38: 2020 (suppl; abstr 9579)
- Saito G et al., Real-world survey of pneumonitis/radiation pneumonitis among locally advanced NSCLC with chemoradiotherapy after the approval of durvalumab: A multicenter retrospective cohort study (HOPE-005/CRIMSON). J Clin Oncol 38: 2020 (suppl; abstr 9039)
© 2019 Springer-Verlag GmbH, Impressum