小细胞条件下的新兴生存获益
IMpower133:更新的OS结果
鉴于广泛期小细胞肺癌(ES-SCLC)患者的不良预后,因此迫切需要有效的一线治疗选择。全球性双盲随机化安慰剂对照的I/III期IMpower133研究是证明PD-L1抑制剂阿特朱单抗加卡铂和依托泊苷(etoposide)相比于安慰剂加化疗在ES-SCLC中的生存获益的首项试验[1]。两个治疗组的中位OS为12.3与10.3个月(HR,0.70;p = 0.007),伴有可耐受的安全性特征。基于这些结果,阿特朱单抗加卡铂和依托泊苷已获准用于ES-SCLC患者的一线治疗。
Reck等人介绍了额外的9个月随访(中位随访,22.9个月)后IMpower133的更新OS发现[2]。在ITT人群中,阿特朱单抗加化疗产生持续的OS改善(中值,12.3与10.3个月;HR,0.76;p = 0.0154)。在18个月时进行的标志分析证明实验组中13 %的生存优势(34.0 %与21.0 %)。根据作者的结论,这些结果进一步支持将阿特朱单抗与化疗的组合用作整个患者人群中未经治疗的ES-SCLC的新标准治疗。
CASPIAN和IMpower133的附加分析
类似地,全球性随机化开放标签III期CASPIAN研究显示了在初治ES-SCLC患者中,一线度伐鲁单抗(durvalumab)加依托泊苷加铂类化疗(EP)相比于单独EP在OS方面统计上显著的改善(中位OS,13.0与10.3个月;HR,0.73;p = 0.0047)[3]。未注意到附加毒性。在2019年ESMO大会上,Paz-Ares等人报告了CASPIAN试验中的首次进展模式和患者报告结果[4]。该分析表明,与对照组相比,度伐鲁单抗治疗组中在数值上有更少的患者在首次进展时出现新病灶(41.4 %与47.2 %)。但是,在新的脑部/CNS病灶方面未发现差异(11.6 %与11.5 %)。与疗效结果一致,包括至所有症状恶化的时间、作用性和健康相关生活质量在内的所有患者报告结果相比于单独EP都更有利于度伐鲁单抗+ EP。
IMpower133和CASPIAN均基于生物标志物表达分析了生存情况。IMpower133的探索性分析包括PD-L1免疫组织化学和血液肿瘤突变负荷的评估,表明患者从添加阿特朱单抗中获得OS获益,而与生物标志物状态无关[2]。然而,PD-L1评估所基于的数据集有限,因为仅有34 %的ITT人群是PD-L1可评价的。同样,CASPIAN显示PD-L1表达与临床结果之间无显著相互作用[4]。51.6 %患者的PD-L1状态可评价。PD-L1表达较低,其中分别有94.9 % 和77.6 %显示肿瘤细胞和免疫细胞中水平< 1 %。两项试验的作者均得出结论认为,需要进一步分析来评价潜在生物标志物与ES-SCLC患者临床结果的关联。
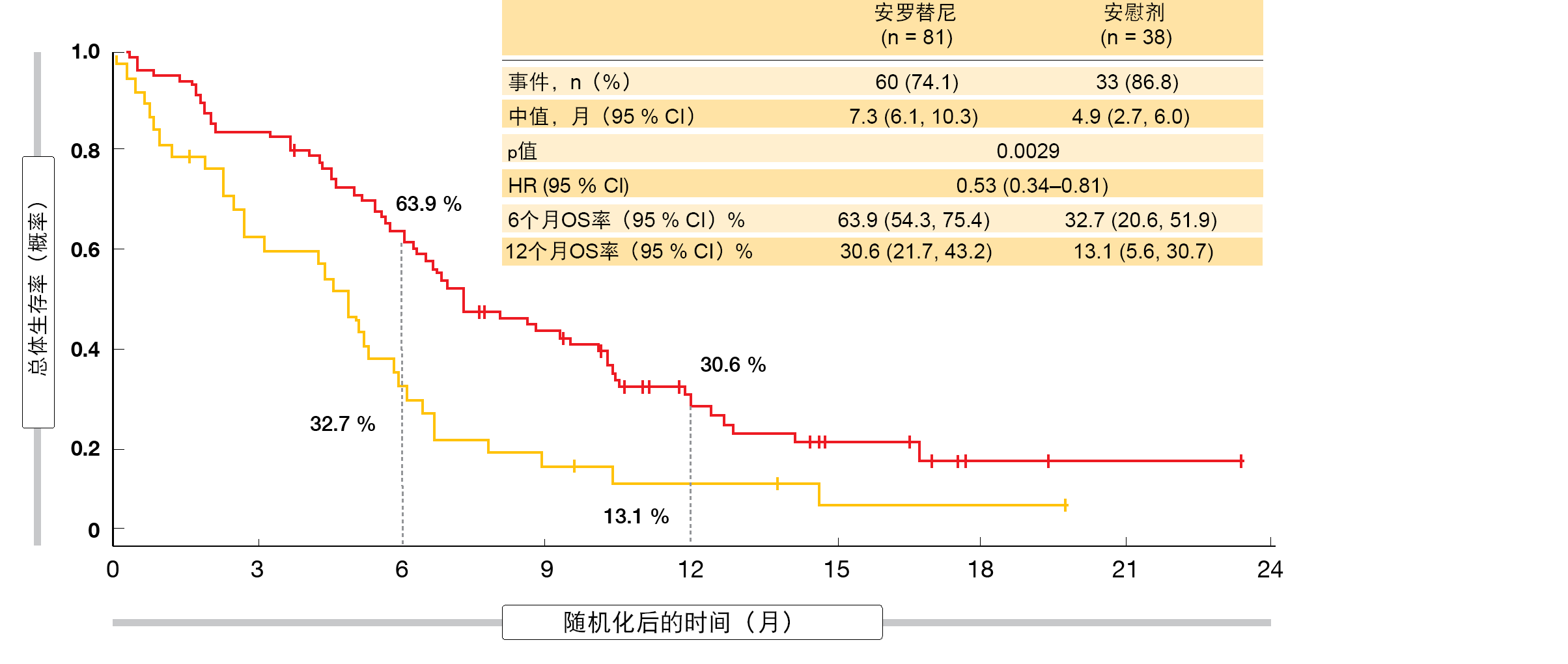
三线及后线:安罗替尼(anlotinib)
多靶点TKI安罗替尼通过选择性地抑制各种生长因子受体而起作用,这些受体增强促血管生成途径以及肿瘤增殖,并在SCLC中表达水平提高。多中心随机化双盲II期ALTER1202试验在≥ 2线化疗后发生进展的局限期SCLC或ES-SCLC患者中评估了安罗替尼。先前分析已显示与安慰剂相比的显著PFS改善(4.1与0.7个月;HR,0.19;p < 0.0001)[5]。当时,关于生存期的发现尚未成熟。 根据在2019年ESMO大会上介绍的更新OS结果,安罗替尼显著优于安慰剂,中位OS为7.3与4.9个月(HR,0.53;p= 0.0029;图)[6]。6个月(63.9 %与32.7 %)和12个月(30.6 %与13.1 %)时安罗替尼的生存率均超过安慰剂的观察结果。大多数亚组获益于积极治疗。具有脑转移的患者显示死亡率降低了77%(中位OS,6.3与2.6个月;HR,0.23;p = 0.0009)。在该队列中,6个月存活率为55.7 %与0 % 。
ALTER1202是证明在至少两条治疗线后经历治疗失败的复发性SCLC患者的生存优势的首项随机化双盲研究。作者建议,应考虑将安罗替尼作为二线或后线化疗后进展的SCLC患者的新标准治疗。
图:ALTER1202:在接受过两线或更多线先前化疗治疗的患者中,安罗替尼相比于安慰剂的总体生存率优势
参考文献
- Horn L et al., First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379: 2220-2229
- Reck M et al., IMPOWER133: Updated overall survival analysis of first line atezolizumab + carboplatin + etoposide in extensive stage SCLC. ESMO 2019, abstract 1736O
- Paz Ares L, et al. Overall survival with durvalumab plus etoposide-platinum in first-line extensive-stage SCLC: results from the CASPIAN study. WCLC 2019, abstract PL02.11
- Garassino MC et al., PD-L1 expression, patterns of progression and patients reported outcomes with durvalumab plus platinum etoposide in ES SCLC: results from CASPIAN. ESMO 2019, abstract LBA89
- Cheng Y et al., Anlotinib as third-line or further-line treatment in relapsed SCLC: a multicenter, randomized, double-blind phase 2 trial. J Thorac Oncol 2018; 13(10): S351-S352
- Cheng Y et al., Overall survival update in ALTER 1202: anlotinib as third line or further line treatment in relapsed SCLC. ESMO 2019, abstract 1738O
More posts
即便是罕见的可操作驱动因子也至关重要
即便是罕见的可操作驱动因子也至关重要 Stephen Liu,MD, 美国华盛顿特区乔治城大学伦巴狄综合癌症中心 在NRG1定向治疗的临床评估方面,我们如今进展如何? N
CNS疾病不妨碍成功治疗
CNS疾病不妨碍成功治疗 诊断时的神经症状负荷影响生存 脑转移在约35 %的转移性NSCLC患者中有发生,并与多种神经症状以及不良预后相关[1]。然而,关于诊断时CNS病灶
罕见突变ALK、ROS1、NTRK、NRG1条件下的创新
罕见突变ALK、ROS1、NTRK、NRG1条件下的创新 BFAST:基于血液的NGS作为独立测试 致癌基因定向治疗需要分子检测,但是众所周知,与组织收集和基于组织的测试有
探索抗血管生成药物与免疫疗法之间的协同作用
探索抗血管生成药物与免疫疗法之间的协同作用 在无可操作驱动突变的非鳞状晚期NSCLC的条件下,免疫检查点抑制剂治疗的出现导致新标准的实施。可以预计来自抗血管生成治疗的协同作
EGFR和血管生成靶向药物的前线组合
EGFR和血管生成靶向药物的前线组合 在未经治疗的EGFR突变肿瘤患者中,已显示向第一代EGFR TKI添加抗VEGF抗体贝伐珠单抗(bevacizumab)会引起PFS获
EGFR阳性肿瘤:多线中的最佳疗法问题
EGFR阳性肿瘤:多线中的最佳疗法问题 FLAURA:一线奥希替尼(osimertinib)的OS 在晚期EGFR阳性NSCLC患者中,EGFR酪氨酸激酶抑制剂(TKI)代