EGFR和血管生成靶向药物的前线组合
在未经治疗的EGFR突变肿瘤患者中,已显示向第一代EGFR TKI添加抗VEGF抗体贝伐珠单抗(bevacizumab)会引起PFS获益,且具有可接受的毒性特征[1,2]。开放标签随机化多中心III期ARTEMIS(CTONG 1509)研究是在中国NSCLC患者中测试贝伐珠单抗加厄洛替尼的首项III期试验[3]。在中国的14个地点,共311名EGFR突变(即外显子19缺失或外显子21 L858R突变)晚期NSCLC患者接受贝伐珠单抗加厄洛替尼(n = 157)或厄洛替尼(n = 154)直至进展。根据独立审查委员会(IRC)的PFS构成主要终点。
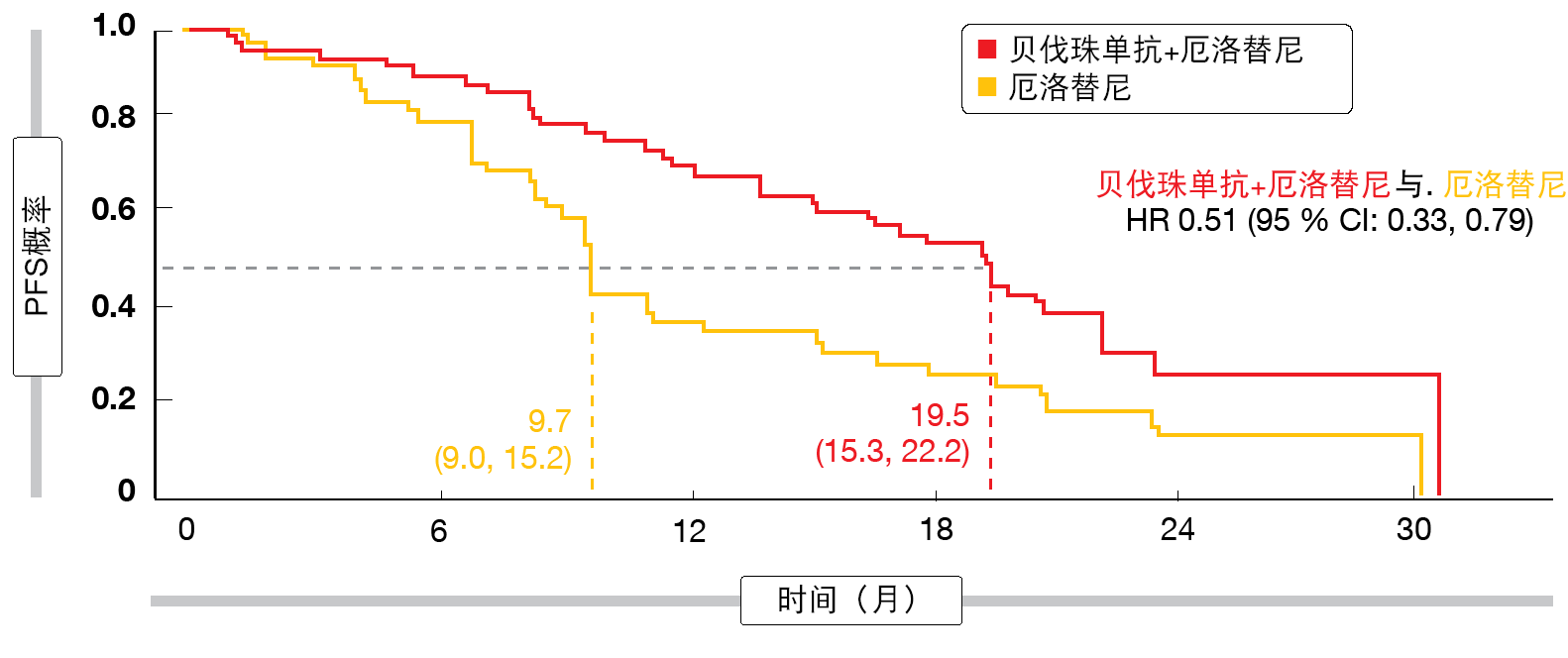
PFS差异高达10个月
贝伐珠单抗的添加确实引起了统计上显著且临床上相关的PFS改善(18.0与11.3个月;HR,0.55;p < 0.001)。亚组分析显示,具有L858R突变的患者和在基线时具有脑转移的患者似乎从组合方法得到特别的PFS获益。对于L858R突变组(约占总队列的一半),根据IRC的中位PFS为19.5与9.7个月(HR,0.51;图),因此超过了缺失19所观察到的PFS发现(17.9与12.5个月;HR,0.62)。缓解率广泛较高,且在治疗组之间无差异。根据IRC的ORR为86.3 %与84.7 %,疾病控制发生率为95.9 %与96.5 %。然而,贝伐珠单抗加厄洛替尼的缓解持续时间长于单独厄洛替尼(根据IRC为16.6与11.1个月;HR,0.59)。与组合疗法有关的不良事件证明是可耐受且可控的。未检测到新的安全性信号。
该研究包括耐药性生物标志物分析,涉及使用新一代测序和转录组测序对组织样品进行测试。在进展时,组合组与厄洛替尼组相比鉴定出EGFR T790M耐药性突变的频率更低(33 %与42 %)。此外,实验组患者显示出较小比例的新突变和扩增,这意味着不同的耐药机制。作者得出结论认为,贝伐珠单抗加厄洛替尼有望成为治疗晚期EGFR突变NSCLC的新一线标准。
图:携带外显子21 L858R突变的患者中观察到的贝伐珠单抗加厄洛替尼的无进展生存期获益
RELAY中的耐药机制
作为EGFR靶向药物的组合伴侣进行研究的另一种抗血管生成药物是抗VEGF-2抗体雷莫芦单抗(ramucirumab)。在全球性III期RELAY试验中,将EGFR突变阳性NSCLC患者随机分配为雷莫芦单抗联合厄洛替尼或安慰剂加厄洛替尼。与厄洛替尼单药治疗相比,组合使中位PFS得到显著程度的改善(19.4与12.4个月;HR,0.591;p < 0.0001)[4]。一项探索性日本RELAY亚研究关注T790M突变作为获得性耐药机制的发生和临床效应[5]。使用来自治疗前、治疗期间和疾病进展后收集的血浆样品的ctDNA测定EGFR突变。生物标志物可评价人群包括65名个体。 根据该分析,进展后的T790M突变率在治疗组之间并无差异,但组合组具有PFS优势。在根据进展前的治疗周期数进行分析时,雷莫芦单抗加厄洛替尼的T790M率相对于厄洛替尼更低,尽管这并不显著。因此,该组合可能延迟由T790M突变引起的耐药性产生。在任一个治疗组中,T790M突变的存在与否均不会明显影响PFS。通过液滴数字聚合酶链反应检测的进展后T790M率与新一代测序检测到的总体意向治疗人群中的比率一致,表明在雷莫芦单抗加厄洛替尼进展后进行有效EGFR定向治疗的潜力。
贝伐珠单抗加阿法替尼
基于贝伐珠单抗与第二代EGFR TKI阿法替尼的组合可能提高疗效的假设,I期Okayama肺癌研究组试验1404在19名晚期EGFR阳性NSCLC患者中评估了阿法替尼加贝伐珠单抗作为前线治疗。疾病控制的证据包括于2018年报道的16名可评价患者中有13名发生缓解[6]。Ninomiya等人在2019年ESMO大会上介绍了次要终点,包括缓解率、PFS、OS和毒性[7]。
在27.4个月的中位随访后,PFS为24.2个月,并且尚未达到中位OS。PFS发现结果根据EGFR突变的类型没有差异(缺失19和L858R突变分别为24.2和23.8个月)。然而,ECOG PS 0的患者显示比PS 1的患者具有显著更长的PFS(未达到与13.4个月;p = 0.0192)。总人群中,ORR达81.3 %,其中完全缓解的发生率为6.3 %。
两年时,7名患者仍在接受治疗,5名因疾病进展而中止,4名因毒性而中止,3名因个人选择而中止。再次活检显示2个病例在进展时存在T790M突变,并给予奥希替尼。在不良事件中,痤疮样皮疹、腹泻、甲沟炎、蛋白尿和高血压最为常见。未观察到≥ 4级不良事件。将阿法替尼加贝伐珠单抗与单药阿法替尼进行比较的随机化试验正在进行。
参考文献
- Ichihara E et al., Phase II trial of gefitinib in combination with bevacizumab as first-line therapy for advanced non-small cell lung cancer with activating EGFR gene mutations: the Okayama Lung Cancer Study Group Trial 1001. J Thorac Oncol 2015; 10(3): 486-491
- Seto T et al., Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations (JO25567): an open-label, randomised, multicentre, phase 2 study. Lancet Oncol 2014; 15(11): 1236-1244
- Zhou Q et al., ARTEMIS (CTONG 1509): phase 3 study of bevacizumab with or without erlotinib in untreated Chinese patients with advanced EGFR-mutated NSCLC. WCLC 2019, abstract 1480O
- Nakagawa K et al., RELAY: A multinational, double-blind, randomized Phase 3 study of erlotinib in combination with ramucirumab or placebo in previously untreated patients with epidermal growth factor receptor mutation-positive metastatic non-small cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 9000)
- Nishio K et al., Impact of ramucirumab + erlotinib on EGFR mutations in circulation tumor DNA – the 1st report of a biomarker study in Japanese patients from RELAY: global phase 3 study of erlotinib + ramucirumab or placebo in 1L metastatic NSCLC with EGFR activating mutations. ESMO 2019, abstract 1523P
- Ninomiya T et al., A phase I trial of afatinib and bevacizumab in chemo-naïve patients with advanced non-small-cell lung cancer harboring EGFR mutations: Okayama Lung Cancer Study Group Trial 1404. Lung Cancer 2018; 115: 103-108
- Ninomiya T et al., Updated analysis of a phase I trial of afatinib and bevacizumab in chemo-naïve patients with advanced non-small-cell lung cancer harboring EGFR mutations: OLCSG1404. ESMO 2019, abstract 1525P
More posts
即便是罕见的可操作驱动因子也至关重要
即便是罕见的可操作驱动因子也至关重要 Stephen Liu,MD, 美国华盛顿特区乔治城大学伦巴狄综合癌症中心 在NRG1定向治疗的临床评估方面,我们如今进展如何? N
CNS疾病不妨碍成功治疗
CNS疾病不妨碍成功治疗 诊断时的神经症状负荷影响生存 脑转移在约35 %的转移性NSCLC患者中有发生,并与多种神经症状以及不良预后相关[1]。然而,关于诊断时CNS病灶
罕见突变ALK、ROS1、NTRK、NRG1条件下的创新
罕见突变ALK、ROS1、NTRK、NRG1条件下的创新 BFAST:基于血液的NGS作为独立测试 致癌基因定向治疗需要分子检测,但是众所周知,与组织收集和基于组织的测试有
探索抗血管生成药物与免疫疗法之间的协同作用
探索抗血管生成药物与免疫疗法之间的协同作用 在无可操作驱动突变的非鳞状晚期NSCLC的条件下,免疫检查点抑制剂治疗的出现导致新标准的实施。可以预计来自抗血管生成治疗的协同作
EGFR和血管生成靶向药物的前线组合
EGFR和血管生成靶向药物的前线组合 在未经治疗的EGFR突变肿瘤患者中,已显示向第一代EGFR TKI添加抗VEGF抗体贝伐珠单抗(bevacizumab)会引起PFS获
EGFR阳性肿瘤:多线中的最佳疗法问题
EGFR阳性肿瘤:多线中的最佳疗法问题 FLAURA:一线奥希替尼(osimertinib)的OS 在晚期EGFR阳性NSCLC患者中,EGFR酪氨酸激酶抑制剂(TKI)代