早期NSCLC:期待を持てる(ネオ)アジュバント療法
NEOSTAR試験
切除可能な非小細胞肺がん(NSCLC)のⅠ期からⅢ期と診断された患者の半数以上は再発するため、効果の高い治療法が求められている[1]。転移巣の広がりと転移後の生存にはPD-L1のupregulationが非常に重要になることを、Chenらが動物モデルを参照して示した[2]。この点を念頭に置いて、ネオアジュバント療法に免疫療法を行った場合の有効性などを、複数の臨床試験で検証している。
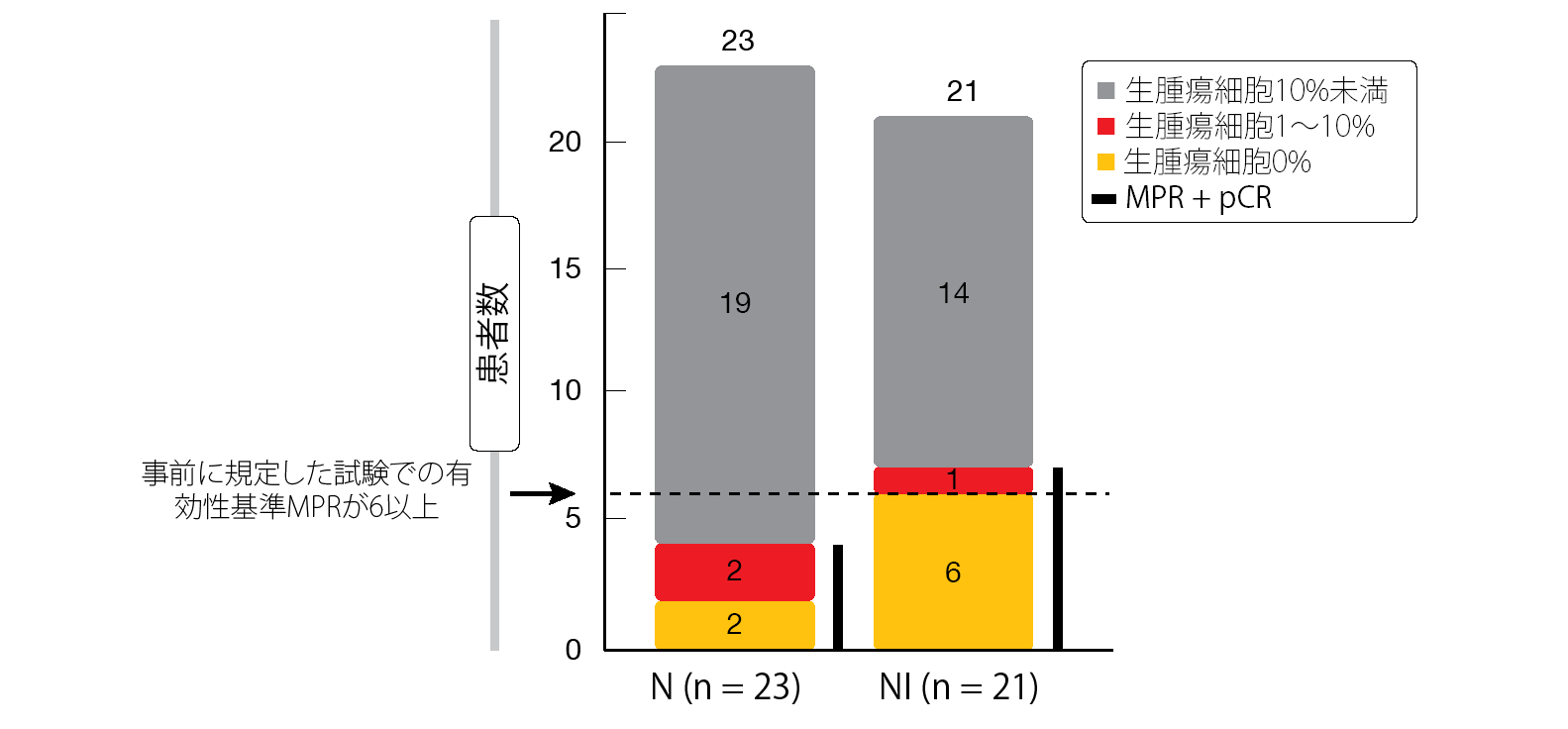
第Ⅱ相ランダム化比較NEOSTAR試験では、手術を受ける予定のⅠ期からⅢA期のNSCLC患者44人が対象になった[3]。この44人を1、15、29日目にニボルマブ3 mg/kgを1回ずつ投与する群と、1日目のみイピリムマブ1 mg/kgを追加する群とにランダムに割り付け、最終投与日から3~6週間後に手術を行った。病理学的奏効(MPR、腫瘍の生細胞は10%以下)を主要評価項目とした。これまでの対照群に比べて、ニボルマブ単独やイピリムマブとの併用によって、患者が導入化学療法後に達成されたMPRよりも改善すると推測した。ITT解析対象集団にもなった患者44人のうち、ニボルマブ単独群に割り付けられたのは23人、ニボルマブ・イピリムマブ併用群に割り付けられたのは21人だった。また、手術を受けたのは39人である。
臨床的有用性と浸潤するT細胞の増加
併用群に見られたMPR率は、事前に規定した同試験での有効性の基準に達していた。ITT解析対象集団の場合、ニボルマブ・イピリムマブ併用群の33%が、MPRと病理学的完全奏効(pCR、腫瘍の生細胞は0%)と判定された(図1)。ニボルマブ単独群では17%がpCRの判定を受けた。手術を受けた併用群の患者の場合、MPRの判定を受けた患者とpCRの判定を受けた患者は合計で44%になり、このうちの38%をpCRの判定が占めた(ニボルマブ単独群の場合は合計で19%)。ITT解析対象集団の、RECISTガイドラインに基づいた画像上の全奏効率(ORR)はそれぞれ19%と22%となった。併用群の1人(5%)が完全奏効(CR)の判定を受け、両群では合計で8人(36%)が部分奏効(PR)の判定を受けた。
なお、許容できない毒性も、術前の罹患率・死亡率の上昇も認められていない。ただ、腫瘍とは区別する必要のある肉芽腫の発現により、結節部での増悪が画像に現れる可能性があるので、ネオアジュバント療法の場合、nodal immune flare(免疫チェックポイント阻害薬をネオアジュバント療法に用いた場合に現れる画像所見)に注意が必要だと著者らは述べた。医師がnodal immune flareと病勢進行とを取り違えてしまうと、治癒につながるかもしれない手術を中止することにもなりうるので、この点は非常に重要である。
RECISTガイドラインによる効果判定とMPR率には正の相関性が見られた。ベースライン時のPD-L1の発現率の高さと、画像的奏効そして腫瘍の病理学的退縮とに相関性を認めた。奏効率の改善が見られたため手術で摘出した腫瘍の検体にフローサイトメトリーを行い、そこで特定した免疫上の特性からは、併用療法には、CD3陽性の腫瘍浸潤リンパ球だけでなく、組織のレジデントT細胞やエフェクターメモリーT細胞の高発現にも関係していることが判明した。また、併用療法はT細胞レパートリーや腫瘍への反応を上昇させていた。
図1:NEOSTAR試験:ニボルマブ単独療法群(N)とニボルマブ+イピリムマブ併用療法群(NI)の病理学的奏効率
アテゾリズマブ単独療法: LCMC3試験
多施設共同第Ⅱ相LCMC3試験では現在、IB期、II期、IIIA期、選択された切除可能IIIB期、そして治療歴のないNSCLC患者を対象に抗PD-L1抗体薬のアテゾリズマブを評価している(参加予定数:180人)。術前にアテゾリズマブ2コースを行い、MPRを主要評価項目とした。本学会ではKwiatkowskiらが、有効性に関する中間解析結果を発表した [4]。この時点での安全性解析対象集団は101人である。そのうちの90人(89%)が手術を受けたため、この人数を手術に関する解析対象集団とした。手術を受けた患者84人(83%)のMPRを判定した。EGFR遺伝子変異陽性およびALK融合遺伝子陽性の判定を受けた患者を除くと、主要有効性解析集団は77人(76%)となった。安全性解析対象集団の46%の患者はⅢA期またはⅢB期で、51%にはPD-L1の発現が認められた。
手術を受けた患者の場合、PRの判定を受けたのは7%、安定(SD)の判定を受けたのは89%となった。主要評価項目の対象集団の場合は、MPR率が19%に上り、pCRの判定を受けたのは5%だった。49%の患者から摘出した腫瘍の検体に50%以上の病理学的退縮が見られた。進行期のがん患者が多数を占めたことを考慮すると、この成績には期待が持てると著者らは評価している。RECISTガイドラインに照らすと、病理学的退縮と腫瘍のサイズの変化にはある程度の相関性があった。MPRと病理学的退縮は、PD-L1の発現と遺伝子変異量の変化に関わらず生じた。また、遺伝子変異とMPRとの間に有意性のある関係は認められなかった。アテゾリズマブ単独療法の忍容性は高く、安全性に警鐘を鳴らすような新たな事象も起きなかった。今回の中間解析結果が有効性の基準を超えていたため、参加者の募集を続けている。プラチナ製剤ベースの化学療法にアテゾリズマブを追加した療法を検証する、第Ⅲ相プラセボ対照試験であるIMpower130試験も続行中である。
免疫化学療法:pCRが71%に
複数の薬剤を併用するネオアジュバント療法を、非盲検多施設共同第Ⅱ相単群NADIM試験で検証している[5]。ⅢA期の切除可能なNSCLC患者に、ニボルマブ360 mgにパクリタキセル+カルボプラチンの化学療法を組み合わせたものを3コース行った。3コース目(21日目)から3週後もしくは4週後に手術を行い、その後、ニボルマブを用いるアジュバント療法を合計で1年間続けた。ITT解析対象集団の患者46人のうち、41人が手術を受けた。
ニボルマブと化学療法を併用した場合の、忍容性の高さも証明された。病勢進行や毒性が原因で手術の実施を前に同試験から脱落する患者はなく、手術を延期する患者もいなかった。術中の合併症はなく、術後に生じた合併症は治療が可能なものだった。ネオアジュバント療法により、ほとんどすべての患者が臨床的奏効を示した。CRと判定された患者は6.5%、PRと判定された患者は72%、 SDの判定を受けた患者は17.5%であ る。病理学的奏効を認めたのは85.36%で、pCR率が71.4%というのはこれまでに見られたことのない率である。病理学的ダウンステージが93%に見られた。
JIPANG試験:ペメトレキセドを用いるアジュバント療法の良好な結果
術後補助化学療法を行う場合、シスプラチンベースのどの治療レジメンに最大の効果があるのかという疑問に、ランダム化比較JIPANG試験が答えた[6]。腫瘍を完全に切除した、Ⅱ期からⅢA期の非扁平上皮非小細胞肺がん患者を、ペメトレキセド+シスプラチン群(n=389)またはビノレルビン+シスプラチン群(n=395)のどちらかにランダムに割り付けた。どちらの治療レジメンも最大で4コース行った。同試験は、ペメトレキセド+シスプラチンの術後補助化学療法としての有効性などを評価する、初めての第Ⅲ相試験である。
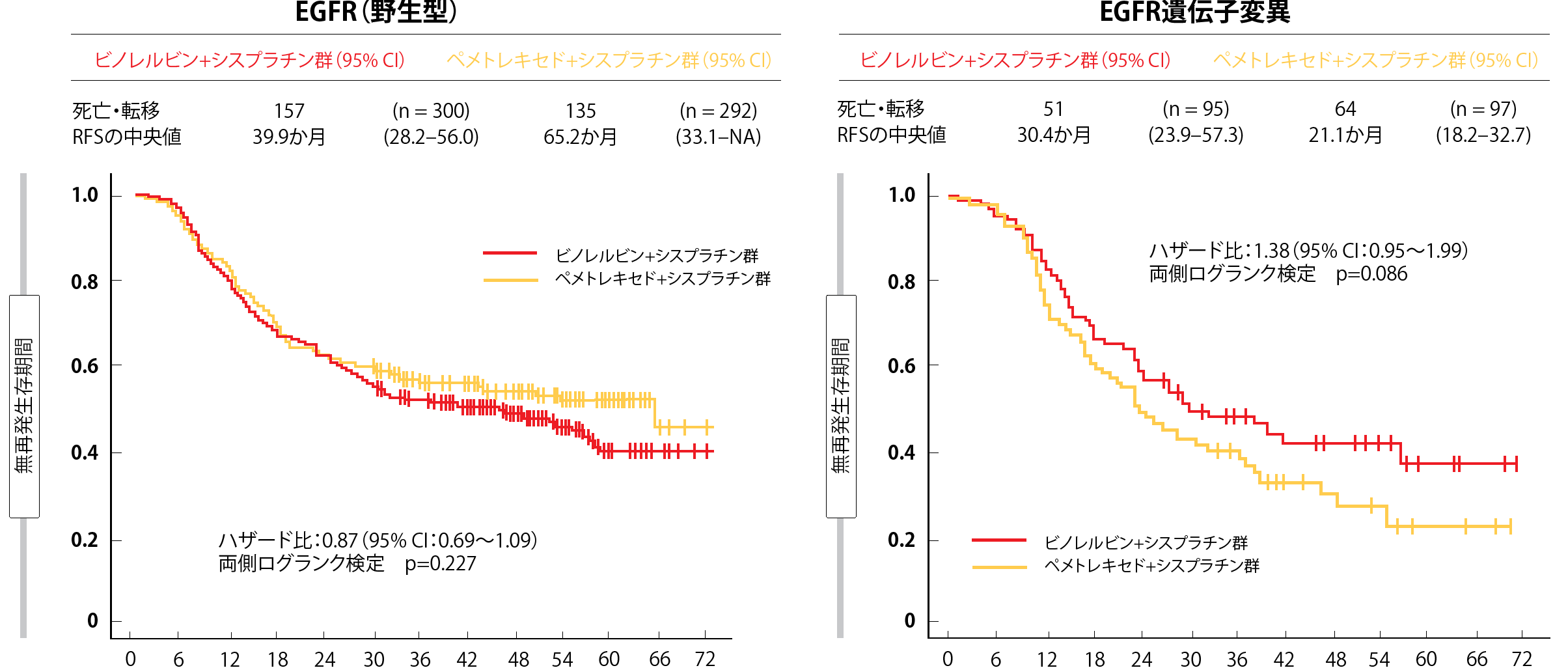
主要評価項目である無再発生存期間(RFS)については、ペメトレキセド+シスプラチン群に優越性は見られなかったが、有効性については、どちらの群もほぼ同様だった(RFSの中央値はペメトレキセド+シスプラチン群が38.9か月、ペビノレルビン+シスプラチン群が37.3か月、HR:0.98)。また、OSに関しても、両群に差異は見られなかった(HR:0.98)。RFS関連のサブグループ解析では、EGFR遺伝子変異を検出した患者ではビノレルビン+シスプラチン療法に良好な結果が見られる一方、野生型のEGFR遺伝子を検出した患者ではペメトレキセド+シスプラチン療法に良好な結果が見られている(図2)。
図2:野生型のEGFR遺伝子を検出した患者群ではペメトレキセド+シスプラチン併用療法に、EGFR遺伝子変異を検出した患者群ではビノレルビン+シスプラチン併用療法に無再発生存期間の延長がみられる。
その際、ペメトレキセド+シスプラチン療法の忍容性の方が高くなっていた。かなりの割合の患者が4コースを完遂した(ペメトレキセドは87.9%、ビノレルビンは72.7%)。毒性は軽度で、重篤な有害事象(AE)もグレード3~5のAEの発現率も低くなっていた。重度の血液学的有害事象の発現率に関しては、ペメトレキセド+シスプラチン群の方が統計学的有意に低くなっており(ペメトレキセドは24.7%、ビノレルビンは81.8%)、投与の中止率も低くなっていた(前者は9.5%、後者は23.5%)。以上のデータを基にすると、ペメトレキセド+シスプラチン療法は、Ⅱ期からⅢA期の非扁平上皮NSCLC患者、とりわけ野生型のEGFR遺伝子を検出した患者への術後補助化学療法の選択肢になる可能性がある。
EGFR TKIを用いるアジュバント療法
EGFR遺伝子変異を認める早期のNSCLCへの、EGFRチロシンキナーゼ阻害薬(TKI)を用いたアジュバント療法は、現在でも議論の的になっている。腫瘍を切除した、EGFR遺伝子変異を認めるNSCLC患者数の合計が1,152人に上る、11の臨床試験を対象にしたメタ解析から、EGFR TKIによるアジュバント療法を行わなかった場合と比べると、EGFR TKIがOS(OR:0.63、p=0.004)と無病生存期間(DFS、OR:0.56、p <0.00001)の双方を延長させたことをTangらが見いだした[7]。事前に定めていたサブグループ解析は、化学療法よりもEGFR TKIがDFSを延長させることを示唆したものの、OSには該当しなかった。化学療法単独と比べると、EGFR TKIと化学療法の併用がDFS(OR: 0.48、p<0.00001)とOS(OR:0.50、 p= 0.003)を統計学的有意に延長させた。また、EGFR TKIを投与した患者に発症したグレード3以上のAEは、化学療法を単独で行った患者のそれよりも少なくなっていた(OR:0.22、p<0.00001)。これらの知見を考慮すると、腫瘍を完全に切除しているEGFR遺伝子変異陽性NSCLC患者には、EGFR TKIを単独もしくは化学療法と併用する療法がアジュバント療法の選択肢になるかもしれない。
EGFR TKIを用いたアジュバント療法を行うかどうかという点に関しては、がん微小環境(TME)の変化が患者を選定する基準になるだろう。発現率が高くなるとEGFR遺伝子変異陽性患者のDFSの改善に関わる、TMEの主要な遺伝子をKhalilらが8種類特定した[8]。免疫プロファイルの特徴別に8つの遺伝子を2グループに大別した。1つのグループは、もう1つのグループに比べて、「炎症」の表現型がより多く見られた(リンパ球浸潤スコアの高さ、TGF-β応答性など)DFSおよび疾患特異的生存期間は両方とも、炎症型ではないグループに比べて炎症型グループで統計学的有意に延長していた。TMEの遺伝子別に患者を層別化すると、どの患者がアジュバント療法のベネフィットを得られるかを個別に判断できるかもしれないことが、このデータから読み取れた。
アファチニブの3か月投与と2年投与の比較
EGFR TKIを用いるアジュバント療法の至適実施期間について議論が続いているため、Ⅰ期からⅢ期のNSCLCの切除後に、一般的なアジュバント療法を最後まで受けた患者24人を対象に、アファチニブの1日1回投与を2年間続ける群(n=22)と3か月間続ける群(n=24)を、第Ⅱ相ランダム化比較試験で評価した[9]。参加者は60人を予定していたが、その数に達するのに時間がかかったため46人で締め切った。2年時点のDFSを主要評価項目とした。3か月間の投与に比べて2年間の投与により再発率が14%低下したが(2年時点のDFSは2年投与群が85%、3か月投与群が71%)、統計学的有意差は認められなかった。なお、両群ともDFSとOSの中央値の期間には達していない。
EGFR TKIによるアジュバント療法に関するこれまでの臨床試験によると、2年間投与群のかなりの患者が治療を最後まで受けておらず、その一番の理由は同意の撤回(23%)、次いで毒性(18%)、再発(9%)となっていた。TKIの忍容性は改善してきているが、アジュバント療法に用いる期間は大きな課題として残っていると、著者らは締めくくった。
免疫療法を用いる地固め療法の個別化
局所進行NSCLC患者への化学放射線療法(CRT)の実施後、分子微小残存病変の検出に血中循環腫瘍DNA(ctDNA)を利用する方法をModingらが調査した[10]。CRT実施後に免疫チェックポイント阻害薬を用いる地固め療法(CICI)を行うと、毒性だけでなく医療費も増すことになるが、ctDNAが検出不能な患者を除外できるかもしれないとModingらは仮説を立てた。根治的化学放射線療法を受けた、ⅡB期からⅢB期のNSCLC患者62人から検体を採取し、このうちの25人にCICIを行った。
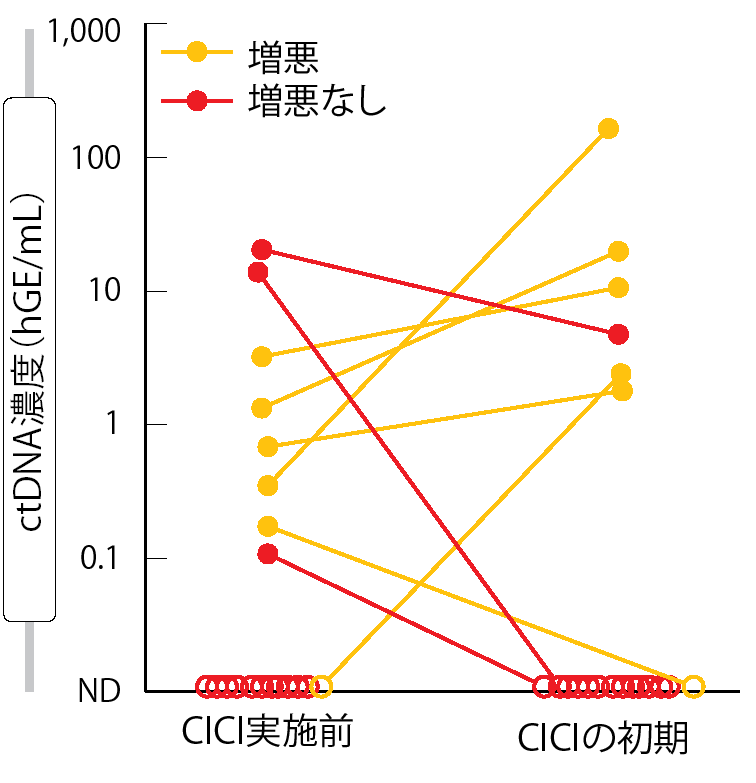
予想通り、ctDNAの存在には予測力があった。CRTの実施後にctDNAが検出不能だった患者群では、解析時にはまだ無増悪生存期間(FFP)の中央値に達していなかったものの予後は良好で、CICIの効果とは無関係だと思われた。CICIの初期段階に再評価したところ、ctDNA量の変化に応じてCICIに反応するか否かが判断できる可能性が示された。この段階では、ctDNAが検出不能な患者群のFFPの中央値には達していなかった。ctDNA量が減少した患者群のFFPの中央値は16.5か月で、増悪がなかったため、免疫療法の効果があったと考えられた(図3)。CICI開始後にctDNA量が増加した患者群の予後は最も悪く、FFPの中央値は0.4か月だった。この場合、急速な増悪は治療への反応の悪さを示している。
著者らは、ctDNAが存在している場合のみ、CRTの実施後にCICIを開始する治療アルゴリズムを提唱している。CICIの初期段階に別の解析を行って、ctDNA量にもよるが治療法を変更するか、あるいはCICIを継続するかどうかを判断する。CRTの実施後にctDNAが検出不能になった患者にはCICIは行わないが、画像検査に加えてctDNAをモニタリングする。CICIを個別化することへのctDNA解析の有用性を前向き臨床試験で証明する必要性があるのは、いうまでもない。
図3:術後補助化学放射線療法の実施後に免疫チェックポイント阻害薬を用いる地固め療法(CICI)を受けた患者の、ctDNAの変化量と臨床経過との相関性
参考文献:
- Pignon JP et al., Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008; 26(21): 3552-3559
- Chen L et al., Metastasis is regulated via microRNA-200/ZEB1 axis control of tumour cell PD-L1 expression and intratumoral immunosuppression. Nat Commun 2014; 5: 5241
- Cascone T et al., Neoadjuvant nivolumab or nivolumab plus ipilimumab for resectable non-small cell lung cancer (NSCLC): clinical and correlative results from the NEOSTAR study. J Clin Oncol 37, 2019 (suppl; abstr 8504)
- Kwiatkowski DJ et al., Neoadjuvant atezolizumab in resectable non-small cell lung cancer (NSCLC): interim analysis and biomarker data from a multicenter study (LCMC3). J Clin Oncol 37, 2019 (suppl; abstr 8503)
- Provencio M et al., Neo-adjuvant chemo-immunotherapy for the treatment of stage IIIA resectable non-small-cell lung cancer (NSCLC): a phase II multicenter exploratory study. Final data of patients who underwent surgical assessment (NADIM). J Clin Oncol 37, 2019 (suppl; abstr 8509)
- Kenmotsu H et al., Randomized phase III study of pemetrexed/cisplatin versus vinorelbine/cisplatin for completely resected non-squamous non-small-cell lung cancer. The JIPANG study. J Clin Oncol 37, 2019 (suppl; abstr 8501)
- Tang W et al., EGFR inhibitors as adjuvant therapy for EGFR mutation positive non-small cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 8508)
- Khalil M et al., The tumor microenvironment in EGFR-driven loco-regional lung adenocarcinoma can predict higher risk of recurrence. J Clin Oncol 37, 2019 (suppl; abstr 8521)
- Chaft JE et al., Randomized phase II study of adjuvant afatinib for 3 months versus 2 years in patients with resected stage I-III EGFR mutant NSCLC. J Clin Oncol 37, 2019 (suppl; abstr 8507)
- Moding EJ et al., ctDNA for personalization of consolidation immunotherapy in localized non-small cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 2547)
More posts
小細胞肺がん:セカンドライン治療の改善
再発性小細胞肺がん(SCLC)患者への治療の選択肢は非常に限られている。プラチナ製剤感受性肺がんのセカンドライン治療に、米食品医薬品局が承認した治療薬はトポテカンだけであるが、臨床的有用性が思わしくない割には、重度の血液学的毒性を引き起こしている。 活性化した発がん性転写因子を抑制することが新薬の開発につながるかもしれない。SCLCは転写因子に依存する腫瘍であることが分かっている。Rudinらが、4種類の主な転写制御因子の発現差異別に、SCLCの遺伝子のサブタイプを分類した。
まれな遺伝子変異:治療を一歩先へ進める
NSCLC患者の3%から4%にMETエクソン14スキップ変異(METex14)を認める、という報告がある。この遺伝子変異は予後だけでなく、免疫療法といった標準治療への反応が不良になることと関係している。その上、MET遺伝子変異のある患者は高齢であることが多いため、忍容性を改善する対策が必要になる。カプマチニブは、非常に高い選択性とMET阻害作用を持つ薬剤として開発されており、MET遺伝子変異を生じさせたがん動物モデルに対してin vitroとin vivoの両方で効果を示している。
ALK融合遺伝子陽性NSCLCにおける血液検体を用いたリキッドバイオプシー
血液検体を用いる診断検査というのは肺がんの診断だけでなく、遺伝子変異の予測にも利用できます。肺がんの場合は現在、患者個人のDNAにどのような変異があるかによって、細かくいくつものサブグループに分類しています。現在の技術をもってすれば、組織中の遺伝子変異はもとより血液中の遺伝子変異も検出可能です。
臨床試験の最新結果および免疫療法の新規バイオマーカー
KEYNOTE-001試験は、進行NSCLCの治療歴のない患者と治療歴のある患者に抗PD-L1抗体薬ペムブロリズマブの作用が見られた、初の臨床試験である[1]。このマルチコホート第IB相試験では、腫瘍細胞のうちPD-L1発現が陽性になる細胞の割合を表すTPSがペムブロリズマブ群で上昇し、より大きな効果が示された。2012年の5月から2014年の7月にかけて、進行NSCLC患者550人が非ランダム化比較試験の4試験と、ランダム化比較試験の2試験の患者コホートとして組み入れられた。
EGFR遺伝子変異陽性肺がんへの新規第一選択薬およびその他の知見
EGFR遺伝子変異陽性肺がん患者には、EGFR TKIがおおむね有効だが、投与開始後8~12か月以内に耐性を獲得することは避けられず、治療がうまくいかない原因となっている。EGFR阻害薬の活性を延長させる選択肢のないところが、アンメットニーズになっている。VEGFとEGFRのシグナル伝達経路をダブルでブロックする方法が、このアンメットニーズへの解決策になる可能性がある。
早期NSCLC:期待を持てる(ネオ)アジュバント療法
切除可能な非小細胞肺がん(NSCLC)のⅠ期からⅢ期と診断された患者の半数以上は再発するため、効果の高い治療法が求められている[1]。転移巣の広がりと転移後の生存にはPD-L1のupregulationが非常に重要になることを、Chenらが動物モデルを参照して示した[2]。この点を念頭に置いて、ネオアジュバント療法に免疫療法を行った場合の有効性などを、複数の臨床試験で検証している。